

湖南省衡阳市衡阳县第一中学2024-2025学年高二上学期11月期中考试化学试卷(Word版附解析)
展开
这是一份湖南省衡阳市衡阳县第一中学2024-2025学年高二上学期11月期中考试化学试卷(Word版附解析),共18页。
一、单选题(每题3分,共42分)
1.下列生产生活中的应用与盐类水解原理无关的是( )
A.明矾净水B.草木灰去油污
C.配制溶液时,加入一些铁粉D.氯化铵除铁锈
2.已知热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·ml−1,下列说法错误的是( )
A.H2的燃烧热为285.8 kJ·ml−1
B.能量图:
C.2H2(g)+O2(g)=2H2O(g) ΔH>-571.6 kJ·ml−1
D.1 ml H2和2 ml H2的燃烧热相同
3.在一密闭容器中发生反应,3min达到平衡状态,增加了0.6ml∙L−1,下列说法正确的是( )
A.0~3min,
B.在2min末,
C.第4min时,和表示的反应速率的值相等
D.若相同时间内,,则这两段时间内反应速率相等
4.下列说法中,正确的是( )
A.H2O(1)分解成H2(g)和O2(g)是熵增过程,该反应在室温下是自发反应
B.吸热反应一定不能自发进行
C.某条件下,反应2AB(g)=C(g)+3D(g) ΔH Si。
(1)上述反应仍能发生的原因是 。
(2)由下图,推测上述反应正向为 (填“吸热”或“放热”)反应;平衡后若其他条件不变,将还原炉体积缩小一半,则达到新平衡时的浓度将 (填“升高”、“降低”或“不变”)。
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,下列说法正确的是___________。
A.反应物不再转化为生成物
B.炉内与CaO·MgO的质量比保持不变
C.气体密度变大
D.单位时间内,
(4)若还原炉容积为,原料中煅白质量为9.6t,5小时后,测得煅白的转化率为50%,计算这段时间内Mg的生成速率 。
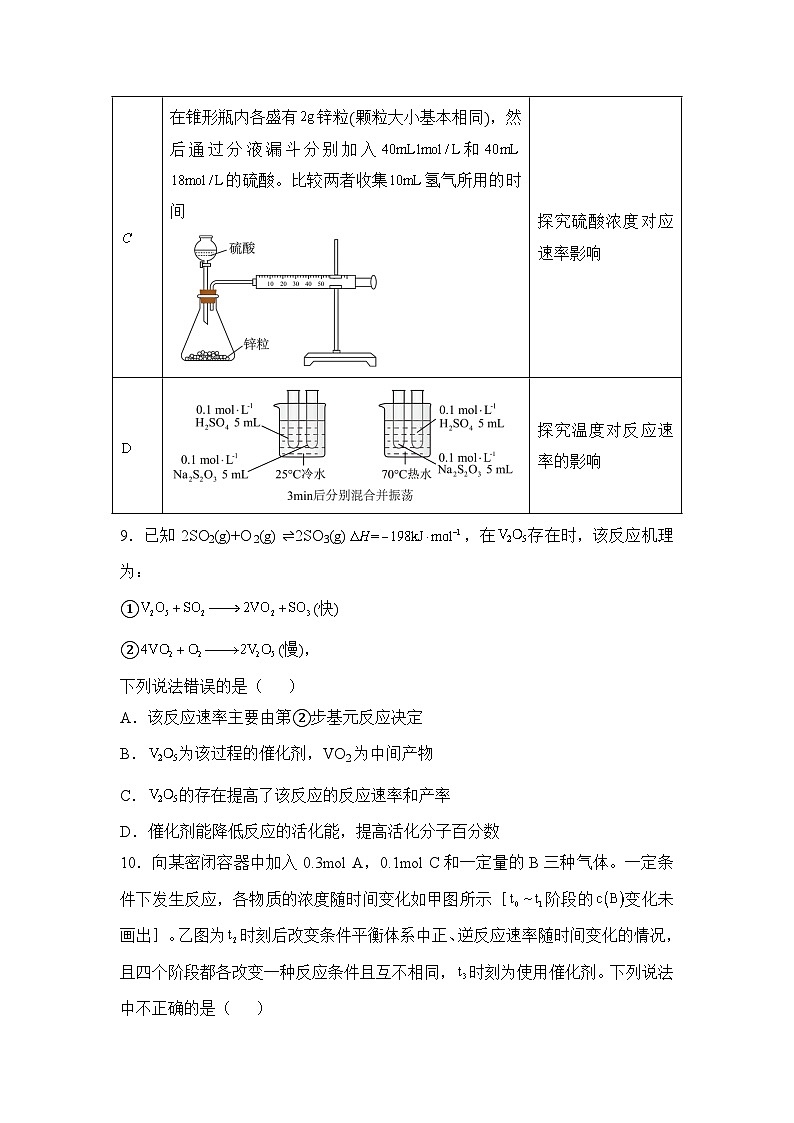
17.某化学小组欲定量探究含对溶液发生分解时化学反应速率的影响,该小组先取溶液利用如图装置进行实验,得到了如表数据:
说明:①表中是折合成标准状况下的体积:
②假设反应过程中溶液体积的变化忽略不计。
(1)检查该装置气密性的操作为 。
(2)0~6min的平均反应速率: (保留两位有效数字),0~6min的平均反应速率 6~10min的平均反应速率(填“>”“-571.6 kJ·ml-1,故C项正确;D.燃烧热的概念就是1ml可燃物完全燃烧生成指定稳定的物质放出来的热量,所以不管是多少摩尔氢气,燃烧热都是一样的,故D项正确;故本题选B。
3.【答案】C
【解析】A.由反应方程式可知,A呈固态,不能用A的浓度变化表示反应速率,A不正确;B.反应进行3min时,达到平衡状态,增加了0.6ml∙L-1,则 ,此速率表示反应进行3min内的平均速率,不等于2min末的速率,B不正确;C.3min达到平衡状态,此时==,第4min时反应仍保持平衡状态,所以和表示的反应速率的值相等,C正确;D.由于B、D的化学计量数不等,所以表示反应进行到不同阶段时的反应速率,则这两段时间内反应速率不相等,D不正确;故选C。
4.【答案】C
【解析】A.H2O(1)分解成H2(g)和O2(g)是熵增、吸热的过程,根据,该反应在高温条件下进行,A错误;B.根据反应自发进行可知,反应能否自发进行由焓变、熵变及反应温度共同决定,B错误;C.该反应、,根据反应自发进行可知,该反应一定能自发进行,C正确;D.该反应、,根据反应自发进行可知,该反应低温有利于自发进行,D错误;答案选C。
5.【答案】A
【解析】A.pH=13,则c(OH-)=0.1ml/L,n(OH-)=c(OH-)×V=0.1ml/L×1L=0.1ml,即0.1NA,A正确;B.盐酸和醋酸的物质的量均为0.2ml,但醋酸为弱酸,在溶液中部分电离,所以醋酸溶液中H+数目小于0.2NA,B错误;C.SO2和O2反应为可逆反应,达到平衡时分子总数目大于2NA,C错误;D.2.3g Na物质的量为0.1ml,与O2完全反应,化合价升高1价,转移电子数为0.1NA,故D错误;故选A。
6.【答案】B
【解析】A.水电离产生的,说明水的电离被促进,该溶液可能为水解显酸性或碱性的盐溶液。酸性条件下,、发生氧化还原反应,不能大量共存。碱性条件下,不能大量共存,A错误;B.能使甲基橙显橙色的溶液显酸性,该溶液中、、、能大量共存,B正确;C.的溶液显酸性,该溶液中不能大量共存,C错误;D.和在溶液中发生双水解反应,不能大量共存,D错误。答案为B。
7.【答案】A
【解析】A.pH相等的NaOH和Na2CO3溶液中,c(OH-)相同,NaOH为强碱,在水溶液中完全电离,c(NaOH)= c(OH-),而Na2CO3为强碱弱酸盐,在水溶液中只发生部分水解,所以c(Na2CO3)>c(OH-),所以c(NaOH)<c(Na2CO3),故A项错误;B.稀释0.1ml/L醋酸溶液,醋酸的浓度减小,其电离程度增大,但c(H+)减小,所以pH 增大,故B项正确;C.AlCl3在水溶液中存在下列水解平衡:,溶液蒸干灼烧过程中,HCl挥发,Al(OH)3分解,所以最后得到的固体是Al2O3,故C项正确;D.分别用等体积的蒸馏水和稀硫酸洗涤 BaSO4 沉淀,因为稀硫酸中存在一定浓度的,对BaSO4的沉淀的溶解有抑制作用,从而减少BaSO4在水中的溶解,所以用水洗涤造成 BaSO4 的损失量大于用稀硫酸洗涤时的损失量,故D项正确;故本题选A。
8.【答案】D
【解析】A.浓度不同,阴离子不同,无法比较Cu2+和Fe3+的催化效率,A错误;
B.两组实验中草酸均不足量,高锰酸钾均无法褪色,B错误;C.18ml·L-1的硫酸为浓硫酸,浓硫酸锌粒反应生成物为SO2,无H2产生,无法比较产生H2的速率,C错误;D.该组实验中只有温度不同,可以用来探究温度对反应速率的影响,D正确;故选D。
9.【答案】C
【解析】A.总反应速率由最慢的一步决定,该反应速率主要由第②步基元反应决定,故A项正确;B.反应前后V2O5的量没有改变,V2O5为该过程的催化剂,VO2为中间产物,故B项正确;C.反应前后V2O5的量没有改变,V2O5是该反应的催化剂,能提高反应速率,但不能提高平衡转化率与产率,故C项错误;D.反应前后V2O5的量没有改变,V2O5是该反应的催化剂,降低反应的活化能,提高该反应活化分子百分数,加快反应速率,故D项正确;故本题选C。
10.【答案】D
【解析】根据图乙可知,时刻为使用催化剂,正、逆反应速率均增大,且化学平衡不移动;阶段改变条件平衡不移动,且正、逆反应速率均减小,由于四个阶段都各改变一种反应条件且互不相同,且改变温度或浓度,平衡均发生移动,则阶段改变的条件为减小压强,反应为等体积反应;时刻正、逆反应速率中只有一个增大,应是改变某一物质的浓度;时刻正、逆反应速率都增大,应是升高温度。A.时,用A的浓度变化表示阶段的平均反应速率为,A正确;B.根据分析,阶段改变的条件为减小压强,B正确;C.根据图甲,A物质的起始浓度为,初始时密闭容器中加入0.3ml A,则该容器的容积为2L,C正确;D.根据图甲,A物质的转化量为,C物质的生成量为,则反应中物质A与C的化学计量数之比为;根据分析可知,减小压强,化学平衡不移动,说明该反应中气体的化学计量数之和前后相等,则化学方程式为;阶段,容器内A的物质的量减少了0.06ml,而此过程中容器与外界的热交换总量为a kJ,说明平衡正向移动,正反应为吸热反应,3mlA反应吸收的热量为,因此该反应的热化学方程式为,D错误;答案选D。
11.【答案】C
【解析】A.碳酸的Ka1小于磷酸的Ka1,所以碳酸的酸性弱于磷酸,故A正确;B.根据电离平衡常数,可知酸性H2CO3>HClO>,根据“强酸制弱酸”,将少量的气体通入溶液中生成碳酸氢钠和次氯酸,反应离子方程式为,故B正确;C.,常温下,加水稀释醋酸,不变,故C错误;D.平衡常数只与温度有关,向弱酸溶液中加少量溶液,电离平衡常数不变,故D正确;选C。
12.【答案】D
【解析】A.催化剂是先被反应掉再生成,中间产物是先生成,然后再被反应掉,根据流程可知,反应中Fe3+为催化剂,Fe2+是中间产物,故A正确;B.根据流程中信息可知,反应I的离子方程式为,故B正确;C.反应Ⅲ为4Fe(NO)2++O2+4H+=4Fe3++4NO+2H2O,只有Fe、O元素化合价发生变化,O2为氧化剂,Fe(NO)2+为还原剂,故氧化剂与还原剂的物质的量比为1∶4,故C正确;D.反应I的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2+16H+,反应Ⅲ的离子方程式为4Fe(NO)2++O2+4H+=4Fe3++4NO+2H2O,反应I、Ⅲ是氧化还原反应;反应Ⅱ的离子方程式为Fe2++NO=Fe(NO)2+,无元素化合价变化,为非氧化还原反应,故D错误;故答案选D。
13.【答案】C
【解析】随着pH的增大,1gc()、lgc(H+)逐渐减小,1gc()、lgc(OH-)逐渐增大,25℃pH=7时,lgc(H+)=lgc(OH-),故NP所在线代表1gc(),MO所在线代表lgc(H+),PQ所在线代表1gc(),OQ所在线代表lgc(OH-),据此分析判断。A.N点时,,A正确;
B.点过程中,c()逐渐增大,水解程度增大,水的电离程度逐渐增大,B正确;C.P点时,,若溶液为HCN与NaCN的混合溶液,则此时根据电荷守恒,,则此时,C错误;D.该溶液中,,又,联立两式消去并化简整理可得出,,D正确;故选C。
14.【答案】C
【解析】A.从20℃升温至30℃,的水解平衡正向移动,水解平衡常数增大,溶液中减小,A错误;B.向盐酸中加入氨水至中性,根据电荷守恒关系可得:,由于溶液中还存在分子,则,B错误;C.属于弱电解质,属于强电解质,两者电离产生的离子所带电荷数一致,由于的溶液比等浓度的溶液电离出的离子总浓度低,则导电能力弱,C正确;D.一元酸HA可能是强酸也可能是弱酸,若HA为强酸,则,若HA为弱酸,则,因此a与b的大小关系无法确定,D错误;答案选C。
15.【答案】(1)④ ⑧⑨
(2)be
(3)2×10﹣12 1∶1
【解析】(1)①熔融的能完全电离,属于强电解质;②稀硫酸是酸溶液,属于混合物,混合物既不是电解质也不是非电解质;③液氯是非金属单质,单质既不是电解质也不是非电解质;④冰醋酸在溶液中部分电离,属于弱电解质;⑤铜是金属单质,单质既不是电解质也不是非电解质;⑥溶于水的硫酸钡在溶液中完全电离,属于强电解质;⑦硫酸氢钠在溶液中能完全电离,属于强电解质;⑧液氨在溶液中自身不能电离,属于非电解质;⑨二氧化硫不能发生电离,属于非电解质;⑩氢氧化钙固体溶于水,在溶液中能完全电离,属于强电解质;则属于弱电解质的是④,属于非电解质的是⑧⑨,故答案为:④;⑧⑨;(2)a.醋酸和水能以任意比例混溶只能说明醋酸的溶解性,不能说明醋酸是弱酸,故错误;b.在醋酸水溶液中还含有未电离的醋酸分子说明醋酸是在溶液中部分电离的弱酸,故正确;c.醋酸与碳酸钠溶液反应放出二氧化碳气体只能说明醋酸的酸性强于碳酸,不能说明醋酸是弱酸,故错误;d.1ml/L的醋酸水溶液能使紫色石蕊溶液变红色只能说明醋酸溶液呈酸性,但不能说明醋酸是弱酸,故错误;e.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多说明醋酸的浓度大于盐酸,是在溶液中部分电离的弱酸,故正确;故选be;(3)Ⅰ.由图可知,该温度下,水的离子积常数Kw=1ml/L×10−15ml/L=1×10−15;水电离产生的氢离子浓度总是等于水电离产生的氢氧根离子浓度,由盐酸溶液中的氢离子浓度为5×10−4ml/L可知,水电离出的氢离子浓度为=2×10−12ml/L,故答案为:2×10−12;Ⅱ.①溶于水的电离方程式为;②由题意可知,氢氧化钡溶液和硫酸氢钠溶液中氢氧根离子浓度和氢离子浓度都为1×10−3ml/L,由所得混合溶液呈中性可得:1×10−3ml/L×V1L=1×10−3ml/L×V2L,解得V1∶V2=1∶1,故答案为:1∶1。
16.【答案】(1)1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动
(2)吸热 不变
(3)BC
(4)0.025
【解析】1200℃下发生反应,1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生。由下图可知,随温度升高,镁的产率增大,推测上述反应正向为吸热反应;因为该反应的K=c2(Mg),平衡常数只与温度有关,平衡后若其他条件不变,将还原炉体积缩小一半,平衡常数不变,则达到新平衡时的浓度将不变。A.反应物不再转化为生成物,说明反应停止,该反应为可逆反应,达到平衡时反应没有停止,故不选A;B.炉内与CaO·MgO的质量比保持不变,说明镁的浓度不再改变,反应达到平衡状态,故选B;C.气体密度变大,说明镁的浓度不再改变,反应达到平衡状态,故选C;D.单位时间内,,不能判断正逆反应速率是否相等,反应不一定平衡,故不选D;选BC。9.6t煅白的物质的量为 ,煅白的转化率为50%,则生成Mg蒸汽的物质的量为,若还原炉容积为,Mg的生成速率。
17.【答案】(1)关闭分液漏斗活塞,向外拉动注射器至一定位置,放开能够恢复到原来的位置,则证明气密性良好
(2) > 随着反应的进行,反应物浓度逐渐减小,化学反应速率降低
(3)不合理 阴离子种类不同 控制了阴离子浓度和种类一样,的浓度比小,出现反应更剧烈
【解析】根据题目所给图分析,锥形瓶为氧气发生装置,过氧化氢分解生成的氧气会前往注射器,注射器向外推动,则可以测量氧气的体积,据此分析题目;(1)要测量装置的气密性,需要关闭分液漏斗活塞,向外拉动注射器至一定位置,放开能够恢复到原来的位置,则证明气密性良好;(2)过氧化氢分解生成氧气的化学方程式为,,生成氧气的物质的量为,则过氧化氢消耗的物质的量为,则;随着反应的进行,反应物浓度逐渐减小,化学反应速率降低,故的平均反应速率>的平均反应速率;
(3)虽然、的浓度、体积都相同,但加入的溶液中含有不同种类的阴离子,不能排除是阴离子对过氧化氢分解速率的影响;控制了阴离子浓度和种类一样,虽然的浓度比小,但是反应更剧烈,则可以证明催化效果更好。
18.【答案】(1)减小
(2)正向 =
(3)BD ④
【解析】(1)利用盖斯定律,由Ⅰ-Ⅱ 可得热化学方程式为:∆H=∆H1-∆H2,结合图分析,反应Ⅰ的1nK随着增大而增大,说明降低温度,平衡正向移动,则反应Ⅰ为放热反应,∆H10,则∆H
相关试卷
这是一份湖南省长沙市长郡中学2024-2025学年高二上学期期中考试化学试卷(Word版附解析),共15页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
这是一份湖南省衡阳市衡阳县第一中学2024-2025学年高一上学期11月期中考试化学试卷(Word版附解析),共15页。试卷主要包含了3g Na、6,2%等内容,欢迎下载使用。
这是一份湖南省衡阳市第八中学2024-2025学年高二上学期第一次月考化学试卷(Word版附解析),文件包含湖南省衡阳市第八中学2024-2025学年高二上学期第一次月考化学试题Word版含解析docx、湖南省衡阳市第八中学2024-2025学年高二上学期第一次月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共34页, 欢迎下载使用。










