

备战2025年高考化学考点一遍过考点40化学平衡常数及转化率教案(Word版附解析)
展开
这是一份备战2025年高考化学考点一遍过考点40化学平衡常数及转化率教案(Word版附解析),共23页。
(1)定义
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,这个常数就是该反应的化学平衡常数(简称平衡常数),用K表示。
(2)表达式
对于一般的可逆反应:mA(g)+nB(g)pC(g)+qD(g),K=。
(3)应用
①判断反应进行的限度
K值大,说明反应进行的程度大,反应物的转化率高。K值小,说明反应进行的程度小,反应物的转化率低。
②判断反应是否达到平衡状态
化学反应aA(g)+bB(g)cC(g)+dD(g)在任意状态时,浓度商均为Qc=。
Qc>K时,反应向逆反应方向进行;
Qc=K时,反应处于平衡状态;
QcK,说明平衡向逆反应方向进行,Qc<K,说明平衡向正反应方向进行,Qc=K,说明反应达到平衡,故正确;C.化学平衡常数只受温度影响,故错误;D.根据选项C分析,故错误。
【答案】B
1.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 ΔH10 平衡常数为K1;
反应② [O]+O32O2 ΔHa>c
D.减压或升温可将b中的平衡状态转变成c中的平衡状态
6.一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
A.甲中反应的平衡常数小于乙
B.该温度下,该反应的平衡常数K为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙=丁0,某温度下,将2 ml SO3置于10 L密闭容器中,反应达平衡后,SO3的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
①由图甲推断,B点SO2的平衡浓度为0.3 ml/L
②由图甲推断,A点对应温度下的平衡常数为1.25×10-3
③达平衡后,压缩容器容积,则反应速率变化图像可以用图乙表示
④相同压强、不同温度下SO3的转化率与温度关系如丙图所示
A.①② B.②③
C.③④ D.①④
9.催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,在CO2中通入H2,二者可发生以下两个平行反应:
反应Ⅰ CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-53.7 kJ·ml-1
反应Ⅱ CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·ml-1
某实验室控制一定的CO2和H2初始投料比,在相同压强下,经过相同反应时间测得如下实验数据(其中“甲醇选择性”是指转化的CO2中生成甲醇的百分比):
(1)CO2的电子式是_____________。
(2)反应Ⅰ的平衡常数表达式是K=_________________________。
(3)对比①和③可发现:同样催化剂条件下,温度升高,CO2转化率升高, 而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因__________________________________;对比①、②可发现,在同样温度下,采用Cu/ZnO纳米片使CO2转化率降低, 而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因_______________________________。
(4)有利于提高CO2转化为CH3OH平衡转化率的措施有________。
a.使用Cu/ZnO纳米棒做催化剂
b.使用Cu/ZnO纳米片做催化剂
c.降低反应温度
d.投料比不变,增加反应物的浓度
e.增大CO2和H2的初始投料比
10.CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造具有更高价值的化学品是目前的研究方向。
(1)250 ℃时,以镍合金为催化剂,涉及此研究的某反应的平衡常数K= QUOTE c2(CO)·c2(H2)c(CO2)·c(CH4) ,则此反应的化学方程式为 ;又知此反应的逆反应为放热反应,则一定能使此反应的平衡常数增大的措施是 (填选项字母);使该反应的平衡一定向正反应方向移动的措施有
(填选项字母)。
A.增大CO2的浓度 B.升高温度 C.降低温度
D.增大压强 E.减小压强
(2)用某种特殊催化剂,可以将CO2和CH4直接转化成乙酸,温度超过某个值时乙酸的生成速率却减小了,原因是 。
(3)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(l)。
①已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率如表:
上述反应的焓变ΔH (填“>”、“45%,则x 1.5。
②在80 ℃时,向体积为0.5 L的密闭容器中加入2 ml CO2和6 ml H2,20 min后反应达到平衡,此时CH3OCH3的物质的量为0.5 ml,则该反应的平均反应速率v(CO2)= ml·L-1·min-1,H2的转化率α(H2)= ,在80 ℃时该反应的化学平衡常数为 (列出计算式即可)。
1.[2019江苏][双选]在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是
A.反应2NO(g)+O2(g)2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×10−4 ml·L−1,NO平衡转化率为50%,则平衡常数K>2000
2.[2018江苏]一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:
下列说法正确的是
A.v1< v2,c2< 2c1 B.K1> K3,p2> 2p3
C.v1< v3,α1(SO2 ) >α3(SO2 ) D.c2> 2c3,α2(SO3 )+α3(SO2 )”“ 不变 升高温度
【解析】(1)将题干中两个方程式做如下处理:(Ⅰ)×2−(Ⅱ)可得4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),则其平衡常数K= QUOTE K12K2 。
(2)根据“三段式”
2NO(g) +Cl2(g) 2ClNO(g)
QUOTE 起始浓度(ml·L-1) 0.1 0.05 0
QUOTE 转化浓度(ml·L-1) 0.1α1 0.05α1 0.1α1
QUOTE 平衡浓度(ml·L-1) 0.1−0.1α1 0.05−0.05α1 0.1α1
v(ClNO)= QUOTE 0.1α1ml·L-110min =7.5×10−3 ml·L−1·min−1,得α1=75%,平衡时n(Cl2)=(0.05−0.05α1) ml·L−1×2 L =0.025 ml。该反应为气体分子数减小的反应,恒压条件下相对于恒容条件下,压强增大,平衡右移,NO的转化率增大,即α2>α1;化学平衡常数只与温度有关,温度不变,平衡常数K2不变;该反应为放热反应,升高温度可使平衡常数K2减小。
2.【答案】(1) QUOTE c(CO)×c(H2O)c(CO2)×c(H2)
(2)吸热 (3)700 ℃
(4)等于 (5)不
(6)逆反应方向
【解析】(1)根据化学方程式可写出K= QUOTE c(CO)×c(H2O)c(CO2)×c(H2) 。
(2)分析表中数据可知,随着温度的升高,K值逐渐增大,说明正反应是吸热反应。
(3)某温度下,由3c(CO2)·c(H2)=5c(CO)·c(H2O)得出 QUOTE c(CO)×c(H2O)c(CO2)×c(H2) = QUOTE 35 =0.6=K,查表知K=0.6时对应温度是700 ℃。
(4)只要温度不变,K值就不变。
(5)830 ℃时达到平衡,扩大容器体积,由于反应前后气体的物质的量不变,则平衡不移动。
(6)该条件下Qc= QUOTE c(CO)×c(H2O)c(CO2)×c(H2) = QUOTE 4×42×2 =4>K=2.6,故反应向逆反应方向移动。
3.【答案】C
【解析】体积增大一倍,压强减小,假设平衡不移动,B的浓度应是原来的50%c,C错误;结合A项分析知,升温可使b中的平衡状态转变为c中的平衡状态,减压平衡逆向移动,导致Ni(CO)4浓度变小,即可使b中的平衡状态转变为c中的平衡状态,D正确。
6.【答案】B
【解析】温度一定,平衡常数不变,A错误;甲中平衡常数K==eq \f(0.162,0.042×0.04)=400,B正确;乙和丙中二氧化硫起始量相同,但丙中氧气物质的量大于乙中氧气物质的量,所以α1
②0.1 50% QUOTE 122×66
【解析】本题考查了化学平衡移动的影响因素、化学平衡常数的计算等知识,充分考查了考生的分析、理解能力及化学计算能力。(1)由平衡常数表达式知反应物为CO2、CH4,生成物为CO、H2,再由浓度幂知各物质前面的化学计量数分别为1、1、2、2,所以该反应的化学方程式为CO2(g)+CH4(g)2CO(g)+2H2(g)。此反应的逆反应为放热反应,则CO2(g)+CH4(g)2CO(g)+2H2(g)为吸热反应,升高温度,平衡正向移动,平衡常数增大;增加反应物的浓度或减少生成物的浓度,平衡正向移动;增大压强要区别恒容充入惰性气体(或N2等不影响反应的气体)增大压强和恒容充入反应气体增大压强,故平衡不一定移动;减小压强平衡向正反应方向移动。
(2)当温度超过某个值时,催化剂的催化效率降低,从而导致乙酸的生成速率降低。
(3)①升高温度,CO2的转化率减小,说明平衡逆向移动,可知该反应为放热反应,ΔHK(400℃);
由图像知,400℃时,HCl平衡转化率为84%,用三段式法对数据进行处理得:
起始(浓度) c0 c0 0 0
变化(浓度) 0.84c0 0.21c0 0.42c0 0.42c0
平衡(浓度)(1-0.84)c0 (1-0.21)c0 0.42c0 0.42c0
则K=;根据题干信息知,进料浓度比过低,氧气大量剩余,导致分离产物氯气和氧气的能耗较高;进料浓度比过高,HCl不能充分反应,导致HCl转化率较低;
(2)根据盖斯定律知,(反应I+反应II+反应III)×2得 ∆H=(∆H1+∆H2+∆H3)×2=-116kJ·ml-1;
(3)若想提高HCl的转化率,应该促使平衡正向移动,该反应为气体体积减小的反应,根据勒夏特列原理,可以增大压强,使平衡正向移动;也可以及时除去产物,减小产物浓度,使平衡正向移动;
5.【答案】(3)①2.52.8×10–3②> > ③B
【解析】(3)① H2S(g) + CO2(g)COS(g)+ H2O(g)
开始 0.40ml 0.10ml 0 0
反应 x x x x
平衡 (0.40–x)ml (0.10–x)ml x x
解得x=0.01ml,所以H2S的转化率是
由于该反应是反应前后气体体积相等的反应,所以在该条件下反应达到平衡时化学平衡常数;
②根据题目提供的数据可知温度由610K升高到620K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,所以H2S的转化率增大。α2>α1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0;③A.增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化消耗量,所以H2S转化率降低,A错误;B.增大CO2的浓度,平衡正向移动,使更多的H2S反应,所以H2S转化率增大,B正确;C.COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,C错误;D.N2是与反应体系无关的气体,充入N2,不能使化学平衡发生移动,所以对H2S转化率无影响,D错误。答案选B。
6.【答案】(1)
(2)
【解析】(1)H2的体积分数随温度的升高而增加,这说明升高温度平衡向逆反应方向进行,即正反应是放热反应。升高温度正逆反应速率均增大,平衡向逆反应方向进行,平衡常数减小,反应物的转化率减小。
(2)相同温度时平衡常数不变,则a、b、c、d与m、n、x、y之间的关系式为。
7.【答案】(2)①4OH−+3+4NO4+3Cl−+2H2O 提高 ②减小 ③大于 NO溶解度较低或脱硝反应活化能较高
(3)①减小 ②
【解析】(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为4OH−+3+4NO4+3Cl−+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高。
②根据反应方程式2H2O++2SO22+Cl−+4H+、2H2O+3+4NO4+3Cl−+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐减小。
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。①由图分析可知,反应温度升高,SO2和NO的平衡分压负对数减小,这说明反应向逆反应方向进行,因此脱硫、脱硝反应的平衡常数均减小。②根据反应的方程式ClO2−+22+Cl−可知平衡常数K表达式为。
K
105
反应程度
很难进行
反应可逆
反应可接近完全
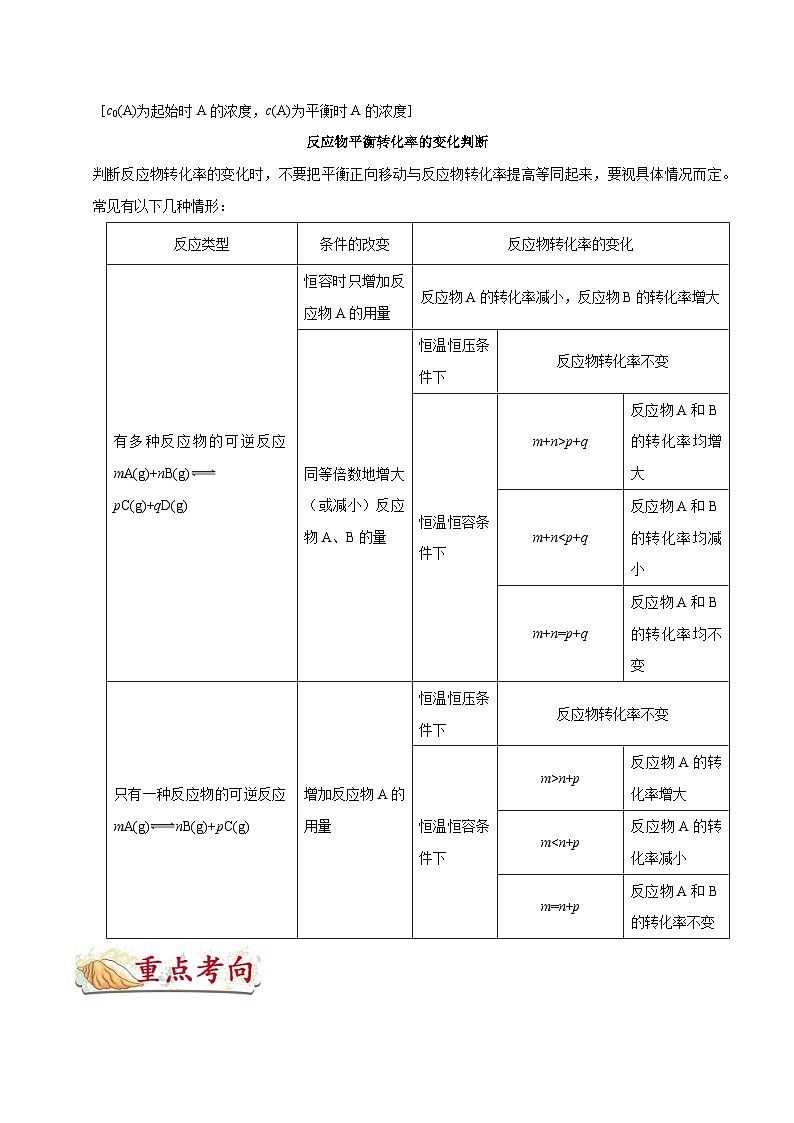
反应类型
条件的改变
反应物转化率的变化
有多种反应物的可逆反应mA(g)+nB(g)pC(g)+qD(g)
恒容时只增加反应物A的用量
反应物A的转化率减小,反应物B的转化率增大
同等倍数地增大(或减小)反应物A、B的量
恒温恒压条件下
反应物转化率不变
恒温恒容条件下
m+n>p+q
反应物A和B的转化率均增大
m+nn+p
反应物A的转化率增大
m
相关教案
这是一份备战2025年高考化学考点一遍过考点07突破NA教案(Word版附解析),共19页。教案主要包含了以物质的量为核心的转换与计算,以物质的结构为依据求共价键数目,反应程度对粒子数目计算的影响等内容,欢迎下载使用。
这是一份备战2025年高考化学考点一遍过考点24原子结构教案(Word版附解析),共17页。教案主要包含了微粒的组成与结构,核外电子排布等内容,欢迎下载使用。
这是一份备战2025年高考化学考点一遍过考点34化学电源教案(Word版附解析),共19页。








