

所属成套资源:中考化学常考点专题必杀题(深圳专用)(原卷版+解析)
中考化学常考点专题必杀题(深圳专用)选择专练11(金属探究题30题)(原卷版+解析)
展开
这是一份中考化学常考点专题必杀题(深圳专用)选择专练11(金属探究题30题)(原卷版+解析),共35页。试卷主要包含了单选题等内容,欢迎下载使用。
一、单选题
1.有一种在古籍里称为“鋈”的银白色铜合金,是古代云南、四川地区的特产,其主要成分是铜、锌、镍等金属单质,炼制时需要黑铜矿(主要成分是CuO)、硫化镍矿(主要成分是Ni2S3)等多种矿物。下列有关说法错误的是( )
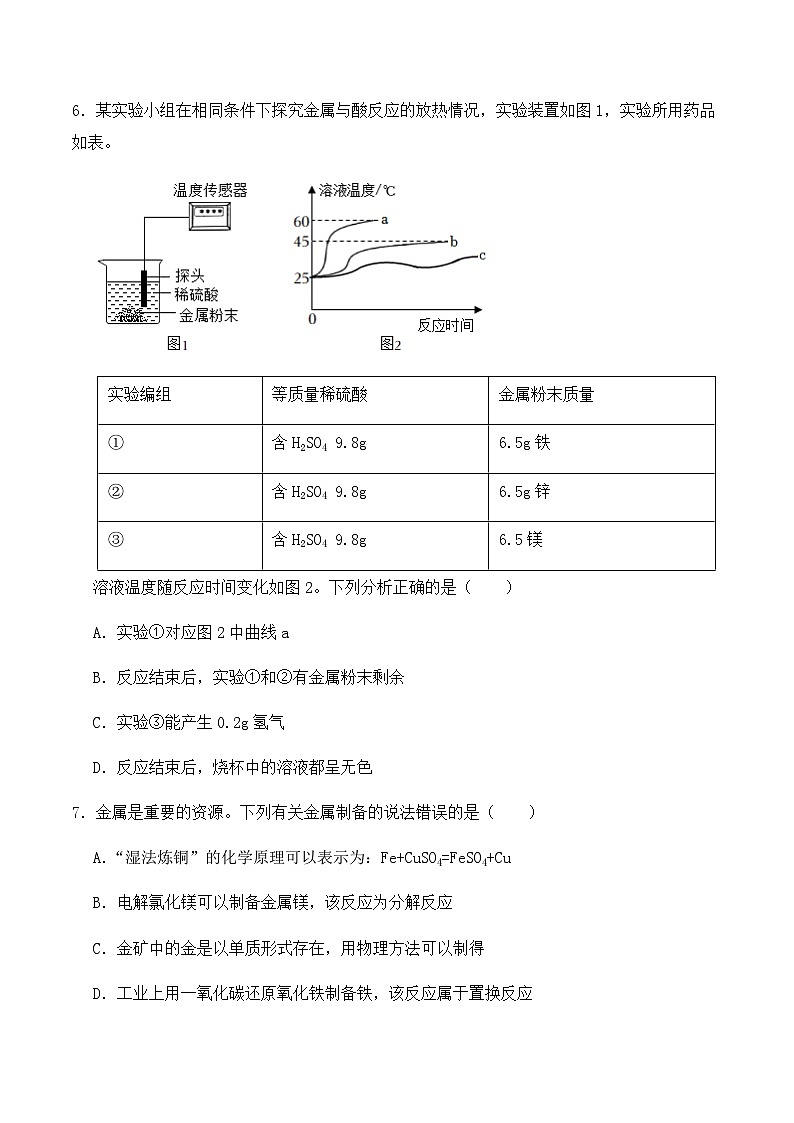
A.鋈属于金属材料
B.鋈的样品在足量稀盐酸中能全部溶解
C.Ni2S3中镍元素呈+3价
D.黑铜矿跟木炭共热能生成单质铜
2.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。
下列说法不正确的是( )
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
D.实验甲中的CuSO4改为CuCl2不能完成本实验探究
3.铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].若要探究“铜生锈是否需要空气中的氧气?”如图所示实验中,只需完成两个实验即可达到实验目的,此两个实验是( )
A.①③B.②③C.②④D.③④
4.下列叙述正确的是( )
A.英国化学家拉瓦锡用定量的方法研究了空气的成分,弄清了燃烧的本质
B.工业炼铁的原理是在高温的条件下,利用一氧化碳将铁矿石中的铁置换出来
C.含有同种元素且由一种物质组成,则该物质一定是单质
D.将煤砸成小块可以使煤充分的燃烧,减少一氧化碳和二氧化硫的产生
5.下列图像与对应的叙述相符合的是( )
A.图A是一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B.图B是在某一密闭的装置内点燃白磷
C.图C是将等质量的Mg、Al分别与溶质质量分数相同的足量稀硫酸反应
D.图D是分别向相同的CuSO4溶液(足量)中加入质量相等的锌粉和铁粉
6.某实验小组在相同条件下探究金属与酸反应的放热情况,实验装置如图1,实验所用药品如表。
溶液温度随反应时间变化如图2。下列分析正确的是( )
A.实验①对应图2中曲线a
B.反应结束后,实验①和②有金属粉末剩余
C.实验③能产生0.2g氢气
D.反应结束后,烧杯中的溶液都呈无色
7.金属是重要的资源。下列有关金属制备的说法错误的是( )
A.“湿法炼铜”的化学原理可以表示为:Fe+CuSO4=FeSO4+Cu
B.电解氯化镁可以制备金属镁,该反应为分解反应
C.金矿中的金是以单质形式存在,用物理方法可以制得
D.工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应
8.把等质量的X、Y、Z、M四种金属分别加入到足量相同质量分数的稀盐酸中,再把X加入到Z(NO3)2溶液中,M加入到Y(NO3)2溶液中,反应关系如图甲、乙、丙、据此判断四种金属的活动性顺序为( )
A.X>Z>M>YB.Y>M>Z>XC.X>Z>Y>MD.Z>X>M>Y
9.为验证Zn、Fe、Cu三种金属的活动性顺序,不可选用的一组物质是( )
A.Zn、Cu、FeCl2溶液B.ZnCl2溶液、Fe、CuCl2溶液
C.Zn、Fe、CuCl2溶液、稀盐酸D.ZnCl2溶液、Fe、Cu
10.“微观﹣宏观﹣符号”三重表征是化学独特的表示物质及其变化的方法。如图是金属钠投入水中所发生反应的微观示意图,以下解释或说法错误的是( )
A.参加反应的物质的微粒个数比2:3
B.该反应属于置换反应
C.该反应前后元素的种类没有发生变化
D.反应后的溶液呈碱性,因为溶液中存在OH﹣
11.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A.“烹胆矾则成铜”是物理变化
B.胆矾可用于配制波尔多液
C.胆矾可作为湿法冶铜的原料
D.“熬之则成胆矾”是蒸发结晶过程
12.请结合图示分析,下列说法中正确的是( )
A.能实现转化①的金属也一定能和稀硫酸反应
B.转化②只能通过铁与硫酸铜溶液反应实现
C.通过与C或CO发生置换反应可实现转化③
D.反应④可用于工业除铁锈,其现象可观察到溶液变为浅绿色
13.一定质量M、N两种金属,分别加入到相同质量和相同溶质质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图。分析图象得到的以下结论中错误的是( )
A.两种金属生成氢气的质量:M=N
B.两种金属的活动性:M>N
C.两种金属消耗稀硫酸的质量:M=N
D.若两种金属在化合物中均显+2价,则相对原子质量:MX>YB.X>Y>ZC.Z>Y>XD.X>Z>Y
22.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )。
A.Mn+2HCl=MnCl2+H2↑B.Mg+MnSO4=MgSO4+Mn
C.Mn+Cu(NO3)2=Mn(NO3)2+CuD.Fe+MnSO4= FeSO4+Mn
23.现有甲、乙、丙三种金属,采用将其中一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如下图所示)。则三种金属的活动性由强到弱的顺序是( )。
A.乙>甲>丙B.乙>丙>甲C.丙>甲>乙D.丙>乙>甲
24.向含有FeSO4和CuSO4的混合溶液中加入一定质量的Zn粒,充分反应后过滤,再向滤渣中加入稀硫酸,有气泡产生,根据上述现象,得出的结论正确的是( )。
A.滤渣中只有CuB.滤渣中一定有Fe
C.滤渣中一定有ZnD.滤渣中一定有Cu、Fe、Zn
25.将一定量的锌粉加入到过量的稀硫酸中,如图是反应过程中某种物质Y的质量随时间变化的关系,则Y不可能是( )。
A.消耗的锌粉B.剩余的稀硫酸
C.生成的氢气D.生成的ZnSO4
26.下列说法正确的是( )。
A.AlCl3、CuCl2可用相应的金属与稀盐酸反应而制得:
B.Fe2(SO4)3、MgSO4可用相应的金属与稀硫酸反应而制得
C.Fe的金属活动性比Cu的强,能够置换出盐酸中的氢
D.实验室欲制取H2,在没有Zn、Fe的情况下,可以用Al、Cu等金属代替
27.某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况进行了如下实验:取等质量的X、Y、Z分别与足量浓度相同的稀硫酸反应,都生成+2价的金属硫酸盐,反应情况如图所示。下列对该图像的理解正确的是( )。
A.相对原子质量:X>Y>ZB.金属活动性由强到弱:X>Z>Y
C.金属活动性由强到弱:X>Y>ZD.X、Y、Z可能依次是Mg、Zn、Fe
28.相同质量的Zn、Fe分别与足量稀盐酸作用,产生H2的质量与反应时间关系如下图所示,其中正确的是( )
A.B.
C.D.
29.金属镧(La)的活动性比锌强,它的氧化物的化学式为La2O3,La(OH)3不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是( )
A.La(OH)3和HClB.La2O3和HCl
C.La和HClD.FeCl3和La(OH)3
30.等质量等浓度的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )
A.B.
C.D.
实验编组
等质量稀硫酸
金属粉末质量
①
含H2SO4 9.8g
6.5g铁
②
含H2SO4 9.8g
6.5g锌
③
含H2SO4 9.8g
6.5镁
11 金属探究
深圳专用
一、单选题
1.有一种在古籍里称为“鋈”的银白色铜合金,是古代云南、四川地区的特产,其主要成分是铜、锌、镍等金属单质,炼制时需要黑铜矿(主要成分是CuO)、硫化镍矿(主要成分是Ni2S3)等多种矿物。下列有关说法错误的是( )
A.鋈属于金属材料
B.鋈的样品在足量稀盐酸中能全部溶解
C.Ni2S3中镍元素呈+3价
D.黑铜矿跟木炭共热能生成单质铜
【答案】B
【解析】A. 由题意鋈是铜合金,其主要成分是铜、锌、镍等金属单质,纯金属与合金均属于金属材料,故正确,不符合题意;
B. 鋈的主要成分是铜、锌、镍等金属单质,铜与稀盐酸不反应,则鋈的样品在足量稀盐酸中不能全部溶解,故错误,符合题意;
C. 由题意Ni2S3中硫元素的化合价为-2价,设镍元素的化合价为x,根据化合物中,正、负化合价的代数和为零,有2x+3×(−2)=0,解得x=+3,故镍元素呈+3价,故正确,不符合题意;
D. 氧化铜与木炭在加热条件下反应生成铜和二氧化碳,黑铜矿的主要成分是CuO,因此黑铜矿跟木炭共热能生成单质铜,故正确,不符合题意。
故答案为:B。
2.化学小组为探究铝、铜、银三种金属的活动性顺序,设计了如图所示实验方案。
下列说法不正确的是( )
A.由实验甲可知金属活动性:Al>Cu
B.由实验乙可知金属活动性:Cu>Ag
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag
D.实验甲中的CuSO4改为CuCl2不能完成本实验探究
【答案】D
【解析】金属活动性顺序中,排前置后。A.由实验甲可知金属活动性:Al>Cu,A不符合题意;
B.由实验乙可知金属活动性:Cu>Ag,B不符合题意;
C.由实验甲、乙、丙可知金属活动性:Al>Cu>Ag,C不符合题意;
D.实验甲中的CuSO4改为CuCl2也能完成本实验探究,D符合题意。
故答案为:D。
3.铜制品在空气中会发生锈蚀[铜锈的主要成分是Cu2(OH)2CO3].若要探究“铜生锈是否需要空气中的氧气?”如图所示实验中,只需完成两个实验即可达到实验目的,此两个实验是( )
A.①③B.②③C.②④D.③④
【答案】C
【解析】 ①因没有水而不生锈, ②铜接触水、二氧化碳、氧气,会生锈,③没有二氧化碳不会生锈, ④没有氧气不会生锈,所以 ②④结合可证明铜生锈需要氧气;
故答案为:C
4.下列叙述正确的是( )
A.英国化学家拉瓦锡用定量的方法研究了空气的成分,弄清了燃烧的本质
B.工业炼铁的原理是在高温的条件下,利用一氧化碳将铁矿石中的铁置换出来
C.含有同种元素且由一种物质组成,则该物质一定是单质
D.将煤砸成小块可以使煤充分的燃烧,减少一氧化碳和二氧化硫的产生
【答案】C
【解析】A. 拉瓦锡是法国化学家,故错误,不符合题意;
B. 工业炼铁的原理是在高温的条件下,利用一氧化碳将铁矿石中铁还原出来,反应物中没有单质,不是置换反应,故错误,不符合题意;
C. 单质是由一种元素组成的纯净物,含同种元素且由一种物质组成,则该物质一定是单质,故正确,符合题意;
D. 煤砸成小块,能增大与氧气的接触面积,能使煤充分的燃烧,能减少一氧化碳,但不能减少二氧化硫的产生,故错误,不符合题意。
故答案为:C。
5.下列图像与对应的叙述相符合的是( )
A.图A是一定温度下,向接近饱和的硝酸钾溶液中不断加入硝酸钾固体
B.图B是在某一密闭的装置内点燃白磷
C.图C是将等质量的Mg、Al分别与溶质质量分数相同的足量稀硫酸反应
D.图D是分别向相同的CuSO4溶液(足量)中加入质量相等的锌粉和铁粉
【答案】D
【解析】A. 接近饱和的硝酸钾溶液中不断加入硝酸钾固体,溶液质量会逐渐增大,但是起始质量不是0 ,直到溶液饱和后溶液质量不再改变,所以图像不是从原点开始,应将原题中图像沿纵轴向上平移一段,才能表示出正确的的变化过程,故A不符合题意;
B. 在密闭的装置内点燃白磷,白磷燃烧放热,使容器内气体受热膨胀,气压变大,白磷燃烧结束后,气压不再增大,温度逐渐恢复至室温,气体收缩气压减小,而白磷燃烧消耗了容器内的氧气,所以最终容器内气压小于反应前气压,而原题图像没有表示出容器内最终气压小于反应前气压,故B不符合题意;
C. 镁、铝与稀硫酸反应的化学方程式及金属与生成气体的质量关系如下:Mg+H2SO4=MgSO4+H2↑242、2Al+3H2SO4=Al2(SO4)3+3H2↑546182,即等质量的镁和铁分别与足量的稀硫酸反应生成气体的质量铝比镁的多,由于横坐标表示时间,纵坐标表示气体的质量,所以用图像表示时,应该是铝的图像拐点比镁的高,但由于镁的活动性比铝的强,所以镁反应时间比铝的短,铝的图像的拐点靠后,故C不符合题意;
D. 硫酸铜分别与锌、和铁反应的化学方程式及质量关系如下:Zn+CuSO4=ZnSO4+Cu6516016164、Fe+CuSO4=FeSO4+Cu5616015264,由于在反应过程中,没有水参加反应,也没有水生成,所以溶剂质量没有改变,因此判断反应前后溶液质量的变化只需要看反应前后溶质质量的变化情况即可,锌与硫酸铜反应时,反应前溶质为硫酸铜,反应后溶质为硫酸锌,根据化学方程式可以看出溶质的质量是增加的,故溶液质量增加,同理,铁与硫酸铜反应后,溶液质量是减小的;由于图像反应的是溶液质量变化与时间的关系,而锌反应后溶液质量增加的幅度要比铁反应后溶液质量减小的幅度小,所以前者变化用时间少,后者用时间多,故D符合题意;
故答案为:D。
6.某实验小组在相同条件下探究金属与酸反应的放热情况,实验装置如图1,实验所用药品如表。
溶液温度随反应时间变化如图2。下列分析正确的是( )
A.实验①对应图2中曲线a
B.反应结束后,实验①和②有金属粉末剩余
C.实验③能产生0.2g氢气
D.反应结束后,烧杯中的溶液都呈无色
【答案】C
【解析】A、由分析可知,实验①对应图2中曲线c,故不符合题意;
B、根据上述分析得出反应后铁与镁有剩余,对应①③组数据,故不符合题意;
C、根据上述分析得出硫酸被完全反应完,镁有剩余,结合化学反应方程式可以得出产生的氢气量为0.2g,故符合题意;
D、铁与硫酸反应生成硫酸亚铁与氢气,硫酸亚铁的溶液呈浅绿色,不符合题意;
故答案为:C;
7.金属是重要的资源。下列有关金属制备的说法错误的是( )
A.“湿法炼铜”的化学原理可以表示为:Fe+CuSO4=FeSO4+Cu
B.电解氯化镁可以制备金属镁,该反应为分解反应
C.金矿中的金是以单质形式存在,用物理方法可以制得
D.工业上用一氧化碳还原氧化铁制备铁,该反应属于置换反应
【答案】D
【解析】A、“湿法炼铜”是铁和硫酸铜反应生成硫酸亚铁和铜,该反应的化学方程式为:Fe+CuSO4=FeSO4+Cu,不符合题意;
B、电解氯化镁生成镁和氯气,该反应符合“一变多”的特点,属于分解反应,不符合题意;
C、金的化学性质比较稳定,金矿中的金是以单质形式存在的,可用物理方法制得,不符合题意;
D、一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的反应物均是化合物,不属于置换反应,符合题意。
故答案为:D。
8.把等质量的X、Y、Z、M四种金属分别加入到足量相同质量分数的稀盐酸中,再把X加入到Z(NO3)2溶液中,M加入到Y(NO3)2溶液中,反应关系如图甲、乙、丙、据此判断四种金属的活动性顺序为( )
A.X>Z>M>YB.Y>M>Z>XC.X>Z>Y>MD.Z>X>M>Y
【答案】A
【解析】由金属活动性顺序可知,排在H前面的金属能从稀酸中置换出H,放出H2,故可知X>H,Z>H,Y、M均弱于氢,再根据放氢气的速率(即图像斜率)可知金属活动性X>Z。X加入到Z (NO3)2溶液中能置换出Z,说明X>Z;M加入到YNO3溶液中能置换出Y,说明M>Y。综上所述,金属活动性顺序为X>Z>M>Y,
故答案为:A。
9.为验证Zn、Fe、Cu三种金属的活动性顺序,不可选用的一组物质是( )
A.Zn、Cu、FeCl2溶液B.ZnCl2溶液、Fe、CuCl2溶液
C.Zn、Fe、CuCl2溶液、稀盐酸D.ZnCl2溶液、Fe、Cu
【答案】D
【解析】A. Zn可以和FeCl2溶液反应,证明Zn的活动性强于Fe,Cu不能和FeCl2溶液反应,证明Cu的活动性弱于Fe,故A不符合题意;
B. Fe可以和CuCl2溶液反应,证明Fe的活动性强于Cu,Fe不能和ZnCl2溶液反应,证明Zn的活动性强于Fe,故B不符合题意;
C. Zn、Fe与稀盐酸均能反应,但Zn与稀盐酸反应速率较快,证明Zn的活动性强于Fe,另Fe能和CuCl2溶液反应,证明Fe的活动性强于Cu,故C不符合题意;
D. Fe、Cu均不能和ZnCl2溶液反应,所以无法验证Fe、Cu的活动性顺序,故D符合题意。
故答案为:D。
10.“微观﹣宏观﹣符号”三重表征是化学独特的表示物质及其变化的方法。如图是金属钠投入水中所发生反应的微观示意图,以下解释或说法错误的是( )
A.参加反应的物质的微粒个数比2:3
B.该反应属于置换反应
C.该反应前后元素的种类没有发生变化
D.反应后的溶液呈碱性,因为溶液中存在OH﹣
【答案】A
【解析】A、由反应的微观示意图可知,反应的化学方程式为2Na+2H2O=2NaOH+H2↑,参加反应的物质的微粒个数比为2:2=1:1,故A符合题意;
B、反应符合一种单质和一种化合物生成另一种单质和另一种化合物,反应属于置换反应,故B不符合题意;
C、由质量守恒定律可知,化学反应前后元素的种类不变,故C不符合题意;
D、反应后生成氢氧化钠,溶液显碱性,则反应后的溶液呈碱性,因为溶液中存在OH﹣,故D不符合题意。
故答案为:A。
11.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是( )
A.“烹胆矾则成铜”是物理变化
B.胆矾可用于配制波尔多液
C.胆矾可作为湿法冶铜的原料
D.“熬之则成胆矾”是蒸发结晶过程
【答案】A
【解析】A、“烹胆矾则成铜”说明硫酸铜晶体受热生成铜,发生化学变化,故A选项符合题意;
B、胆矾是硫酸铜晶体,与熟石灰可以配制波尔多液,故B选项不符合题意;
C、由“熬胆矾铁釜,久之亦化为铜”,可知硫酸铜溶液与铁反应生成铜,所以胆矾可作为湿法冶铜的原料,故C选项不符合题意;
D、由“熬之则成胆矾”可知蒸发水分,得到硫酸铜晶体,所以此过程为蒸发结晶,故D选项不符合题意。
故答案为:A。
12.请结合图示分析,下列说法中正确的是( )
A.能实现转化①的金属也一定能和稀硫酸反应
B.转化②只能通过铁与硫酸铜溶液反应实现
C.通过与C或CO发生置换反应可实现转化③
D.反应④可用于工业除铁锈,其现象可观察到溶液变为浅绿色
【答案】A
【解析】A. 由于铁位于氢的前边,能将铁置换出来的金属位于铁的前边,所以能实现转化①的金属也一定能和稀硫酸反应,故符合题意;
B. 转化②不只有通过铁与硫酸铜溶液反应实现,铁还能与稀硫酸等反应也可生成硫酸亚铁,故不符合题意;
C. 通过C发生置换反应可实现转化③,但CO与三氧化二铁的反应不属于置换反应,故不符合题意;
D. 由于氧化铁与稀盐酸反应生成了氯化铁和水,反应④中能观察到溶液变为黄色,故不符合题意。
故答案为:A。
13.一定质量M、N两种金属,分别加入到相同质量和相同溶质质量分数的稀硫酸中,生成氢气的质量与反应时间的关系如图。分析图象得到的以下结论中错误的是( )
A.两种金属生成氢气的质量:M=N
B.两种金属的活动性:M>N
C.两种金属消耗稀硫酸的质量:M=N
D.若两种金属在化合物中均显+2价,则相对原子质量:MN。B不符合题意。
C、根据图像可知,两种金属最终生成氢气的质量相等,由于氢气来自硫酸中的氢元素,所以两种金属消耗稀硫酸的质量相等。C不符合题意。
D、由图像可知,生成的氢气质量相等,硫酸完全反应,金属是过量的,不能确定两种金属的相对原子质量的大小,所以D符合题意。
故答案为:D。
14.下列图像分别与选项中的实验现象及结果相对应,其中正确的是( )
A.电解水
B.向等质量的镁粉和铁粉中分别滴加同浓度的稀硫酸至过量
C.向一定量的二氧化锰中加入过氧化氢溶液
D.一定温度时向一定量饱和石灰水中加入氧化钙
【答案】B
【解析】A.电解水生成氧气和氢气的质量比为8:1,故A不符合题意;
B.镁和铁与酸反应生成的化合物中金属元素显+2价;金属质量相同时、相对原子质量小的生成氢气多,故B符合题意
C.过氧化氢在二氧化锰的催化下生成水和氧气,氧气的量与过氧化氢有关,随着过氧化氢的增加,氧气逐渐增加,故C不符合题意
D.氧化钙和水反应生成氢氧化钙,反应放热,氢氧化钙析出,溶液质量减小,故D不符合题意
故答案为:B
15.向AgNO3溶液中加入一定量的Mg粉和Fe粉,充分反应后过滤,得到滤渣和浅绿色的滤液.关于该滤渣和滤液有下列四种说法:
①向滤渣中加入稀盐酸,一定有气泡产生; ②向滤液中加入稀盐酸一定有沉淀产生;
③滤渣中一定有Ag; ④滤液中一定有Fe(NO3)2、一定不含AgNO3、可能有Mg(NO3)2.
以上说法中正确的个数为( )
A.1个B.2 个C.3个D.4个
【答案】A
【解析】 向AgNO3溶液中加入一定量的Mg粉和Fe粉,硝酸银先和镁反应生成银和硝酸镁,当镁反应完后,和铁反应生成硝酸亚铁和镁,充分反应后,得到滤渣和浅绿色的滤液 ,说明镁一定反应完了,铁可能反应完全,也可能没有反应完,
①当铁恰好反应完后,向滤渣中加入稀盐酸,没有气泡产生,故① 不符合题意; ② 当硝酸银反应完全,加入稀盐酸,没有沉淀生成,故不正确,③镁和铁与硝酸银反应生成银,故正确,④镁和硝酸银先反应,滤液中一定含有硝酸镁,故错误
故答案为:A
16.下列图像能正确反映其对应变化关系的是( )
A. 用等质量、等浓度的过氧化氢溶液分别在有、无催化剂的条件下制氧气
B. 向等质量的铝、锌中分别加入足量的等浓度的稀盐酸
C. 通电电解水
D. 加热一定质量的高锰酸钾
【答案】D
【解析】A、用等质量、等浓度的双氧水制取氧气,催化剂只能影响反应速率,不影响产生氧气的质量,图像不符合题意。
B、向等质量的铝、锌中分别加入足量的等浓度稀盐酸,若消耗盐酸相同,则生成氢气质量相同,故开始两斜线重合,后因盐酸过量,铝消耗盐酸多,生成氢气多,拐点高些,图像不符合题意。
C、电解水生成氢气和氧气,氢气和氧气体积比是2:1,质量比是1:8,图像不符合题意。
D、加热一定质量的高锰酸钾,生成锰酸钾、二氧化锰和氧气,根据质量守恒定律,固体中钾元素质量不变,图像符合题意。
故答案为:D。
17.小明发现月饼盒里的脱氧剂部分呈红棕色,查阅资料得知脱氧剂中含有铁粉和活性炭。他猜想这包脱氧剂中可能含有:①Cu和C;②Fe2O3和C;③Fe3O4和C;④Fe3O4、C和Fe;⑤Fe2O3、C和Fe。其中猜想合理的是( )。
A.①③⑤B.②④⑤C.②⑤D.④⑤
【答案】C
【解析】 ①Cu是红色的,不是红棕色的,②Fe2O3是红棕色的, ③Fe3O4和C, 是黑色的, ④Fe3O4、C和Fe是黑色的,⑤Fe2O3是红棕色的,且含有铁粉和活性炭。 故选C
故答案为:C
18.如图所示,在盛水的试管中放一枚洁净的铁钉,用带U形管的橡胶塞塞紧,∪形管内水面处于同一高度,数天后观察到U形管内的水面高度( )。
A.a比b高B.b比a高
C.一样高D.U形管的水从b管口全部溢出
【答案】A
【解析】铁钉和空气中的水和氧气接触会生锈,铁钉生锈消耗试管中的氧气,使得试管内的压强变小,在外界大气压的作用下,左边液面上升,右边液面下降
故答案为:A
19.下列有关工业炼铁的主要原料中正确的一组是( )。
①铁矿石;②焦炭;③一氧化碳;①石灰石;⑤空气。
A.①②⑤B.①②④⑤C.①③④⑤D.②③④
【答案】B
【解析】工业炼铁的主要原料中:
铁矿石能够提供铁元素,是炼铁的主要原料;
焦炭在点燃条件下和空气或者氧气反应生成二氧化碳,二氧化碳在高温条件下能被焦炭还原成一氧化碳,一氧化碳能够把铁矿石中的铁还原出来;
石灰石在高温条件下分解能生成氧化钙和二氧化碳,氧化钙能和铁矿石中的杂质二氧化硅反应生成硅酸钙,从而除去二氧化硅;
空气能够提供氧气;
工业炼铁的主要原料包括铁矿石、焦炭、石灰石和空气.
故答案为:B。
20.下列关于铁的冶炼的说法错误的是( )。
A.把铁矿石、焦炭和石灰石一起加入高炉
B.石灰石的主要作用是将矿石中的二氧化硅转变成炉渣
C.生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%
D.在反应过程中,Fe2O3作还原剂,被氧化
【答案】D
【解析】A. 把铁矿石、焦炭和石灰石一起加入高炉进行炼铁,故正确,不符合题意;
B. 石灰石的主要作用是将矿石中的二氧化硅转变成硅酸钙沉淀,形成炉渣,故正确,不符合题意;
C. 生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%,故正确,不符合题意;
D. 在反应过程中,Fe2O3作氧化剂,被还原,故错误,符合题意;
故答案为:D。
21.X、Y、Z是三种二价金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )。
①Z+YSO4=ZSO4+Y;
②X+YSO4=XSO4+Y;
③Z+H2SO4=ZSO4+H2↑;
④X+H2SO4→不发生反应。
A.Z>X>YB.X>Y>ZC.Z>Y>XD.X>Z>Y
【答案】A
【解析】①Z+YSO4=ZSO4+Y,说明Z的活动性比Y强;
②X+YSO4=XSO4+Y,说明X的活动性比Y强;
③Z+H2SO4=ZSO4+H2↑,说明Z的活动性排在氢之前;
④X+H2SO4→不发生反应,说明X的活动性排在氢之后,
所以三种金属的活动性顺序为Z>X>Y 。
故答案为:A.
22.若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应错误的是( )。
A.Mn+2HCl=MnCl2+H2↑B.Mg+MnSO4=MgSO4+Mn
C.Mn+Cu(NO3)2=Mn(NO3)2+CuD.Fe+MnSO4= FeSO4+Mn
【答案】D
【解析】若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,说明锰的活动性比铁强,那么ABC三选项正确,D选项错误。
故答案为:D。
23.现有甲、乙、丙三种金属,采用将其中一种金属分别放入另外两种金属的硫酸盐溶液中的方法进行实验,得到三种金属间的转化关系(如下图所示)。则三种金属的活动性由强到弱的顺序是( )。
A.乙>甲>丙B.乙>丙>甲C.丙>甲>乙D.丙>乙>甲
【答案】C
【解析】根据转化图可知,丙可以从甲、乙的硫酸盐溶液中把甲、乙置换出来,说明丙是活动性比甲、乙强;
甲可以从乙的硫酸盐溶液中把乙置换出来,说明甲的活动性比乙强。
所以三种金属的活动性由强到弱的顺序为丙>甲>乙 。
故答案为:C。
24.向含有FeSO4和CuSO4的混合溶液中加入一定质量的Zn粒,充分反应后过滤,再向滤渣中加入稀硫酸,有气泡产生,根据上述现象,得出的结论正确的是( )。
A.滤渣中只有CuB.滤渣中一定有Fe
C.滤渣中一定有ZnD.滤渣中一定有Cu、Fe、Zn
【答案】B
【解析】题目中三种金属的活动性由强到弱的顺序为锌、铁、铜。
向含有FeSO4和CuSO4的混合溶液中加入一定质量的Zn粒,充分反应后过滤,锌先与硫酸铜反应,硫酸铜完全反应后,锌再与硫酸亚铁反应;所以反应后的溶液中一定含有铜单质;
根据再向滤渣中加入稀硫酸,有气泡产生,说明反应后的溶液中含有活泼的金属,可能锌有剩余。那么滤渣中含有铜、锌、铁;也可能锌把硫酸亚铁中铁置换出来,锌就完全反应,没有剩余,此是滤渣中含有铜、铁。
故答案为:B。
25.将一定量的锌粉加入到过量的稀硫酸中,如图是反应过程中某种物质Y的质量随时间变化的关系,则Y不可能是( )。
A.消耗的锌粉B.剩余的稀硫酸
C.生成的氢气D.生成的ZnSO4
【答案】B
【解析】锌和稀硫酸反应生成硫酸锌和氢气
A.随着反应的进行,消耗锌粉的质量会不断增大,直到反应结束,故A不符合题意
B.剩余稀硫酸的质量不断减小,直至不变,故B符合题意
C.锌和稀硫酸反应生成硫酸锌和氢气,生成氢气的质量不断增大,直至反应结束,故C不符合题意
D.锌和稀硫酸反应生成硫酸锌和氢气,生成硫酸锌的质量不断增大,直至反应结束,故D不符合题意
故答案为:B
26.下列说法正确的是( )。
A.AlCl3、CuCl2可用相应的金属与稀盐酸反应而制得:
B.Fe2(SO4)3、MgSO4可用相应的金属与稀硫酸反应而制得
C.Fe的金属活动性比Cu的强,能够置换出盐酸中的氢
D.实验室欲制取H2,在没有Zn、Fe的情况下,可以用Al、Cu等金属代替
【答案】C
【解析】A.铜和稀盐酸不反应,故不能得到氯化铜,故A不符合题意
B.铁和稀硫酸反应生成硫酸亚铁和氢气,故不能得到硫酸铁,故B不符合题意
C.铁的金属活动性在氢之前,能和酸反应生成氢气,故C符合题意
D.铜的金属活动性在氢之后,因此不能用铜和酸反应制取氢气,故D不符合题意
故答案为:C
27.某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况进行了如下实验:取等质量的X、Y、Z分别与足量浓度相同的稀硫酸反应,都生成+2价的金属硫酸盐,反应情况如图所示。下列对该图像的理解正确的是( )。
A.相对原子质量:X>Y>ZB.金属活动性由强到弱:X>Z>Y
C.金属活动性由强到弱:X>Y>ZD.X、Y、Z可能依次是Mg、Zn、Fe
【答案】B
【解析】A. 等质量的X、Y、Z分别与足量浓度相同的稀硫酸反应,都生成+2价的金属硫酸盐, 则相对原子质量大的生成的氢气少,故三种金属的相对原子质量大小关系是Z>Y>X,故A不符合题意
B.根据图像可知,X的图像最陡,Z的图像次之,则三种金属的活动性顺序为X>Y>Z,故B符合题意
C.根据图像可知,X的图像最陡,Z的图像次之,则三种金属的活动性顺序为X>Y>Z,故C不符合题意
D. Mg、Zn、Fe 三种金属的活动性顺序为Mg>Zn>Fe,对应X>Y>Z,故D不符合题意
故答案为:B
28.相同质量的Zn、Fe分别与足量稀盐酸作用,产生H2的质量与反应时间关系如下图所示,其中正确的是( )
A.B.
C.D.
【答案】C
【解析】相同质量的Zn、Fe分别与足量稀盐酸作用,由于稀硫酸过量,因此充分反应后放出氢气的质量大小由金属决定,根据化学方程式 Fe+H2SO4=FeSO4+H2↑ ,每56g铁生成2g氢气,又根据化学方程式 Zn+H2SO4=ZnSO4+H2↑ ,每65g锌生成2g氢气,所以相同质量的Zn、Fe分别与足量稀盐酸作用,铁比锌生成氢气量多;根据金属的活动性强弱关系锌>铁,可判断锌与稀硫酸反应快,铁与稀硫酸反应慢,锌反应完所用的时间短,图像先出现拐点。
故答案为:C。
29.金属镧(La)的活动性比锌强,它的氧化物的化学式为La2O3,La(OH)3不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。由此判断下列几组物质,不能直接反应制取LaCl3的是( )
A.La(OH)3和HClB.La2O3和HCl
C.La和HClD.FeCl3和La(OH)3
【答案】D
【解析】A.La(OH)3属于碱,能和HCl反应生成LaCl3,不符合题意;
B.La2O3属于金属氧化物,根据酸的通性,它能和HCl反应生成LaCl3,不符合题意;
C.金属镧(La)的活动性比锌强,在金属活动性顺序中,排在氢前,故能与盐酸反应生成LaCl3,不符合题意;
D.La(OH)3是不溶于水的碱,不能和氯化铁反应,符合题意。
故答案为:D。
30.等质量等浓度的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图像能正确表示产生氢气质量与反应时间之间关系的是( )
A.B.
C.D.
【答案】B
【解析】等质量等浓度的稀硫酸分别与足量的镁、铁、锌三种金属反应,生成氢气中的氢元素全部来自于硫酸溶质,金属分别都是足量的,所以生成的氢气质量相等(对应同一纵坐标);又因为三种金属分别与等质量等浓度的稀硫酸反应,三种金属的活动性:镁>锌>铁,所以反应速率镁>锌>铁,反应完所用的时间镁最少,其次是锌,最长是铁(反应结束的拐点对应的横坐标:镁
相关试卷
这是一份中考化学常考点专题必杀题(深圳专用)选择专练12(流程推断题30题)(原卷版+解析),共44页。试卷主要包含了单选题等内容,欢迎下载使用。
这是一份中考化学常考点专题必杀题(深圳专用)选择专练10(物质的除杂与鉴别30题)(原卷版+解析),共27页。试卷主要包含了单选题等内容,欢迎下载使用。
这是一份中考化学常考点专题必杀题(深圳专用)选择专练08(实验设计30题)(原卷版+解析),共36页。试卷主要包含了单选题等内容,欢迎下载使用。









