所属成套资源:【备战2025】2025年高考化学一轮复习 课时检测专题(共73讲,含解析)
2025年高考化学一轮复习 课时检测二十七:喷泉实验与含氮物质间的相互转化(含解析)
展开
这是一份2025年高考化学一轮复习 课时检测二十七:喷泉实验与含氮物质间的相互转化(含解析),共8页。试卷主要包含了水合肼可用作还原剂,解析等内容,欢迎下载使用。
A.工业上模拟自然界“雷雨发庄稼”的过程生产HNO3
B.自然固氮、人工固氮都是将N2转化为含氮化合物
C.氨气是重要的工业原料,可用于生产化肥和纯碱等大宗化学品
D.多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
2.自然界中氮的部分循环过程如图,下列有关说法正确的是( )
A.过程①和②均属于自然固氮
B.X→Y发生化合反应
C.NH3→N发生氧化还原反应
D.若为硫循环,X在空气中点燃可得Y
3.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。下列关于海洋氮循环的说法正确的是( )
A.海洋中的氮循环起始于氮的还原
B.海洋中的氮循环中属于固氮作用的是③
C.海洋中的反硝化作用一定有氧气的参与
D.向海洋排放含NOeq \\al(-,3)的废水不会影响海洋中NHeq \\al(+,4)的含量
4.(2023·浙江1月选考)关于反应2NH2OH+4Fe3+===N2O↑+4Fe2++4H++H2O,下列说法正确的是( )
A.生成1 ml N2O,转移4 ml电子
B.NH2OH是还原产物
C.NH2OH既是氧化剂又是还原剂
D.若设计成原电池,Fe2+为负极产物
5.
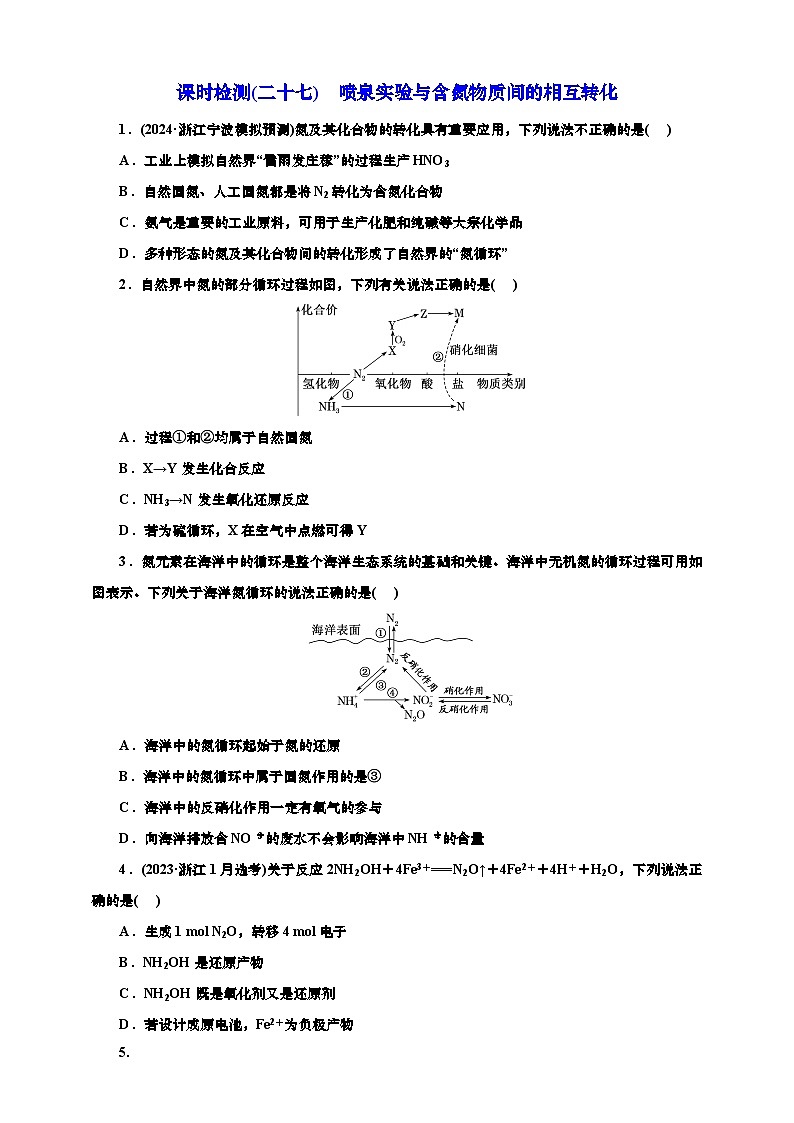
中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )
A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
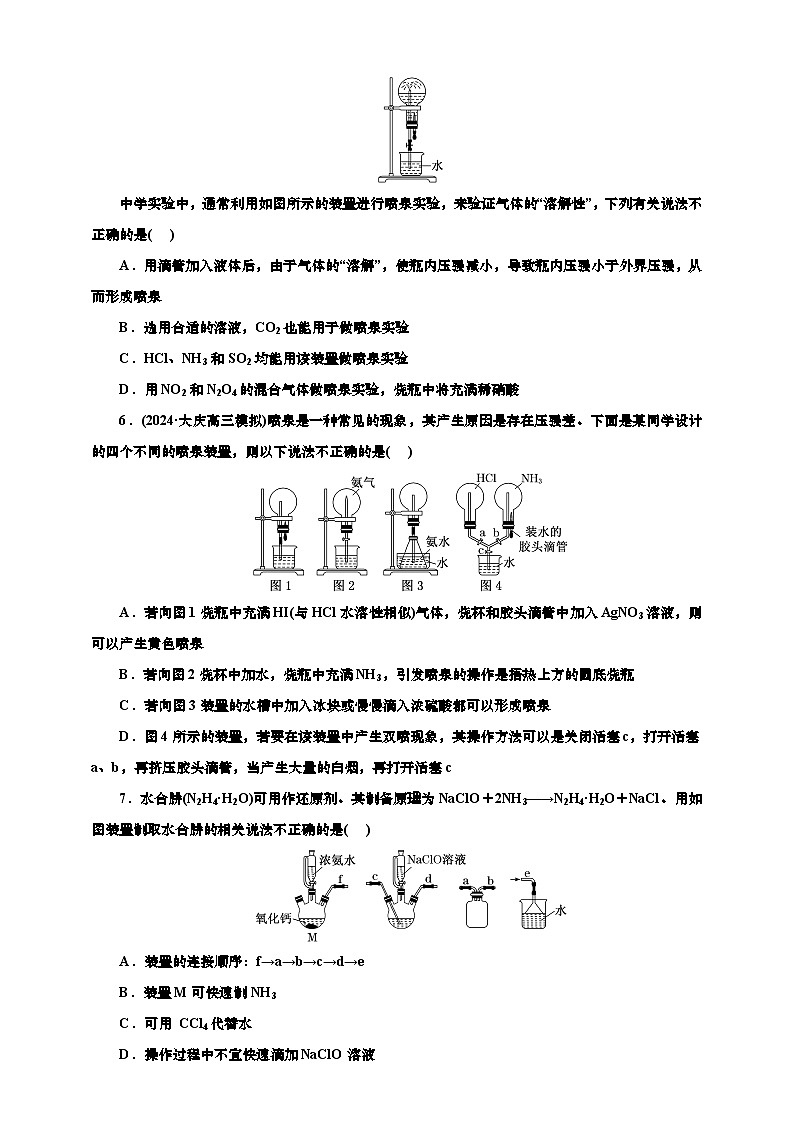
6.(2024·大庆高三模拟)喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则以下说法不正确的是( )
A.若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3溶液,则可以产生黄色喷泉
B.若向图2烧杯中加水,烧瓶中充满NH3,引发喷泉的操作是捂热上方的圆底烧瓶
C.若向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D.图4所示的装置,若要在该装置中产生双喷现象,其操作方法可以是关闭活塞c,打开活塞a、b,再挤压胶头滴管,当产生大量的白烟,再打开活塞c
7.水合肼(N2H4·H2O)可用作还原剂。其制备原理为NaClO+2NH3―→N2H4·H2O+NaCl。用如图装置制取水合肼的相关说法不正确的是( )
A.装置的连接顺序:f→a→b→c→d→e
B.装置M可快速制NH3
C.可用 CCl4代替水
D.操作过程中不宜快速滴加NaClO溶液
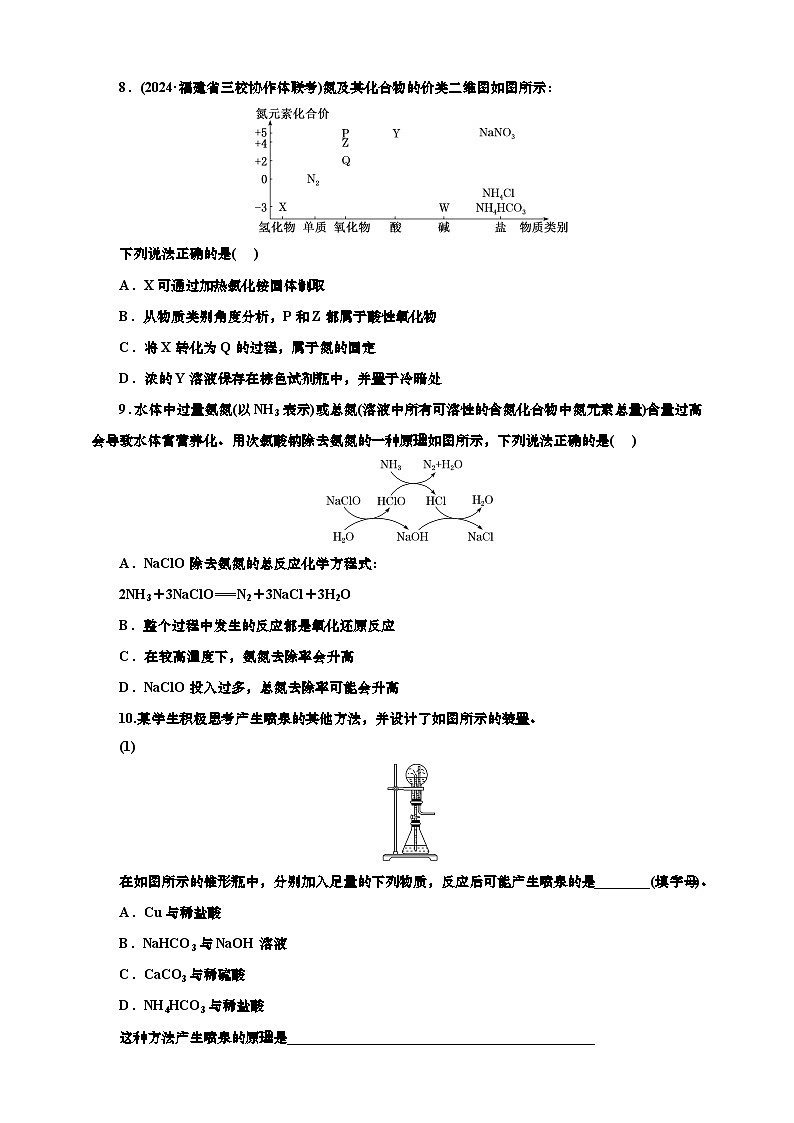
8.(2024·福建省三校协作体联考)氮及其化合物的价类二维图如图所示:
下列说法正确的是( )
A.X可通过加热氯化铵固体制取
B.从物质类别角度分析,P和Z都属于酸性氧化物
C.将X转化为Q的过程,属于氮的固定
D.浓的Y溶液保存在棕色试剂瓶中,并置于冷暗处
9.水体中过量氨氮(以NH3表示)或总氮(溶液中所有可溶性的含氮化合物中氮元素总量)含量过高会导致水体富营养化。用次氯酸钠除去氨氮的一种原理如图所示,下列说法正确的是( )
A.NaClO除去氨氮的总反应化学方程式:
2NH3+3NaClO===N2+3NaCl+3H2O
B.整个过程中发生的反应都是氧化还原反应
C.在较高温度下,氨氮去除率会升高
D.NaClO投入过多,总氮去除率可能会升高
10.某学生积极思考产生喷泉的其他方法,并设计了如图所示的装置。
(1)
在如图所示的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________(填字母)。
A.Cu与稀盐酸
B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
这种方法产生喷泉的原理是____________________________________________
________________________________________________________________________。
(2)在图示锥形瓶外放一水槽,瓶中加入酒精;水槽中加入水后,再加入足量的下列物质,结果也可产生喷泉。水槽中加入的物质可以是__________(填字母)。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
这种方法产生喷泉的原理是__________________________________________
________________________________________________________________________。
(3)
如图为化学教学中所用的喷泉实验装置。某同学用烧瓶中盛不同成分的气体进行喷泉实验,请帮助分析实验后烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。
①若用HCl气体,则c(HCl)=__________________________________________。
②若用NO2气体,则c(HNO3)=____________。
③若用n(NO2)∶n(O2)=2∶1的混合气体,则c(HNO3)=________________。
11.较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2三种气体。某同学欲用如图所示仪器组装装置来直接验证有NO、NO2生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:①NO2沸点是21.1 ℃,熔点是-11 ℃;NO的沸点是-151 ℃、熔点是-164 ℃;②氮化镁遇水会发生水解。回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是________(填序号)。
a.A→D→C→F→B→F→E
b.A→C→D→F→B→F→E
c.A→F→C→D→F→B→E
d.A→F→D→C→F→B→E
(2)确定还原产物中有NO2的现象是______________________________________
________________,实验中两次使用装置F,第二次使用装置F的作用是________________________________________________________________________。
(3)实验前需先打开开关K,向装置内通CO2气体,其目的是______________________,
当________________________时停止通入CO2。
(4)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:____________________________________________________。
(5)在A中反应开始时,某同学马上点燃B处的酒精灯,实验结束后通过测定发现B处的产品纯度不高,原因是____________________________________________
(用化学方程式回答)。
(6)验证B处有氮化镁生成的方法是___________________________________________。
课时检测(二十七)
1.A 自然界 “雷雨发庄稼”的第一步是将空气中的氮气转化为NO,工业生产硝酸的第一步是将氮气和氢气反应生成氨气,氨气催化氧化得到NO,NO被氧化为NO2,NO2和水反应最后得到硝酸,A项错误;氮的固定是将N2转化为含氮化合物的过程,其中氮的固定包括自然固氮、人工固氮,B项正确;氨气作为重要的工业原料可用于生产化肥和纯碱等大宗化学品,C项正确;氮元素在自然界中既有游离态又有化合态,多种形态的氮及其化合物间的转化形成了自然界的“氮循环”,D项正确。
2.B 依据自然界中氮的部分循环过程图可知,X为NO,Y为NO2,Z为HNO3,M为硝酸盐,N为铵盐。过程①可能是自然固氮,但过程②不属于氮的固定,A错误;X→Y发生的反应为2NO+O2===2NO2,是化合反应,B正确;NH3→N的过程元素化合价没有改变,所以不是氧化还原反应,C错误;若为硫循环,X为SO2,Y为SO3,X→Y的反应为2SO2+O2eq \(,\s\up7(催化剂),\s\d5(△))2SO3,X在空气中点燃不能得到Y,D错误。
3.A 海洋中的氮循环起始于N2→NHeq \\al(+,4),即起始于氮的还原,A正确;海洋中的氮循环中属于固氮作用的是②,B错误;反硝化作用中N元素化合价降低,被还原,而氧气是常见氧化剂,C错误;转化关系图中若NOeq \\al(-,3)增多,反硝化作用增强,向海洋排放含NOeq \\al(-,3)的废水会影响海洋中NHeq \\al(+,4)的含量,D错误。
4.A 由方程式可知,反应生成1 ml一氧化二氮,转移4 ml电子,故A正确;由方程式可知,反应中氮元素的化合价升高被氧化,NH2OH是反应的还原剂,铁元素的化合价降低被还原,铁离子是反应的氧化剂,故B、C错误;若设计成原电池,铁离子在正极得到电子发生还原反应生成亚铁离子,亚铁离子为正极产物,故D错误。
5.D 由于气体溶于水或某种溶液(或与水、某种溶液反应),导致烧瓶中的压强迅速减小,与外界产生足够的压强差,从而形成喷泉,A正确;CO2能与NaOH等强碱溶液反应,从而被吸收,能与外界产生压强差,故能形成喷泉,B正确;NH3和HCl属于极易溶于水的气体,SO2可以与NaOH溶液等反应,故均能形成喷泉,C正确;NO2和N2O4与水反应后有NO生成,故液体不能充满烧瓶,D错误。
6.C 若向题图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯和胶头滴管中加入AgNO3 溶液,硝酸银和HI反应生成黄色AgI沉淀,所以可以产生黄色喷泉,故A正确;若向题图2烧杯中加水,烧瓶中充满NH3,捂热上方的圆底烧瓶,气体膨胀,氨气与水接触,氨气迅速溶解,烧瓶内压强减小,形成喷泉,故B正确;若向题图3装置的水槽中加入冰块温度降低,氨水不能溢出氨气,压强不增大,不能形成喷泉,故C错误;题图4所示的装置,关闭活塞c,打开活塞a、b,再挤压胶头滴管,氨气溶于水,右侧烧瓶内压强减小,HCl进入右侧烧瓶,产生大量的白烟氯化铵,此时两烧瓶内压强都减小,再打开活塞c,产生双喷现象,故D正确。
7.C M中制备氨气,氨气通过安全瓶防倒吸,为使氨气充分反应,氨气由长导管通入次氯酸钠溶液中反应生成水合肼,最后尾气处理,装置的连接顺序为f→a→b→c→d→e,故A正确; 氧化钙和水反应生成氢氧化钙,该反应放热,温度升高,氢氧化钙使氨水中氢氧根离子浓度增大,所以装置M可快速制 NH3,故B正确;水的作用是吸收尾气,氨气难溶于四氯化碳,不能用CCl4代替水,故C错误;次氯酸钠具有氧化性,若操作过程中快速滴加NaClO溶液,可能使N2H4·H2O被NaClO氧化,故D正确。
8.D 根据化合价以及所属物质类别可知,X为NH3,Q为NO,Z为NO2,P为N2O5,Y为HNO3,W为NH3·H2O。直接加热氯化铵固体分解生成的HCl又会和氨气反应生成氯化铵,需加热氯化铵和氢氧化钙的混合物,A错误;Z为NO2,NO2与碱发生氧化还原反应,生成两种盐,不是酸性氧化物,B错误;氮的固定是指将游离态的氮转化为化合态,X转化为Q的过程是一种化合态转化为另一种化合态,不属于氮的固定,C错误;浓硝酸见光易分解,需保存在棕色试剂瓶中,并置于冷暗处,D正确。
9.A 根据箭头方向可知,只进去的为反应物,只出来的为生成物,NH3、NaClO是反应物,氯化钠、氮气和水是生成物,根据元素守恒和得失电子守恒写出化学方程式为2NH3 + 3NaClO===N2+3NaCl+3H2O,A正确;其中NaClO与水反应、氢氧化钠与盐酸的反应中,元素的化合价没有发生变化,不是氧化还原反应,B错误;NH3易挥发,温度较高时溶解度减小,氨氮去除率会降低,C错误;具有强氧化性的NaClO投入过多,会氧化部分NH3生成NOeq \\al(-,3),总氮去除率可能会下降,D错误。
10.解析:(1)Cu与稀盐酸不反应,NaHCO3与NaOH溶液反应不产生气体,不能形成压强差,故不能形成喷泉;CaCO3与稀硫酸反应产生CO2,但生成的CaSO4微溶于水,覆盖在CaCO3的表面,会使反应很快停止,不能形成较大的压强差,故不能形成喷泉;NH4HCO3与稀盐酸反应能产生较多的CO2气体,使锥形瓶内压强远大于烧瓶内压强,从而形成喷泉。(2)浓硫酸(或生石灰、烧碱等)溶于水均能放出大量的热,使酒精大量挥发,形成较大的压强差,从而形成喷泉;氯化钠、硝酸钾、硫酸铜溶于水温度变化不大,不能使酒精大量挥发,不能形成较大的压强差,故不能形成喷泉。(3)设烧瓶的容积为V L,则气体(混合气体)的物质的量均为eq \f(V,22.4) ml。①若用HCl气体,喷泉后,溶液充满烧瓶,则溶液的体积为V L,c(HCl)=eq \f(\f(V,22.4) ml,V L)=eq \f(1,22.4) ml·L-1。②若用NO2,喷泉后,溶质为HNO3,
3NO2+H2O===2HNO3+NO
eq \f(V,22.4) ml eq \f(2,3)×eq \f(V,22.4) ml
则喷泉后溶液的体积为eq \f(2,3)V L,c(HNO3)=eq \f(\f(2,3)×\f(V,22.4) ml,\f(2,3)V L)=eq \f(1,22.4) ml·L-1。③若为n(NO2)∶n(O2)=2∶1的混合气体,喷泉后,反应剩余eq \f(1,6)的O2,溶液充至烧瓶的eq \f(5,6),溶质为HNO3,
4NO2 + O2 +2H2O===4HNO3
eq \f(V,22.4)×eq \f(2,3) eq \f(V,22.4)×eq \f(2,3)×eq \f(1,4) eq \f(V,22.4)×eq \f(2,3)
则喷泉后溶液的体积为eq \f(5,6)V L,c(HNO3)=eq \f(\f(V,22.4)×\f(2,3) ml,\f(5,6)V L)=eq \f(1,28) ml·L-1。
答案:(1)D NH4HCO3与稀盐酸反应产生二氧化碳气体,锥形瓶中气体压强增大,把液体压入烧瓶中,形成喷泉
(2)A 浓硫酸溶于水放出大量的热,使锥形瓶中的酒精挥发,锥形瓶中气体压强增大,把酒精压入烧瓶中形成喷泉
(3)①eq \f(1,22.4) ml·L-1 ②eq \f(1,22.4) ml·L-1 ③eq \f(1,28) ml·L-1
11.解析:(1)根据题意“一定浓度的硝酸与镁反应,可同时得到NO、NO2、N2”,若有NO2生成则气体呈红棕色,根据已知①中NO2、NO的熔沸点,在装置D中可将NO2冷凝为液态,可观察到装置D中有红棕色液体生成;利用NO具有还原性,用装置C中酸性KMnO4溶液验证NO;根据已知②中Mg3N2遇水会发生水解,与Mg反应的N2必须是干燥的,气体在进入装置B之前必须用浓硫酸干燥,且要防止H2O(g)进入制备Mg3N2的装置;装置的连接顺序为A→D→C→F→B→F→E。(2)确定还原产物中有NO2的现象是装置D中有红棕色液体生成;Mg3N2遇水会发生水解,实验中两次使用装置F,第一次使用装置F的作用是干燥N2,第二次使用装置F的作用是防止E中H2O(g)进入B中,使Mg3N2不纯。(3)由于NO能与O2反应生成NO2,会影响NO2、NO的验证,实验开始前要排出装置中的空气,所以实验前先打开开关K,向装置内通CO2气体。当观察到装置E中产生白色沉淀时,表明装置中空气已经排尽,停止通入CO2。(4)装置D中观察到有红棕色液体出现,装置C中溶液颜色慢慢褪去,说明酸性KMnO4溶液将NO氧化成NOeq \\al(-,3),同时MnOeq \\al(-,4)被还原成
Mn2+,结合得失电子守恒、元素守恒、电荷守恒,写出离子方程式为5NO+3MnOeq \\al(-,4)+4H+===5NOeq \\al(-,3)+3Mn2++2H2O。(5)在A中反应开始时,马上点燃B处的酒精灯,Mg与CO2发生置换反应生成MgO和C,导致实验结束后B处制得的Mg3N2纯度不高,化学方程式为2Mg+CO2eq \(=====,\s\up7(△))2MgO+C。(6)Mg3N2遇水发生水解生成Mg(OH)2和NH3,检验有Mg3N2生成只要检验B处固体中加水产生NH3即可。
答案:(1)a (2)D中有红棕色液体生成 防止E中水蒸气进入B中,造成产物不纯
(3)排出装置内空气,防止干扰实验 E中产生白色沉淀
(4)5NO+3MnOeq \\al(-,4)+4H+===3Mn2++5NOeq \\al(-,3)+2H2O
(5)CO2+2Mgeq \(=====,\s\up7(△))2MgO+C
(6)取B中固体少量于试管中,向其中加入少量水,若产生能使湿润的红色石蕊试纸变蓝的气体,则B中有氮化镁生成
相关试卷
这是一份2025年高考化学一轮复习 课时检测二:物质的转化及传统文化(含解析),共7页。试卷主要包含了古诗文经典已融入中华民族的血脉,“银朱”主要成分为HgS等内容,欢迎下载使用。
这是一份2025年高考化学一轮复习 课时检测一:物质的分类及转化的基本知能评价(含解析),共4页。试卷主要包含了下列说法不正确的是等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习课时跟踪练23硝酸氮及其化合物的相互转化,共8页。








