

2025年高考化学一轮复习 课时检测三十九:晶体结构的比较及晶胞相关计算(含解析)
展开A.催化活性:①>②
B.镍酸镧晶体的化学式为LaNiO3
C.La周围紧邻的O有4个
D.La和Ni的最短距离为eq \f(\r(3),2)a
2.(2023·重庆等级考)配合物[MA2L2]的分子结构以及分子在晶胞中的位置如图所示,下列说法错误的是( )
A.中心原子的配位数是4
B.晶胞中配合物分子的数目为2
C.晶体中相邻分子间存在范德华力
D.该晶体属于混合型晶体
3.某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则下列说法错误的是( )
A.方块A含有1个Fe2+、4个O2-
B.方块B含有0.5个Fe2+、4个O2-、4个Fe3+
C.该氧化物中Fe2+、Fe3+、O2-的个数比为1∶2∶4
D.晶胞的棱长为 eq \r(3,\f(8×232,NA·d))×107 nm
4.
砷化镓(GaAs)作为第二代半导体材料的代表,具有宽禁带、高频、高压、抗辐射、耐高温及发光效率高的特点,被广泛应用于移动通信、无线通信、光纤通信、LED、卫星导航等领域。GaAs晶胞结构如图所示,晶胞边长为a pm,下列说法正确的是( )
A.GaAs属于离子晶体
B.基态砷原子价层电子排布图为
C.As的配位数为4
D.该晶体密度为eq \f(5.8×1036,NA×a3) g·cm-3
5.(2024·北京朝阳区检测)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的晶胞如图1所示,晶胞棱长为z pm,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。下列说法错误的是( )
A.该铁氮化合物的化学式为Fe4N
B.晶体中与每个N距离最近且等距离的N有6个
C.两个b位置Fe的最近距离为eq \f(\r(2),2)z pm
D.其中更稳定的Cu替代型产物的化学式为FeCu3N
6.
已知NixMg1-xO晶体属立方晶系,晶胞边长为a。将Li+掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.该结构单元中O个数为3
B.Ni和Mg间的最短距离为eq \f(\r(2),2)a
C.Ni的配位数为12
D.该物质的化学式为
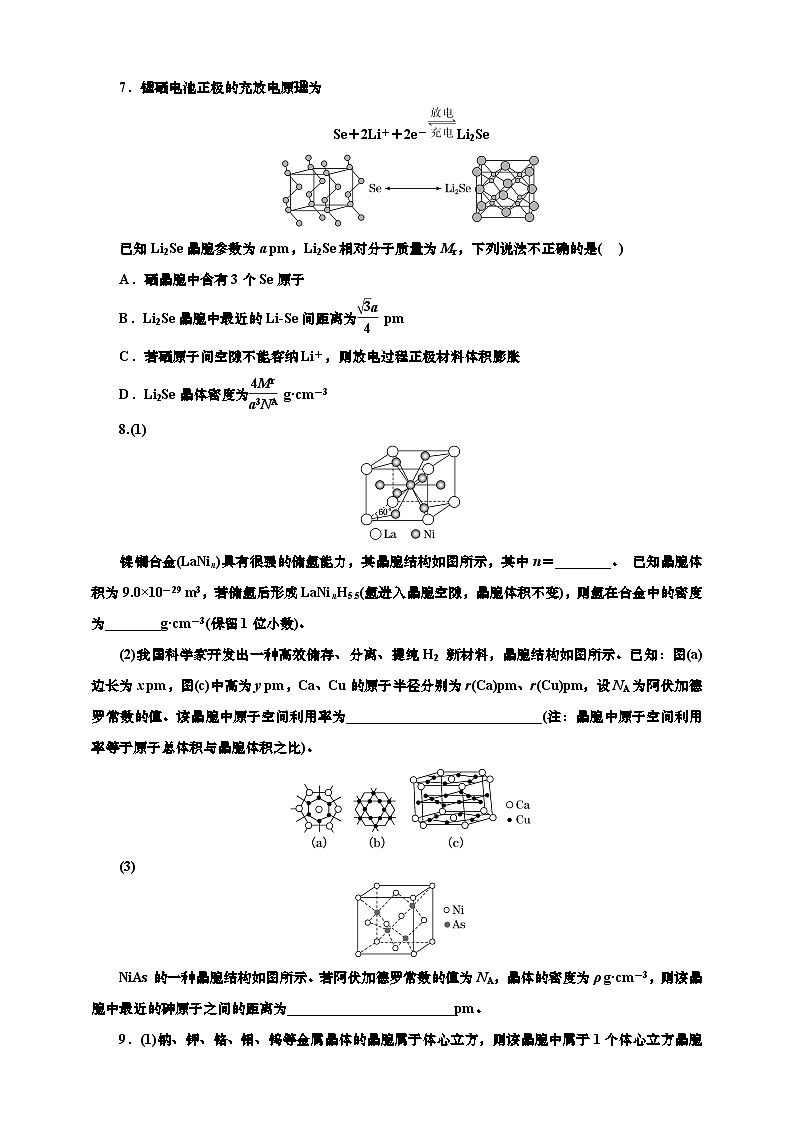
7.锂硒电池正极的充放电原理为
Se+2Li++2e-Li2Se
已知Li2Se晶胞参数为a pm,Li2Se相对分子质量为Mr,下列说法不正确的是( )
A.硒晶胞中含有3个Se原子
B.Li2Se晶胞中最近的LiSe间距离为eq \f(\r(3)a,4) pm
C.若硒原子间空隙不能容纳Li+,则放电过程正极材料体积膨胀
D.Li2Se晶体密度为eq \f(4Mr,a3NA) g·cm-3
8.(1)
镍镧合金(LaNin)具有很强的储氢能力,其晶胞结构如图所示,其中n=________。 已知晶胞体积为9.0×10-29 m3,若储氢后形成LaNinH5.5(氢进入晶胞空隙,晶胞体积不变),则氢在合金中的密度为________g·cm-3(保留1位小数)。
(2)我国科学家开发出一种高效储存、分离、提纯H2 新材料,晶胞结构如图所示。已知:图(a)边长为x pm,图(c)中高为y pm,Ca、Cu的原子半径分别为r(Ca)pm、r(Cu)pm,设NA为阿伏加德罗常数的值。该晶胞中原子空间利用率为____________________________(注:晶胞中原子空间利用率等于原子总体积与晶胞体积之比)。
(3)
NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g·cm-3,则该晶胞中最近的砷原子之间的距离为________________________pm。
9.(1)钠、钾、铬、钼、钨等金属晶体的晶胞属于体心立方,则该晶胞中属于1个体心立方晶胞的金属原子数目是________。氯化铯晶体的晶胞如图1,则Cs+位于该晶胞的________,Cl-位于该晶胞的________;Cs+的配位数是________。
(2)铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:________________________________________________________________________
________________________________________________________________________。
(3)图3为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“eq \a\vs4\al(○)”表示的离子是______(填离子符号)。
(4)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图4所示),已知3种离子晶体的晶格能(注:反映离子键强弱的物理量)数据如表:
则这4种离子晶体(不包括NaCl)熔点从高到低的顺序是________________________。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有________个。
10.理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge被Hg和Sb取代后形成。
(1)图b为Ge晶胞中部分Ge被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
________________________________________________________________________
________________________________________________________________________。
(2)图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为________;该晶胞中粒子个数比Hg∶Ge∶Sb =__________________。
(3)设X的最简式的式量为Mr,则X晶体的密度为____________g·cm-3(列出算式)。
课时检测(三十九)
1.C 具有催化活性的是Ni,图②中没有Ni原子,则催化活性:①>②,故A正确;镍酸镧电催化剂立方晶胞中含有1个Ni,12×eq \f(1,4)=3个O,8×eq \f(1,8)=1个La,镍酸镧晶体的化学式为LaNiO3,故B正确;由晶胞结构可知,La在晶胞体心,O在晶胞的棱心,则La周围紧邻的O有12个,故C错误;由晶胞结构可知,La和Ni的最短距离为体对角线的一半,为eq \f(\r(3),2)a,故D正确。
2.D 由配合物[MA2L2]的分子结构可知,中心原子M形成了4个配位键,故中心原子的配位数是4,A正确;由晶胞结构可知,晶胞中配合物分子位于晶胞顶点和上下底面面心,数目为8×eq \f(1,8)+2×eq \f(1,2)=2,B正确;该晶体为配合物分子组成的分子晶体,晶体中相邻分子间存在范德华力,C正确,D错误。
3.A 根据均摊法计算,方块A含有1+4×eq \f(1,8)=1.5个Fe2+、4个O2-,故A错误。根据均摊法计算,方块B含有4×eq \f(1,8)=0.5个Fe2+、4个O2-、4个Fe3+,故B正确。Fe2+位于晶胞的顶点、面心以及方块A的体心,O2-位于方块A、B的内部,Fe3+位于方块B的内部;晶胞中Fe2+数目=4+8×eq \f(1,8)+6×eq \f(1,2)=8、Fe3+数目=4×4=16,O2-数目=4×8=32,故该氧化物中Fe2+、Fe3+、O2-的个数比为8∶16∶32=1∶2∶4,故C正确。设该晶胞的棱长为a cm,晶胞中含有Fe2+、Fe3+、O2-的个数分别为8、16、32,它们的相对原子质量之和是8×232,有8×232=d×a3×NA,解得a= eq \r(3,\f(8×232,NA·d)),即晶胞的棱长为 eq \r(3,\f(8×232,NA·d))×107 nm,故D正确。
4.C 由砷化镓耐高温的特点可知,砷化镓是熔沸点很高的共价晶体,A错误;基态砷原子的价层电子排布图为,B错误;由GaAs晶胞结构图可知,与砷原子距离最近的镓原子的个数为4,故As的配位数为4,C正确;由GaAs晶胞结构图知,位于晶体内部的砷原子个数为4,位于顶点和面心的镓原子个数为8×eq \f(1,8)+6×eq \f(1,2)=4,故该晶体的密度为eq \f(\f(4×70+75,NA),a×10-103) g·cm-3=eq \f(5.8×1032,NA×a3) g·cm-3,D错误。
5.D Fe位于8个顶点、6个面心,个数为8×eq \f(1,8)+6×eq \f(1,2)=4,N位于体心,个数为1,故该铁氮化合物的化学式为Fe4N,A正确;晶体中与每个N距离最近且等距离的N有6个,分别在与之相邻的上下、左右、前后位置,B正确;两个b位置Fe的最近距离为大立方体面对角线的一半,即eq \f(\r(2),2)z pm,C正确;Cu替代a位置Fe型能量更低更稳定,其化学式为Fe3CuN,D错误。
6.B 由均摊法可知该结构单元中O个数=1+12×eq \f(1,4)=4,A错误;由晶胞结构图可知,Ni和Mg间的最短距离为晶胞面对角线的一半,即eq \f(\r(2),2)a,B正确;由晶胞结构图可知,Ni的配位数为6,C错误;1个晶胞中Li的个数=1×eq \f(1,2)=0.5,Mg的个数=2×eq \f(1,2)+1×eq \f(1,8)=1.125,Ni的个数=7×eq \f(1,8)+3×eq \f(1,2)=2.375,O的个数=4,因此该物质的化学式为,D错误。
7.D 从硒晶胞中可以看出,Se间以链状连接,每3个Se为1个重复单元,因此我们可以用一个点表示3个Se:,在硒晶胞中这样的点都在顶点,所以硒晶胞中含有3个Se,A项正确。Li2Se晶胞中Se为面心立方堆积,Li+填充在四面体空隙中,四面体空隙中心在体对角线eq \f(1,4)处,因此最近的LiSe间距离为eq \f(\r(3)a,4) pm,B项正确。放电过程正极得到电子,因此对应反应式为Se+2Li++2e-―→Li2Se,Li+嵌入硒原子间空隙,使材料体积膨胀,C项正确。Li2Se晶胞中Se为面心立方堆积,含有4个Se,即含有4个Li2Se,晶体密度为eq \f(4Mr,a×10-103NA) g·cm-3,题目中没有将a pm转化为a×10-10cm,D项错误。
8.解析:(1)由晶胞结构图可知,晶胞中位于面上和体心的镍原子个数为8×eq \f(1,2)+1=5,由储氢后形成LaNinH5.5可知,晶胞中氢原子的质量为eq \f(5.5×1,NA) g,则氢在合金中的密度为eq \f(\f(5.5×1,NA),9.0×10-29×106 cm3)≈0.1 g·cm-3。(2)观察题图(c)知,钙位于六棱柱的顶点和上、下面心,铜位于面上和体内;1个晶胞含铜原子数为18×eq \f(1,2)+6=15,含钙原子数为12×eq \f(1,6)+2×eq \f(1,2)=3,晶体的化学式为CaCu5;题图(a)面积为eq \f(\r(3),2)x×x×eq \f(1,2)×6 pm2=eq \f(3\r(3),2)x2 pm2,题图(c)体积为eq \f(3\r(3),2)x2y pm3,原子空间利用率等于原子总体积与晶胞体积之比,即eq \f(\f(4,3)π\b\lc\[\rc\](\a\vs4\al\c1(3r3Ca+15r3Cu)),\f(3\r(3),2)x2y)×100%。(3)该晶胞中含有Ni个数为8×eq \f(1,8)+6×eq \f(1,2)=4,含有As个数为4,即含有4个NiAs,其质量为4×eq \f(134,NA) g,设其棱长为a cm,有4×eq \f(134,NA) g=(a cm)3×ρ g·cm-3,As位于其八分之一晶胞的中心,两个As之间的距离相当于面对角线长度的一半,所以两个As之间的距离为eq \f(\r(2),2)a cm=eq \b\lc\(\rc\)(\a\vs4\al\c1(\f(\r(2),2)× \r(3,\f(134×4,ρNA))×1010))pm。
答案:(1)5 0.1 (2)eq \f(\f(4,3)π\b\lc\[\rc\](\a\vs4\al\c1(3r3Ca+15r3Cu)),\f(3\r(3),2)x2y)×100% (3)eq \f(\r(2),2)× eq \r(3,\f(134×4,ρNA))×1010
9.解析:(1)体心立方晶胞中,1个原子位于体心,8个原子位于立方体的顶点,故该晶胞中属于1个体心立方晶胞的金属原子数目为8×eq \f(1,8)+1=2;氯化铯晶胞中,Cs+位于体心,Cl-位于顶点,Cs+的配位数为8。(2)由晶胞结构图可知,灰球、白球个数比为1∶1,则铜的氢化物的化学式为CuH,CuH与Cl2反应的化学方程式为2CuH+3Cl2eq \(=====,\s\up7(点燃))2CuCl2+2HCl。(3)由晶胞结构图可知,1个晶胞中黑球有1个,灰球有1个,白球有3个,由电荷守恒可知n(Mg2+)∶n(K+)∶n(F-)=1∶1∶3,故白球代表F-。(4)从3种离子晶体的晶格能数据可知,离子所带电荷越多、离子半径越小,离子晶体的晶格能越大,离子所带电荷数:Ti3+>Mg2+>K+,离子半径:Mg2+<Ca2+,所以熔点:TiN>MgO>CaO>KCl;MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有12个。
答案:(1)2 体心 顶点 8 (2)2CuH+3Cl2eq \(=====,\s\up7(点燃))2CuCl2+2HCl
(3)F- (4)TiN>MgO>CaO>KCl 12
10.解析:(1)题图b中上、下两个面的面心原子分别为Hg和Ge,晶胞结构不对称,不符合晶胞平移后重合的特性,因此不是晶胞单元。(2)由题图c可知,X的晶体中与Hg距离最近的Sb的数目为4;该晶胞中Hg个数=4×eq \f(1,4)+6×eq \f(1,2)=4,Ge个数=8×eq \f(1,8)+4×eq \f(1,2)+1=4,Sb个数为8,故该晶胞中Hg、Ge、Sb粒子个数比为4∶4∶8=1∶1∶2。(3)该晶胞的组成为Hg4Ge4Sb8,由于最简式的式量为Mr,则晶胞的质量为eq \f(4Mr,NA) g,晶胞的体积为x2y×10-21 cm3,则晶体的密度为eq \f(\f(4Mr,NA),x2y×10-21) g·cm-3=eq \f(4Mr,NAx2y×10-21) g ·cm-3。
答案:(1)图b中上、下两个面的原子不同,不符合晶胞平移后重合的特性
(2)4 1∶1∶2 (3)eq \f(4Mr,NAx2y×10-21)
离子晶体
NaCl
KCl
CaO
晶格能/(kJ·ml-1)
786
715
3 401
2025年高考化学一轮复习 课时检测四十六:串联电池及电池的相关计算(含解析: 这是一份2025年高考化学一轮复习 课时检测四十六:串联电池及电池的相关计算(含解析,共7页。
2025年高考化学一轮复习 课时检测四十二:反应热的相关计算(含解析): 这是一份2025年高考化学一轮复习 课时检测四十二:反应热的相关计算(含解析),共9页。试卷主要包含了关于下列ΔH的判断正确的是,解析等内容,欢迎下载使用。
高考化学一轮复习微专题10晶胞结构的分析及相关计算学案: 这是一份高考化学一轮复习微专题10晶胞结构的分析及相关计算学案,共6页。试卷主要包含了晶胞参数及相关计算,原子分数坐标等内容,欢迎下载使用。












