

2025年高考化学一轮复习 课时检测五十一:速率常数与平衡常数的相关计算(含解析)
展开A.p总1
C.图2中M点能正确表示600 K时该反应平衡常数的对数(lgK)
D.若p总1=0.25 MPa,则Y点的平衡常数Kp=32 (MPa)-2
2.SO2与Cl2反应可制得磺酰氯(SO2Cl2),反应为SO2(g)+Cl2(g)⥫⥬ SO2Cl2(g)。按投料比1∶1把SO2与Cl2充入一恒压的密闭容器中发生上述反应,SO2的转化率与温度T的关系如图所示:
若反应一直保持在p压强条件下进行,则M点的压强平衡常数Kp为( )
A.eq \f(3,p) B.p C.2p D.4p
3.反应2NO(g)+2H2(g)===N2(g)+2H2O(g)中,每生成7 g N2,放出166 kJ的热量,该反应的速率表达式为v=k·cm(NO)·cn(H2)(k、m、n待测),其反应包含下列两步:
①2NO+H2===N2+H2O2(慢)
②H2O2+H2===2H2O(快)
T ℃时测得有关实验数据如下:
下列说法错误的是( )
A.整个反应速率由第①步反应决定
B.正反应的活化能一定是①>②
C.该反应速率表达式:v=5 000c2(NO)·c(H2)
D.该反应的热化学方程式为
2NO(g)+2H2(g)===N2(g)+2H2O(g)ΔH=+664 kJ·ml-1
4.工业上C2H5OH催化氧化可制得H2,主要反应如下:
反应Ⅰ 2C2H5OHeq \b\lc\(\rc\)(\a\vs4\al\c1(g))+3O2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))⥫⥬ 4CO2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))+6H2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))ΔH=-552.0 kJ·ml-1
反应Ⅱ 2C2H5OHeq \b\lc\(\rc\)(\a\vs4\al\c1(g))+O2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))⥫⥬ 4COeq \b\lc\(\rc\)(\a\vs4\al\c1(g))+6H2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))ΔH=+28.2 kJ·ml-1
还可能发生下列副反应:
反应Ⅲ CO2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))+4H2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))⥫⥬ CH4eq \b\lc\(\rc\)(\a\vs4\al\c1(g))+2H2Oeq \b\lc\(\rc\)(\a\vs4\al\c1(g))ΔH=-164.8 kJ·ml-1
反应Ⅳ CH4eq \b\lc\(\rc\)(\a\vs4\al\c1(g))⥫⥬ Ceq \b\lc\(\rc\)(\a\vs4\al\c1(s))+2H2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))ΔH=-77.95 kJ·ml-1
反应Ⅴ COeq \b\lc\(\rc\)(\a\vs4\al\c1(g))+H2eq \b\lc\(\rc\)(\a\vs4\al\c1(g))⥫⥬ Ceq \b\lc\(\rc\)(\a\vs4\al\c1(s))+H2Oeq \b\lc\(\rc\)(\a\vs4\al\c1(g))ΔH=-114.8 kJ·ml-1
研究发现,在实验条件下,乙醇的转化率都接近100%。1×105Pa、氧醇比为0.6时,部分气体产物(H2、CO、CO2和CH4)的平衡分压ppeq \b\lc\(\rc\)(\a\vs4\al\c1(H2))=eq \f(n\b\lc\(\rc\)(\a\vs4\al\c1(H2)),n总\b\lc\(\rc\)(\a\vs4\al\c1(气体)))×p总随温度的变化如图所示。已知:用气体物质的分压替换浓度计算得到的平衡常数称为分压平衡常数eq \b\lc\(\rc\)(\a\vs4\al\c1(Kp))。下列说法正确的是( )
A.500 K时,反应体系中一定有积碳产生
B.曲线①表示CO2的平衡分压随温度的变化
C.720 K时,反应Ⅳ的Kp=0.2
D.其他条件一定,增加体系压强,产物中氢气的量增多
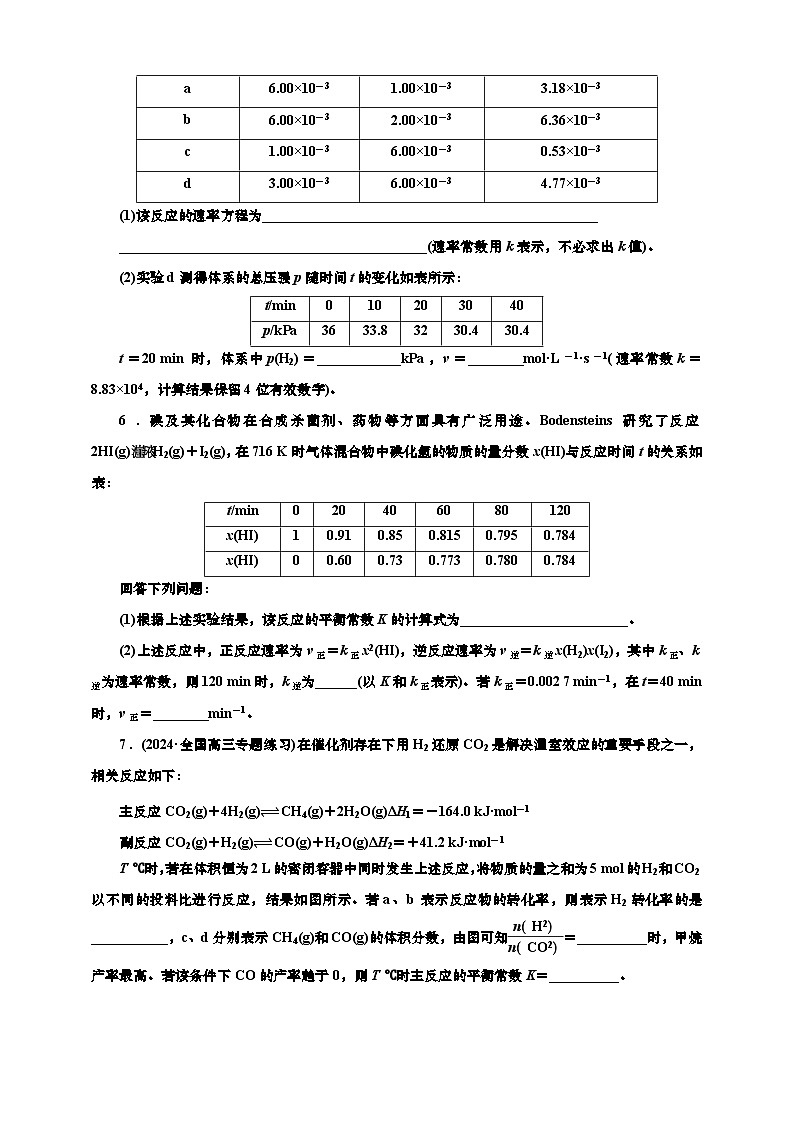
5.(2024·武汉模拟)为测定c(H2)、c(NO)与反应2NO(g)+2H2(g)⥫⥬ N2(g)+2H2O(g)的关系,某兴趣小组同学在T ℃、容积为1 L的密闭容器中进行实验,获得如表所示实验数据。
(1)该反应的速率方程为________________________________________________
____________________________________________(速率常数用k表示,不必求出k值)。
(2)实验d测得体系的总压强p随时间t的变化如表所示:
t=20 min时,体系中p(H2)=____________kPa,v=________ml·L-1·s-1(速率常数k=8.83×104,计算结果保留4位有效数字)。
6.碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。Bdensteins研究了反应2HI(g)H2(g)+I2(g),在716 K时气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
回答下列问题:
(1)根据上述实验结果,该反应的平衡常数K的计算式为________________________。
(2)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则120 min时,k逆为______(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=________min-1。
7.(2024·全国高三专题练习)在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应CO2(g)+4H2(g)⥫⥬ CH4(g)+2H2O(g)ΔH1=-164.0 kJ·ml-1
副反应CO2(g)+H2(g)⥫⥬ CO(g)+H2O(g)ΔH2=+41.2 kJ·ml-1
T ℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 ml的H2和CO2以不同的投料比进行反应,结果如图所示。若a、b表示反应物的转化率,则表示H2转化率的是___________,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知eq \f(nH2,nCO2)=__________时,甲烷产率最高。若该条件下CO的产率趋于0,则T ℃时主反应的平衡常数K=__________。
8.机动车尾气的主要污染物是氮的氧化物,采用合适的催化剂可分解NO,反应为2NO(g)⥫⥬ N2(g)+O2(g) ΔH,在T1℃和T2℃时,分别在容积均为1 L的密闭容器中通入1 ml NO,并发生上述反应,NO的转化率随时间的变化曲线如图所示:
(1)T1______T2,ΔH______0。(填“>”或“<”)
(2)温度为T1℃时,该反应的平衡常数K=__________(结果保留3位小数)。已知反应速率v正=k正c2(NO),v逆=k逆c(N2)·c(O2),k正、k逆分别为正反应速率常数和逆反应速率常数,则a点处eq \f(v正,v逆)=__________。
9.工业上用二氧化碳催化加氢可合成乙醇,其反应原理为2CO2(g)+6H2(g)⥫⥬ C2H5OH(g)+3H2O(g) ΔH。
(1)该反应的ΔH________(填“>”“<”或“=”) 0;其正反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
(2)该反应的反应速率表达式为v正=k正 ·c2(CO2)·c6(H2),v逆=k逆·c(C2H5OH)·c3(H2O),其中k正、k逆为速率常数。则该反应的平衡常数K=________(用含k正、k逆的代数式表示),若其他条件不变,降低温度,则下列推断合理的是________(填标号)。
A.k正增大,k逆减小
B.k正减小,k逆增大
C.k正减小的倍数大于k逆
D.k正减小的倍数小于k逆
课时检测(五十一)
1.B 压强增大,CO(g)+2H2(g)⥫⥬ CH3OH(g)平衡正向移动,甲醇物质的量增大,故p总1>p总2,A错误;ρ=eq \f(m,V),气体质量不变,容器容积可变,达到平衡时,容器容积不变,则ρ不变,故混合气体的密度不再发生变化可说明该反应已达到平衡状态,B正确;由题图1可知,压强一定时,升高温度,甲醇的物质的量减少,平衡逆向移动,则lgK减小,由题图2知,500 K时,lgK对应的点为Q,升温lgK减小,故N点能正确表示600 K时该反应平衡常数的对数(lgK),C错误;X、Y点温度相同,则平衡常数相同,X点甲醇的物质的量为0.25 ml,则列三段式可得:
CO(g)+2H2(g)⥫⥬ CH3OH(g)
起始量/ml 0.5 1 0
转化量/ml 0.25 0.5 0.25
平衡量/ml 0.25 0.5 0.25
则K(Y)=K(X)=
eq \f(\f(0.25,0.25+0.25+0.5)×0.25 MPa,\b\lc\(\rc\)(\a\vs4\al\c1(\f(0.25,0.25+0.25+0.5)×0.25 MPa))×\b\lc\(\rc\)(\a\vs4\al\c1(\f(0.5,0.25+0.25+0.5)×0.25 MPa))2)=64 (MPa)-2,D错误。
2.A 据图可知M点SO2的转化率为50%,设初始投料为2 ml SO2和2 ml Cl2,列三段式有
SO2(g)+Cl2(g)⥫⥬ SO2Cl2(g)
起始/ml 2 2 0
转化/ml 1 1 1
平衡/ml 1 1 1
所以p(SO2)=p(Cl2)=p(SO2Cl2)=eq \f(1,3)p,所以Kp=eq \f(\f(1,3)p,\f(1,3)p×\f(1,3)p)=eq \f(3,p)。
3.D 反应过程中反应慢的反应①决定整个反应速率,A正确;反应①慢,说明第①步反应的活化能高,正反应的活化能一定是①>②,B正确;比较实验Ⅰ、Ⅱ数据可知,NO浓度不变,氢气浓度增大一倍,反应速率增大一倍,比较实验Ⅲ、Ⅳ数据可知,H2浓度不变,NO浓度增大一倍,反应速率增大四倍,据此得到速率方程:v=kc2(NO)·c(H2),依据实验Ⅰ中数据计算k=5 000,则速率表达式为v=5 000c2(NO)·c(H2),C正确;反应2NO(g)+2H2(g)===N2(g)+2H2O(g)中,每生成7 g N2放出166 kJ的热量,生成28 g N2放热664 kJ,热化学方程式为2NO(g)+2H2(g)===N2(g)+2H2O(g) ΔH=-664 kJ·ml-1,D错误。
4.A 反应Ⅰ是放热反应,反应Ⅱ是吸热反应,升高温度,反应Ⅰ平衡逆向移动,反应Ⅱ平衡正向移动,CO2的平衡分压减小,CO的平衡分压增大,因此曲线①表示CO的平衡分压随温度的变化,曲线②表示CO2的平衡分压随温度的变化。由题图可知,500 K时,H2、CO、CO2、CH44种气体中H2和CO的平衡分压最小,说明反应Ⅴ正向进行的程度大,反应体系中一定有积碳产生,故A正确;由分析可知,曲线①表示CO的平衡分压随温度的变化,故B错误;反应Ⅳ的Kp=eq \f(p2\b\lc\(\rc\)(\a\vs4\al\c1(H2)),p\b\lc\(\rc\)(\a\vs4\al\c1(CH4))),由题图可知,720 K时,peq \b\lc\(\rc\)(\a\vs4\al\c1(CH4))=peq \b\lc\(\rc\)(\a\vs4\al\c1(H2)),则Kp=p(H2)=0.2×105,故C错误;反应Ⅰ、Ⅱ均是气体体积增大的反应,增加体系压强,平衡均逆向移动,产物中氢气的量减少,故D错误。
5.解析:(1)对比a、b组实验可知,反应速率与c(H2)成正比,对比c、d组实验可知,反应速率与c2(NO)成正比,故该反应的速率方程为v=k·c(H2)·c2(NO)。(2)兴趣小组同学在T ℃、容积为1 L的密闭容器中进行实验,根据表格所给数据,设生成N2的浓度为x ml·L-1,列三段式如下:
2H2(g) + 2NO(g)⥫⥬ N2(g)+ 2H2O(g)
eq \a\vs4\al( 起始/,ml·L-1) eq \a\vs4\al(6.00×,10-3) eq \a\vs4\al(3.00×,10-3) 0 0
eq \a\vs4\al( 转化/,ml·L-1) 2x 2x x 2x
eq \a\vs4\al( 20 min/,ml·L-1) eq \a\vs4\al(6.00×10-3,-2x) eq \a\vs4\al(3.00×10-3,-2x)x 2x
由此得20 min时气体总物质的量=(9×10-3-x)ml·L-1×1 L=(9×10-3-x)ml;恒温恒容下,气体的压强之比等于物质的量之比,eq \f(p始,p20 min)=eq \f(n始,n20 min),即eq \f(36,32)=eq \f(9.00×10-3,9×10-3-x),解得x=1×10-3,故20 min 时,n(H2)=(6×10-3-2x)ml·L-1×1 L=4×10-3 ml,n(总)=(9×10-3-x)ml=8×10-3 ml,故p(H2)=p(总)·eq \f(nH2,n总)=32 kPa×eq \f(4×10-3 ml,8×10-3 ml)=16 kPa;20 min时,c(H2)=4×10-3 ml·L-1,c(NO)=(3×10-3-2x)ml·L-1=1×10-3 ml·L-1,故反应速率v=k·c(H2)·c2(NO)=[8.83×104×4×10-3×(1×10-3)2]ml·L-1·s-1=3.532×10-4 ml·L-1·s-1。
答案:(1)v=kc(H2)·c2(NO) (2)16 3.532×10-4
6.解析:(1)由表中数据可知,无论是从正反应方向开始,还是从逆反应方向开始,最终x(HI)均为0.784,说明此时已达到了平衡状态。设HI的初始浓度为1 ml·L-1,则:
2HI(g)⥫⥬ H2(g)+I2(g)
初始浓度/(ml·L-1) 1 0 0
eq \a\vs4\al(转化浓度/ml·L-1) 0.216 0.108 0.108
eq \a\vs4\al(平衡浓度/ml·L-1) 0.784 0.108 0.108
K=eq \f(cH2·cI2,c2HI)=eq \f(0.108×0.108,0.7842)
(2)建立平衡时,v正=v逆,即k正x2(HI)=k逆x(H2)·x(I2),k逆=eq \f(x2HI,xH2·xI2)k正=eq \f(c2HI,cH2·cI2)k正=eq \f(k正,K)。在40 min时,x(HI)=0.85,则v正=0.002 7 min-1×0.852≈1.95×10-3 min-1。
答案:(1)eq \f(0.108×0.108,0.7842) (2)eq \f(k正,K) 1.95×10-3
7.解析:随着eq \f(nH2,nCO2)增大,H2的平衡转化率减小,CO2的平衡转化率增大,结合题图可得,b表示H2的平衡转化率,a表示CO2的平衡转化率。c表示甲烷的体积分数,当eq \f(nH2,nCO2)=4时,甲烷产率最高,CO的产率趋于0,由题意并结合题图得起始时c(CO2)=0.5 ml·L-1,c(H2)=2 ml·L-1,CO2、H2的平衡转化率均为0.80,则列如下三段式:
CO2(g)+4H2(g)⥫⥬ CH4(g)+2H2O(g)
起始/
(ml·L-1) 0.5 2 0 0
转化/
(ml·L-1) 0.4 1.6 0.4 0.8
平衡/
(ml·L-1) 0.1 0.4 0.4 0.8
平衡常数K=eq \f(c2H2O·cCH4,cCO2·c4H2)=eq \f(0.82×0.4,0.1×0.44)=100。
答案:b 4 100
8.解析:(1)由图像可知,T1℃下反应先达到化学平衡,故T1>T2,又T1℃下NO的平衡转化率低于T2℃下NO的平衡转化率,即降低温度,平衡向正反应方向移动,故ΔH<0。(2)T1℃条件下NO的平衡转化率为21%,利用“三段式”法计算:
2NO(g)⥫⥬ N2(g)+O2(g)
起始/(ml·L-1) 1 0 0
转化/(ml·L-1) 0.21 0.105 0.105
平衡/(ml·L-1) 0.79 0.105 0.105
则平衡常数K=0.105 ml·L-1×0.105 ml·L-1÷(0.79 ml·L-1)2≈0.018。反应达到平衡时,v正=v逆,故k正c2(NO)=k逆c(N2)·c(O2),即eq \f(k正,k逆)=K=0.018,a点对应的NO的转化率为20%,利用“三段式”法计算:
2NO(g)⥫⥬ N2(g)+O2(g)
起始/(ml·L-1) 1 0 0
转化/(ml·L-1) 0.2 0.1 0.1
平衡/(ml·L-1) 0.8 0.1 0.1
故a点处eq \f(v正,v逆)=K×eq \f(c2NO,cN2·cO2)=0.018×eq \f(0.8 ml·L-12,0.1 ml·L-1×0.1 ml·L-1)=1.152。
答案:(1)> < (2)0.018 1.152
9.解析:(1)反应2CO2(g)+6H2(g)⥫⥬ C2H5OH(g)+3H2O(g)生成气体物质的量减少,ΔS<0。该反应能自发进行,根据ΔH-TΔS<0,该反应的ΔH<0;其正反应在低温下能自发进行。(2)反应达到平衡时k正·c2(CO2)·c6(H2)=k逆·c(C2H5OH)·c3(H2O),K=eq \f(cC2H5OH·c3H2O,c2CO2· c6H2)=eq \f(k正,k逆)。降低温度,正逆反应速率均减小,所以k正减小、k逆减小,故A错误,B错误;正反应放热,降低温度,平衡正向移动,v正>v逆,k正减小的倍数小于k逆减小的倍数,故C错误,D正确。
答案:(1)< 低温 (2)eq \f(k正,k逆) D
序号
c(NO)/
(ml·L-1)
c(H2)/
(ml·L-1)
速率/
(ml·L-1·min-1)
Ⅰ
0.006 0
0.001 0
1.8×10-4
Ⅱ
0.006 0
0.002 0
3.6×10-4
Ⅲ
0.001 0
0.006 0
3.0×10-5
Ⅳ
0.002 0
0.006 0
1.2×10-4
实验
编号
起始浓度c/(ml·L-1)
生成N2的起始
反应速率v/(ml·L-1·s-1)
NO
H2
a
6.00×10-3
1.00×10-3
3.18×10-3
b
6.00×10-3
2.00×10-3
6.36×10-3
c
1.00×10-3
6.00×10-3
0.53×10-3
d
3.00×10-3
6.00×10-3
4.77×10-3
t/min
0
10
20
30
40
p/kPa
36
33.8
32
30.4
30.4
t/min
0
20
40
60
80
120
x(HI)
1
0.91
0.85
0.815
0.795
0.784
x(HI)
0
0.60
0.73
0.773
0.780
0.784
2025年高考化学一轮复习 课时检测六十一:沉淀溶解平衡与四大平衡常数的相关计算(含解析): 这是一份2025年高考化学一轮复习 课时检测六十一:沉淀溶解平衡与四大平衡常数的相关计算(含解析),共7页。试卷主要包含了已知,0×10-38、1,5×10-4×10-5=2,3~9等内容,欢迎下载使用。
第33讲 化学平衡常数(K、Kp)、速率常数及相关计算 -备战2023年高考化学【一轮·夯实基础】复习精讲精练: 这是一份第33讲 化学平衡常数(K、Kp)、速率常数及相关计算 -备战2023年高考化学【一轮·夯实基础】复习精讲精练,文件包含第33讲化学平衡常数KKp速率常数及相关计算原卷版-备战2023年高考化学一轮·夯实基础复习精讲精练docx、第33讲化学平衡常数KKp速率常数及相关计算解析版-备战2023年高考化学一轮·夯实基础复习精讲精练docx等2份试卷配套教学资源,其中试卷共80页, 欢迎下载使用。
专题复习 高考化学 考点43 电离平衡常数及相关计算 讲义: 这是一份专题复习 高考化学 考点43 电离平衡常数及相关计算 讲义,共13页。试卷主要包含了表达式,意义,特点,影响因素,电离常数的三大应用,电离平衡常数相关计算等内容,欢迎下载使用。












