

2025年高考化学一轮复习 课时检测七十一:物质制备型综合实验(含解析)
展开回答下列问题:
(1)装置A的作用是______________,通入氯气后,装置A中观察到有酸雾产生,原因是________________________________________________________________________
________________________________________________________________________。
(2)装置C中P2O5的作用是_____________________________________________,
请写出装置D中发生反应的化学方程式:_________________________________
________________________________________________________________________。
(3)在E、G处收集产物是利用了FeCl3________的性质;实验过程中若F处出现堵塞,则在B处可观察到的现象是_______________________________________________。
(4)装置H的作用是________;装置I中发生反应的离子方程式是_______________。
(5)某同学用11.2 g干燥铁粉制得无水FeCl3样品29.9 g,该次实验的产率是________。
(6)实验室中还常用SOCl2与FeCl3·6H2O晶体共热制备无水FeCl3,其化学方程式为________________________________________________________________________
________________________________________________________________________。
2.(2023·福建等级考)某研究小组以TiCl4为原料制备新型耐热材料TiN。
步骤一:TiCl4水解制备TiO2(实验装置如图A,夹持装置省略)。滴入TiCl4,边搅拌边加热,使混合液升温至80 ℃,保温3小时。离心分离白色沉淀TiO2·xH2O并洗涤,煅烧制得TiO2。
(1)装置 A 中冷凝水的入口为______(填“a”或“b”)。
(2)三颈烧瓶中预置的稀盐酸可抑制胶体形成、促进白色沉淀生成。TiCl4水解生成的胶体主要成分为________(填化学式)。
(3)判断TiO2·xH2O沉淀是否洗涤干净,可使用的检验试剂有________________。
步骤二:由TiO2制备TiN并测定产率(实验装置如图,夹持装置省略)。
(4)装置C中试剂X为__________。
(5)装置D中反应生成TiN、N2和H2O,该反应的化学方程式为________________。
(6)装置E的作用是__________________。
(7)实验中部分操作如下:
a.反应前,称取0.800 g TiO2样品;
b.打开装置B中恒压滴液漏斗旋塞;
c.关闭装置B中恒压滴液漏斗旋塞;
d.打开管式炉加热开关,加热至800 ℃左右;
e.关闭管式炉加热开关,待装置冷却;
f.反应后,称得瓷舟中固体质量为0.656 g。
①正确的操作顺序为a→________→f。(填标号)
②TiN的产率为__________。
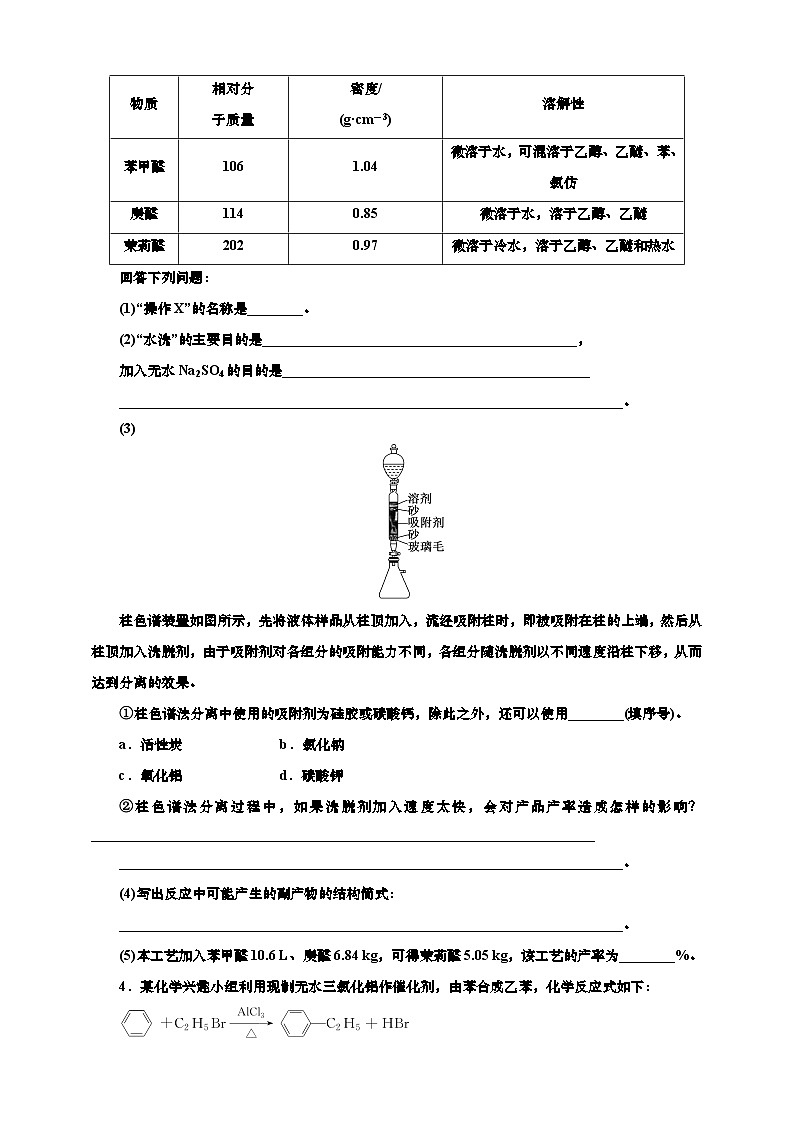
3.制备茉莉醛(具有茉莉花香味,广泛应用于化妆品、洗涤剂和空气清新剂)的一种工艺流程和有关数据如下:
Ⅰ.反应原理
Ⅱ.工艺流程
Ⅲ.有关数据
回答下列问题:
(1)“操作X”的名称是________。
(2)“水洗”的主要目的是_____________________________________________,
加入无水Na2SO4的目的是____________________________________________
________________________________________________________________________。
(3)
柱色谱装置如图所示,先将液体样品从柱顶加入,流经吸附柱时,即被吸附在柱的上端,然后从柱顶加入洗脱剂,由于吸附剂对各组分的吸附能力不同,各组分随洗脱剂以不同速度沿柱下移,从而达到分离的效果。
①柱色谱法分离中使用的吸附剂为硅胶或碳酸钙,除此之外,还可以使用________(填序号)。
a.活性炭 b.氯化钠
c.氧化铝 d.碳酸钾
②柱色谱法分离过程中,如果洗脱剂加入速度太快,会对产品产率造成怎样的影响?________________________________________________________________________
________________________________________________________________________。
(4)写出反应中可能产生的副产物的结构简式:
________________________________________________________________________。
(5)本工艺加入苯甲醛10.6 L、庚醛6.84 kg,可得茉莉醛5.05 kg,该工艺的产率为________%。
4.某化学兴趣小组利用现制无水三氯化铝作催化剂,由苯合成乙苯,化学反应式如下:
已知下列信息:
回答下列问题:
Ⅰ.如图是实验室制备无水AlCl3的实验装置。
(1)写出B装置中发生反应的离子方程式:__________________________________
________________________________________________________________________。
(2)选择合适的装置制备无水AlCl3,按气流从左到右正确的连接顺序为_______________
(写导管口标号)。
(3)E中的试剂X名称为_______________________________________________。
Ⅱ.实验室制取乙苯的装置如图。
在三颈烧瓶中加入50 mL苯和适量的无水AlCl3,由恒压滴液漏斗滴加20 mL C2H5Br,加入少量碎瓷片,恒温磁力搅拌,充分反应。
(4)仪器M的名称为________,反应过程中忘加碎瓷片,正确的做法是________________________________________________________________________。
(5)使用恒压滴液漏斗的优点是__________________________________________
________________________________________________________________________。
(6)反应中要加入过量的苯原因是_______________________________________,
所得产物通过蒸馏(精馏)进行分离,收取乙苯馏分的沸点范围为________________。
(7)实验中测得生成乙苯20 g,则乙苯的产率为________。
课时检测(七十一)
1.解析:该实验的目的是制备无水FeCl3;由于FeCl3易水解,故要先将潮湿Cl2通过装置A,以获得干燥的Cl2,其中潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内空气中的水蒸气形成酸雾,故需要装置C来除去酸雾;装置D为Fe和Cl2反应生成FeCl3的装置;装置E、G为FeCl3的收集装置;装置B、I为Cl2的吸收装置;由于FeCl3易升华,则有部分FeCl3固体会在F中积累,可能会引起堵塞,这时Cl2会进入B中被吸收以防止污染环境;为防止装置I中的水蒸气进入G中,需装置H来吸收装置I中的水蒸气,以防止G中FeCl3水解。(4)FeCl3易潮解,装置H可以防止装置I中水蒸气进入装置G中使氯化铁发生水解;装置I用来吸收Cl2,相应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。(5)n(Fe)=eq \f(11.2 g,56 g·ml-1)=0.2 ml,理论上反应产生0.2 ml FeCl3,即32.5 g,则该次实验的产率为eq \f(29.9 g,32.5 g)×100%=92%。
答案:(1)干燥Cl2 潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内空气中的水蒸气形成酸雾 (2)除去酸雾 2Fe+3Cl2eq \(=====,\s\up7(△))2FeCl3 (3)易升华 B处有气泡产生 (4)防止装置I中水蒸气进入装置G中使氯化铁发生水解 Cl2+2OH-===Cl-+ClO-+H2O (5)92%
(6)FeCl3·6H2O+6SOCl2eq \(=====,\s\up7(△))FeCl3+12HCl+6SO2
2.解析:稀盐酸可抑制胶体形成、促进白色沉淀生成,向盐酸中滴入TiCl4,搅拌并加热,TiCl4在盐酸中水解生成白色沉淀TiO2·xH2O,将TiO2·xH2O洗涤、煅烧制得TiO2;装置B中利用浓氨水和生石灰反应制备NH3,利用装置C除去NH3中的水蒸气,则试剂X可以是碱石灰,装置D中,NH3和TiO2在800 ℃下反应生成TiN、N2和H2O,化学方程式为6TiO2+8NH3eq \(=====,\s\up7(800 ℃))6TiN+12H2O+N2,装置E中装有CaCl2,可以吸收生成的水蒸气及过量的NH3。(1)装置 A 中冷凝水应从下口进上口出,则冷凝水的入口为b。(2)TiCl4 水解生成Ti(OH)4,TiCl4水解生成的胶体主要成分为Ti(OH)4。(3)TiO2·xH2O沉淀中含有少量的Cl-杂质,判断TiO2·xH2O沉淀是否洗涤干净,只需检验洗涤液中是否含有Cl-即可,若最后一次洗涤液中不含Cl-,则证明TiO2·xH2O沉淀洗涤干净,反之,则未洗涤干净,检验Cl-,应选用的试剂是硝酸酸化的AgNO3。(7)①该实验应先称取一定量的TiO2固体,将TiO2放入管式炉中,提前通入NH3排出管式炉中空气后再进行加热,当反应结束后,应先停止加热,待冷却至室温后再停止通入NH3,则正确的实验操作步骤为abdecf。②0.800 g TiO2的物质的量为eq \f(0.800 g,80 g·ml-1)=0.01 ml,则TiN的理论产量为0.01 ml×62 g·ml-1=0.62 g,设实际生成的TiN质量为x g,有eq \f(x,62)+eq \f(0.656-x,80)=0.01,解得x=0.496,则TiN的产率为eq \f(0.496 g,0.62 g)×100%=80%。
答案:(1)b (2)Ti(OH)4
(3)AgNO3(或AgNO3+HNO3、硝酸酸化的硝酸银)
(4)碱石灰(或CaO、NaOH、KOH以及这些物质的组合均可)
(5)6TiO2+8NH3eq \(=====,\s\up7(800 ℃))6TiN+12H2O+N2
(6)吸收氨气与水 (7)①bdec ②80%
3.解析:苯甲醛、庚醛在乙醇、氢氧化钾条件下生成茉莉醛,冷却后分液除去水层,有机层水洗后加入无水硫酸钠干燥,有机层通过柱色谱装置分离得到茉莉醛。(1)“操作X”是分离有机层和水层的操作,其名称是分液。(2)有机层中含有少量的乙醇、氢氧化钾,“水洗”的主要目的是除去乙醇和KOH溶液;无水Na2SO4可以吸收有机层中的水分,故加入无水Na2SO4的目的是吸收水分、干燥有机层。(3)①柱色谱法分离中使用的吸附剂为表面积较大,具有吸附性的物质且不和分离物质发生反应,故选ac。②柱色谱法分离过程中,如果洗脱剂加入速度太快,导致产品不能被充分吸附,使得杂质难以分离,产率可能偏大也可能偏小。(4)根据醛与醛的反应原理,反应中庚醛与庚醛也可能发生反应,故产生的副产物为。(5)本工艺加入苯甲醛10.6 L,质量为10.6×103 mL×1.04 g·cm-3=11 024 g,物质的量为104 ml,庚醛为6.84 kg,物质的量为60 ml,则反应中苯甲醛过量、庚醛完全反应,理论上生成茉莉醛60 ml,质量为12.12 kg,又本工艺中得茉莉醛5.05 kg,故该工艺的产率为eq \f(5.05 kg,12.12 kg)×100%≈41.7%。
答案:(1)分液 (2)除去乙醇和KOH溶液 吸收水分、干燥有机层
(3)①ac ②产品与杂质难以分离,产率可能偏大也可能偏小
(4) (5)41.7
4.解析:(2)B装置产生的氯气中混有氯化氢和水蒸气杂质,用D装置除去HCl 杂质,C装置除去水蒸气杂质,由于氯化铝易升华,产生的氯化铝颗粒易堵塞导气管,所以得到纯净的氯气后在F装置中和铝反应制取氯化铝而不用A装置,根据信息可知氯化铝遇水极易潮解并产生白色烟雾,所以最后必须用E装置吸收多余的氯气并防止空气中的水蒸气进入F装置中,因此制备无水氯化铝正确的连接顺序为d、e、f、g、h、i、j、c。(3)试剂X用于除去多余的氯气,防止污染空气,同时防止空气中的水蒸气进入,使氯化铝水解,所以是碱石灰。(6)加入过量苯的目的是提高另一种反应物溴乙烷的转化率;乙苯的沸点是136.2 ℃,AlCl3的沸点是178 ℃,所以收取乙苯馏分的沸点范围为136.2~178 ℃。(7)加入苯的物质的量为50 mL×0.88 g·mL-1÷78 g·ml-1≈0.56 ml,C2H5Br的物质的量为20 mL×1.468 g·mL-1÷109 g·ml-1≈0.269 ml,由反应方程式+C2H5Breq \(――→,\s\up7(AlCl3),\s\d5(△))可知,加入的苯过量,则理论上生成乙苯的质量为0.269 ml×106 g·ml-1≈28.51 g,乙苯的产率为eq \f(20 g,28.51 g)×100%≈70.2%。
答案:(1)MnO2+4H++2Cl-eq \(=====,\s\up7(△))Mn2++Cl2↑+2H2O
(2)defghijc (3)碱石灰 (4)球形冷凝管 停止反应,冷却后补加
(5)平衡气压,使液体顺利滴下 (6)提高溴乙烷的转化率(其他合理答案也可) 136.2~178 ℃ (7)70.2%
物质
相对分
子质量
密度/
(g·cm-3)
溶解性
苯甲醛
106
1.04
微溶于水,可混溶于乙醇、乙醚、苯、氯仿
庚醛
114
0.85
微溶于水,溶于乙醇、乙醚
茉莉醛
202
0.97
微溶于冷水,溶于乙醇、乙醚和热水
物质
相对分子质量
密度/(g·mL-1)
熔点/℃
沸点/℃
溶解性
AlCl3
—
—
194
178
遇水极易溶解并产生白色烟雾,微溶于苯
苯
78
0.88
—
80.1
难溶于水,易溶于乙醇
溴乙烷
109
1.468
—
38.4
难溶于水,可溶于苯
乙苯
106
0.878
—
136.2
难溶于水,易溶于苯
高考化学热点试题热点20物质制备型实验综合题含解析答案: 这是一份高考化学热点试题热点20物质制备型实验综合题含解析答案,共13页。试卷主要包含了过硼酸钠可用于漂白剂及杀菌消毒等内容,欢迎下载使用。
2025届高考化学一轮总复习真题演练第11章化学综合实验第55讲物质制备型综合实验: 这是一份2025届高考化学一轮总复习真题演练第11章化学综合实验第55讲物质制备型综合实验,共4页。
2025届高考化学一轮总复习课时跟踪练55物质制备型综合实验: 这是一份2025届高考化学一轮总复习课时跟踪练55物质制备型综合实验,共8页。












