


江西省赣州中学2024-2025学年高一上学期期中考试 化学试题
展开本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 K-39 Ca-40 S-32 Fe-56 Cu-64 Cl-35.5 Ag-108
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1. 某化学实验小组书写的化学式、俗名以及归类完全正确的是
A. NaOH、苛性钠、纯碱B. CH3COOH、酒精、有机物
C. NO2、干冰、无机物D. NaHCO3、小苏打、盐
2. 焰色试验过程中铂丝的清洗和灼烧与钾焰色试验的观察两项操作如图所示:
下列叙述中不正确的是( )
A.每次实验中都要先将铂丝灼烧至火焰无色,再蘸取被检验物质
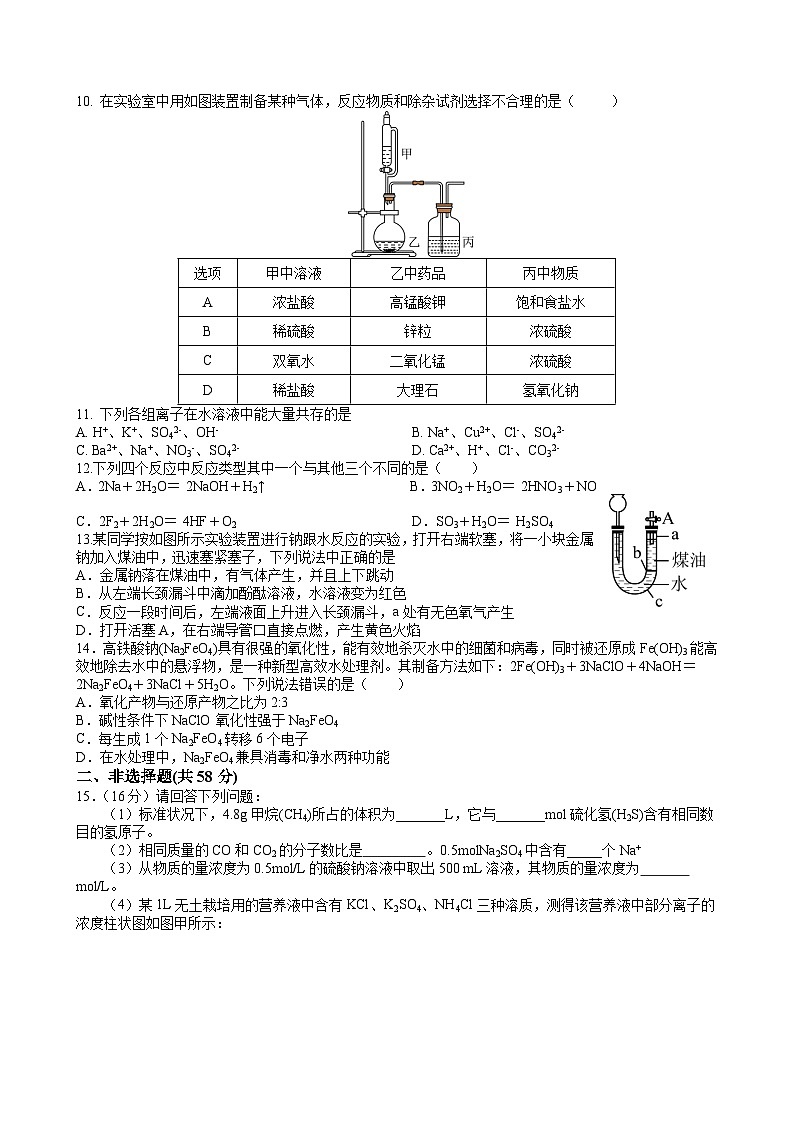
B.钾的焰色试验要透过蓝色钴玻璃观察
C.实验时最好选择本身颜色较深的火焰
D.没有铂丝可用无锈铁丝代替进行实验
3. 成语“云蒸霞蔚”描绘了自然界中的丁达尔效应。下列分散系不能产生丁达尔效应的是
A. Fe(OH)3胶体B. 淀粉溶液
C. 蛋白质溶液D. Ca(OH)2溶液
4. 在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
A.溶液中Na+浓度增大,有O2放出 B.溶液碱性不变,有H2放出
C.溶液中Na+数目减少,有O2放出 D.溶液碱性增强,有O2放出
5. 下列电离方程式正确的是
A. H2S(溶液)=2H++S2-B. NaHSO4(熔融)=Na++HSO4-
C. NaOH(溶液)⇌Na++OH-D. NaHCO3(溶液)⇌Na++H++CO32-
6. 设NA为阿伏加德罗常数值。下列说法正确的是
A. 100 g质量分数为98%的浓硫酸中所含氧原子数为4NA
B. 含0.01 ml FeCl3的饱和溶液滴入沸腾的蒸馏水中,制得的氢氧化铁胶体粒子数为0.01NA
C. 标准状况下1ml氢气与18g水的体积相等
D. 1mlCl2与铁完全反应生成FeCl3时,反应转移的电子数为2NA
7. 下列离子方程式书写正确的是
A. 石灰石与醋酸反应:CaCO3+2H++=Ca2++CO2↑+H2O
B. 刻制印刷电路板时用FeCl3溶液作为“腐蚀液”:Cu+Fe3+=Fe2++Cu2+
C. 稀硫酸与氢氧化钡溶液反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
D. KAl(SO4)2溶液中滴加Ba(OH)2使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-==[Al(OH)4]-+2BaSO4↓
8. 现有下列三种气体:a.32 g CH4、b.约含有6.02×1023个HCl分子的氯化氢气体、c. 标准状况下33.6 L NH3。下列排列顺序一定正确的是
A. 质量:a>b>c B. 氢原子数目:a>c>b
C. 分子数:b>a>c D. 体积:c>a>b
9. 下列说法正确的是
A. Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
B. 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
C. 纯净的氢气在氯气中安静地燃烧,有白烟产生
D. 鉴别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
10. 在实验室中用如图装置制备某种气体,反应物质和除杂试剂选择不合理的是( )
11. 下列各组离子在水溶液中能大量共存的是
A. H+、K+、SO42-、OH-B. Na+、Cu2+、Cl-、SO42-
C. Ba2+、Na+、NO3-、SO42-D. Ca2+、H+、Cl-、CO32-
12.下列四个反应中反应类型其中一个与其他三个不同的是( )
A.2Na+2H2O=2NaOH+H2↑ B.3NO2+H2O=2HNO3+NO
C.2F2+2H2O=4HF+O2 D.SO3+H2O=H2SO4
13.某同学按如图所示实验装置进行钠跟水反应的实验,打开右端软塞,将一小块金属钠加入煤油中,迅速塞紧塞子,下列说法中正确的是
A.金属钠落在煤油中,有气体产生,并且上下跳动
B.从左端长颈漏斗中滴加酚酞溶液,水溶液变为红色
C.反应一段时间后,左端液面上升进入长颈漏斗,a处有无色氧气产生
D.打开活塞A,在右端导管口直接点燃,产生黄色火焰
14.高铁酸钠(Na2FeO4)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成Fe(OH)3能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。下列说法错误的是( )
A.氧化产物与还原产物之比为2:3
B.碱性条件下NaClO氧化性强于Na2FeO4
C.每生成1个Na2FeO4转移6个电子
D.在水处理中,Na2FeO4兼具消毒和净水两种功能
二、非选择题(共58分)
15.(16分)请回答下列问题:
(1)标准状况下,4.8g甲烷(CH4)所占的体积为_______L,它与_______ml硫化氢(H2S)含有相同数目的氢原子。
(2)相同质量的CO和CO2的分子数比是 。0.5mlNa2SO4中含有_____个Na+
(3)从物质的量浓度为0.5ml/L的硫酸钠溶液中取出500 mL溶液,其物质的量浓度为 ml/L。
(4)某1L无土栽培用的营养液中含有KCl、K2SO4、NH4Cl三种溶质,测得该营养液中部分离子的浓度柱状图如图甲所示:
①该营养液中K2SO4的物质的量浓度为 ml/L,含KCl的质量为 。
②该营养液中NH4Cl的物质的量为 。
16.(14分)某化学兴趣小组设计了如图装置制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
(1)A中发生反应的化学方程式为 。
(2)储气瓶b可以收集氯气,则b内盛放的试剂名称是 。
(3)装置B中所发生反应的离子方程式为 ,
其还原产物中阴离子的检验方法是:
(4)在装置D中能看到的实验现象是 。
(5)装置F的作用是 。
(6) 在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为 。
17.(14分)某实验小组制取“84”消毒液(主要成分为NaClO)并探究其性质。
[查阅资料]
①常温下:16HCl(浓)+2KMnO4=2MnCl2+8H2O+2KCl+5Cl2↑;
②苯为有机物,密度比水小且不溶于水;
③氯、溴、碘的单质均易溶于有机溶剂。
I.制取NaClO的装置如图1所示(夹持装置略):
(1)装置B中发生反应的离子方程式为 。
(2)上述装置存在一个缺陷,会导致的不良后果是:______________________________________。
II.探究“84”消毒液的性质:
(3)为验证“84”消毒液的某些性质,实验小组设计图2实验方案。观察到试管1中溶液不褪色;试管2中溶液变蓝,短时间内无明显现象;试管3中溶液先变蓝,通入CO2后,溶液快速褪色。
①试管1的作用是 。
②由试管2、3的现象可得到的结论是 。
③若将试管3中通入的CO2换成盐酸也可达到相同的效果,且速度更快,但有可能产生Cl2而带来不良的实验后果,试说明理由(用离子方程式表示) 。
④奥运会期间,由于工作人员将84消毒液(NaClO)与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。该反应中氧化性:H2O2 NaClO(填“>”或“<”)。反应的离子反应方程式为 。
18.(14分)化工专家侯德榜发明的候氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
回答下列问题:
(1)从A~E中选合适的仪器制备NaHCO3,正确的连接顺序是 (按气流方向,用小写字母表示)。
_______→_______→_______→_______→_______→g
为使A中分液漏斗内的稀盐酸顺利滴下,可将玻璃塞上的凹槽对准漏斗颈部的小孔或 。
B. C. D. E.
(2) 生成NaHCO3的总反应的化学方程式为 。
(3)Na2CO3(假设只含NaHCO3杂质)纯度的测定。
加热法:取样品100g按下图装置进行实验。
①A装置中发生反应的化学方程式 ,C中碱石灰的作用是 ,若无C装置测得结果将 (填“偏大”“偏小”“无影响”)
②经测定B中增重6.2g,则Na2CO3的纯度为 %
选项
甲中溶液
乙中药品
丙中物质
A
浓盐酸
高锰酸钾
饱和食盐水
B
稀硫酸
锌粒
浓硫酸
C
双氧水
二氧化锰
浓硫酸
D
稀盐酸
大理石
氢氧化钠
江西省赣州市南康区第一中学等校2024-2025学年高一上学期第一次月考 化学试题: 这是一份江西省赣州市南康区第一中学等校2024-2025学年高一上学期第一次月考 化学试题,共7页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
江西省赣州市南康区第一中学等校2024-2025学年高一上学期第一次月考 化学试题(无答案): 这是一份江西省赣州市南康区第一中学等校2024-2025学年高一上学期第一次月考 化学试题(无答案),共6页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
江西省赣州市瑞金第一中学2024-2025学年上学期高三开学考试化学试题: 这是一份江西省赣州市瑞金第一中学2024-2025学年上学期高三开学考试化学试题,共4页。












