

河南省南阳市六校2024-2025学年高一上学期期中考试 化学试卷
展开
这是一份河南省南阳市六校2024-2025学年高一上学期期中考试 化学试卷,共10页。试卷主要包含了5 Cu 64,下列叙述正确的是,下列对应离子方程式书写正确的是等内容,欢迎下载使用。
考生注意:
1.答题前,考生务必将自己的姓名、考生号填写在试卷和答题卡上,并将考生号条形码粘贴在答题卡上的指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C 12 N 14 O 16 S 32 Cl 35.5 Cu 64
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.科学家为社会发展做出了巨大贡献,下列有关科学家与其成就的描述错误的是
A.侯德榜发明了联合制碱法
B.波义耳提出化学元素的概念,标志着近代化学的诞生
C.屠呦呦因合成结晶牛胰岛素获得诺贝尔奖
D.徐光宪在量子化学、配位化学、稀土化学等方面研究成果突出
2.近日,南方科技大学李闯创课题组历时6年多,成功合成了仅由碳、氢、氧三种元素组成的天然产物 Vinigrl,该物质曾被认为是最难合成的天然物质之一,其结构如图所示。
下列叙述错误的是
A.碳、氢、氧均为非金属元素
B.化学研究不仅能认识分子,还能制造分子
C.由碳、氢、氧元素中的两种元素组成的化合物只有3种
D.利用X 射线衍射仪、核磁共振仪、质谱仪可以分析 Vinigrl 的组成和结构
3、当用一束可见光通过下列物质时,会出现丁达尔现象的是
①AgI胶体 ②Fe(OH)3浊液 ③油水混合物④鸡蛋清水溶液 ⑤云或雾
A、①⑤ B、①②⑤ C、①③⑤ D、①④⑤
4、下列对化学概念的理解正确的是
A、碱性氧化物一定是金属氧化物
B、能电离出H+的化合物一定是酸
C、只含有一种元素的物质一定是纯净物
D、只含有两种元素的化合物一定是电解质
5、在指定条件下,下列选项所示的物质间转化能实现的是
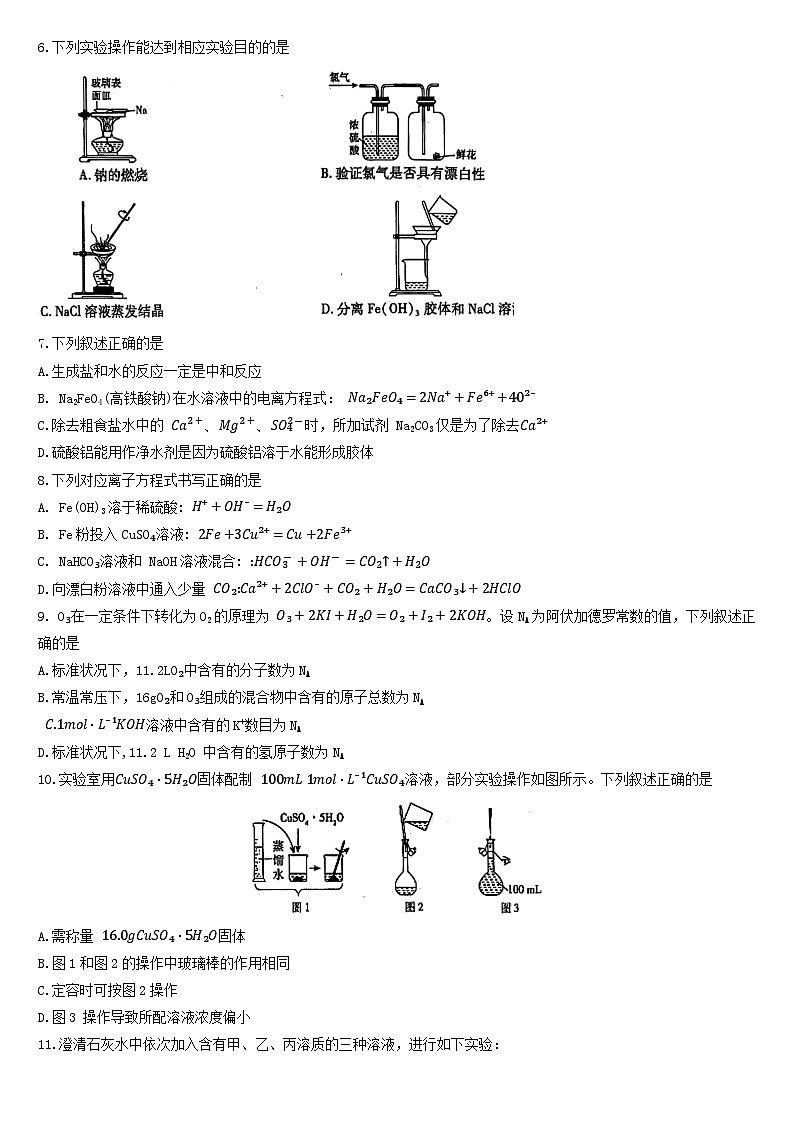
6.下列实验操作能达到相应实验目的的是
7.下列叙述正确的是
A.生成盐和水的反应一定是中和反应
B. Na2FeO4(高铁酸钠)在水溶液中的电离方程式: Na₂FeO₄=2Na⁺+Fe⁶⁺+40²⁻
C.除去粗食盐水中的 Ca2+、Mg2+、SO42-时,所加试剂 Na2CO3仅是为了除去Ca²⁺
D.硫酸铝能用作净水剂是因为硫酸铝溶于水能形成胶体
8.下列对应离子方程式书写正确的是
A. Fe(OH)3溶于稀硫酸: H⁺+OH⁻=H₂O
B. Fe粉投入CuSO₄溶液: 2Fe+3Cu²⁺=Cu+2Fe³⁺
C. NaHCO₃溶液和 NaOH溶液混合: :HCO3-+OH-=CO2↑+H2O
D.向漂白粉溶液中通入少量 CO₂:Ca²⁺+2ClO⁻+CO₂+H₂O=CaCO₃↓+2HClO
9. O₃在一定条件下转化为O2的原理为 O₃+2KI+H₂O=O₂+I₂+2KOH。设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2LO₂中含有的分子数为NA
B.常温常压下,16gO₂和O₃组成的混合物中含有的原子总数为NA
C.1ml⋅L⁻¹KOH溶液中含有的K+数目为NA
D.标准状况下,11.2 L H2O 中含有的氢原子数为NA
10.实验室用CuSO₄⋅5H₂O固体配制 100mL 1ml⋅L⁻¹CuSO₄溶液,部分实验操作如图所示。下列叙述正确的是
A.需称量 16.0gCuSO₄⋅5H₂O固体
B.图1和图2的操作中玻璃棒的作用相同
C.定容时可按图2操作
D.图3 操作导致所配溶液浓度偏小
11.澄清石灰水中依次加入含有甲、乙、丙溶质的三种溶液,进行如下实验:
则甲、乙、丙可能是
A. Na2CO3、HCl、Fe(NO3)₃
B. NaHCO3、HCl、AgNO₃
C. K2CO3、HNO3、BaCl₂
D.CaHCO₃₂、H₂SO₄,MgCl₂
12.现有三种溶液: ①200mL1.0ml⋅L⁻¹盐酸、 ②100mL2.0ml⋅L⁻¹盐酸、③150 mL 1.5ml⋅L⁻¹氯化钙溶液,下列说法错误的是
A.溶液的导电能力:②>①
B.Cl⁻的物质的量:③>②
C.将标准状况下4.48 L HCl溶于水配成200 mL溶液可得①
D.向①中加入6.9 g Na,产生标准状况下: 2.24LH₂
13.向盛有 20mL 0.1ml⋅L⁻¹M溶液的烧杯中匀速滴入 0.1ml⋅L⁻¹N溶液,溶液电导率(表示溶液传导电流的能力)与滴入N溶液的体积变化关系如图所示。
则M、N可能是
14.某无色透明溶液中可能含有 K+、H+、Fe3+、SO42-、CO32-、HCO3-、Cl-中的若干种,且各种离子的物质的量浓度相等。取两份该溶液,进行如下实验:
下列叙述正确的是
A.实验i说明 CO32-与 HCO3-至少含有一种
B.向白色沉淀 A 中加入稀硝酸,沉淀会部分溶解
C.实验 iii和 iv能证明原溶液中含有Cl⁻
D.将原溶液蒸发浓缩、冷却结晶,可析出一种纯净物
二、非选择题:本题共4 小题,共58分。
15.(14分)掌握以物质的量为中心的相关计算,是学好化学的关键之一。请回答下列问题:
1CO32-的摩尔质量为 。
(2)常温常压下,测得16 g CH₄的体积为VL,则该条件下气体摩尔体积为 (用含V的式子表示)。
(3)在标准状况下,2L的密闭容器中恰好可盛放x个N₂分子和y个O₂分子组成的混合气体,则阿伏加德罗常数.(用含x、y的代数式表示)。
4100mL0.2ml⋅L⁻¹Al₂SO₄₃溶液与 50mL0.3ml⋅L⁻¹NH₄₂SO₄溶液混合,所得溶液中 SO42-的物质的量浓度为 ml⋅L⁻¹(假设溶液体积具有加和性)。f
(5)同温下,某密闭容器中有一个可自由滑动的隔板(厚度不计),将容器分成两部分,当向甲中充入14.4g N2和CO₂的混合气体,乙中充入 4.4gCO₂时,隔板处于如图所示位置。
①14.4g N₂和CO₂的混合气体总物质的量为 ,混合气体的平均摩尔质量为 。
②向乙容器中再通入 gN₂时,隔板刚好处于该密闭容器的正中间。
16.(15分)硫代硫酸钠晶体( Na₂S₂O₃⋅5H₂O,又名大苏打、海波,广泛用于定影、媒染等领域,临床上用于氰化物解毒,是一种用途非常广泛的化学试剂。一种工业制备方法如下:向①Na₂CO₃溶液中通入②二氧化硫反应,加入③NaOH 固体中和,加( ④Na₂S固体除杂质、过滤,再将⑤硫黄粉溶解在热 Na₂SO₃溶液中进行反应,经过滤、除杂等一系列操作,即可制得硫代硫酸钠成品,相关反应有:i. Na₂CO₃+SO₂=Na₂SO₃+CO₂; ii. Na₂SO₃+S+ 5H₂O=Na₂S₂O₃⋅5H₂O。
请回答下列问题:
1Na₂S₂O₃⋅5H₂O属于 (填序号)。
a.钠盐 b.纯净物 c.混合物 d.硫酸盐
(2)上述标①-⑤序号的物质中,能导电的是 (填序号,下同);属于电解质的是 。
(3)两 NaOH 溶液中通入: SO₂、也能生成 Na₂SO₃,.该反应的离子方程式为 ,该反应 (填“能”或“不能”)说明: SO₂属于酸性氧化物。
(4)实验室进行过滤操作研测器的玻璃仪器有 。
(5)反应i的离子方程式为 ;反应自愿于 (填因大基本反应类型)。
17、(14分)元素及其化合物的“价—类”二维图是学习元素化合物知识的重要模型,它以元素的他合价为纵坐标、以物质类别为做坐标。氯及其化合物的“价—类”二维图如图所示。
已知:实验室常用 MnO₂和浓盐酸在加热条件下制备Cl₂。
请回答下列问题:
(1)乙和丙均可用于自来水的杀菌、消毒。
①乙能用于自来水杀菌、消毒的原因是 (用离子方程式解释)。
②丙作为一种广泛使用的消毒剂,极易溶于水,其密度比空气 (填“大”或“小”)。实验室收集丙时,选用M装置,进气端为 (填“a”或“b”);某同学计划将丙从端通入N装置,获得丙的水溶液,若进行该操作可能出现的问题是 。
(2)已知己是一元强酸,写出己与NaOH 溶液反应的化学方程式: 。
(3)其能举兴趣小组利用如下装置制备并收集干燥纯净的氧气。
①盛放浓盐酸的实验仪器名称是 。
②该小组同学欲用碱石灰除去氯气中的杂质,该方案 (填“合理”或“不合理“)、原因是 。③NaOH溶液的作用是 (用离子方程式表示)。
18、(15 分)以不同类别物质间的转化为线索,有利于提高对转化规律的认识。钠及其化合物在生活和生产中有重要用途,相关转化途径如图所示。
请回答下列问题:
(1)在实验室里,钠单质通常保存在 中,其目的是 。
(2)用化学方程式解释 Na₂O₂能用作潜艇供氧剂的原因: (写出1例即可)。一定条件下,若将1ml混合气体(含有水蒸气的CO₂)与足量 Na₂O₂固体充分反应,则生成O₂的质量为 g。
3NaHCO₃用作馒头膨松剂的原因为 (用文字叙述)。
(4)某同学设计如下“套管实验”装置验证‘ “Na₂CO₃比 NaHO₃稳定”这一结论。
①实验时“内管”应放置 (填化学式),点燃酒精灯后,能观察到 (填“A”“B”或“A和B”)烧杯中澄清石灰水变浑浊,该烧杯中发生反应的离子方程式是 。
②实验结束时的操作是 。
2024—2025 学年(上)南阳六校高一年级期中考试
化学·答案
1-14题,每小题3分,共42分。
1.答案 C
命题透析 本题以化学史为情境,考查科学家及其成就等知识,意在考查理解与辨析能力,科学态度与社会责任的核心素养。
思路点拨 我国科学家屠呦呦因提取抗疟药青蒿素做出卓越贡献而获得诺贝尔奖,C项错误。
2.答案 C
命题透析 本题以天然产物 Vinigrl合成为素材,考查化学科学的主要特征、元素与化合物等知识,意在考查理解与辨析能力,宏观辨识与微观探析的核心素养。
思路点拨 由碳、氢、氧元素中的两种元素组成的化合物有H2O、H2O2、CO、CO2、CH4等,C项错误。
3.答案 D
命题透析 本题以丁达尔现象为情境,考查胶体判断等知识,意在考查理解与辨析能力,宏观辨识与微观探析的核心素养。
思路点拨 AgI胶体、鸡蛋清水溶液、云和雾都是胶体,都能产生丁达尔现象,Fe(OH)3浊液和油水混合物均属于浊液,D项符合题意。
4.答案 A
命题透析 本题以化学概念为情境,考查碱性氧化物、酸、纯净物、电解质等知识,意在考查理解与辨析能力,宏观辨识与征观探析的核心素养。
思路点拨 碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,A项正确;电离出的阳离子全部是H⁺的化合物一定是酸,如NaHSO4能电离出H+,但NaHSO₄是盐,B项错误;只含有一种元素的物质不一定是纯净物,如金刚石与石墨的混合物中只含一种元素、C项错误;只含有两种元素的化合物不一定是电解质,如CO2等是非电解质,D项错误。
5.答案 C
命题透析 本题以物质转化为情境,考查元素与化合物知识,意在考查理解与辨析能力,变化观念与平衡思想的核心素养。
思路点拨 铁与氯气在点燃条件下反应生成氯化铁,即使铁过量也不生成氯化亚铁,A项不符合题意;CuO 不溶于水,也不与水反应,B.项不符合题意;H2与Cl2在点燃条件下反应生成HCl,C项符合题意;向NaOH溶液中通入过量的CO2,生成碳酸氢钠,D项不符合题意。
6.答案 C
命题透析 本题以实验操作与实验目的为情境,考查实验仪器的使用及基本实验操作等知识,意在考查探究与创新能力,科学探究与创新意识的核心素养。
思路点拨 钠的燃烧应该在坩埚中进行,不现在表面皿中进行,A项错误;氮气相鲜花中的本生成次氧酸,即他耕花搁色,也不能征明干燥的氧气具有源白性,B项错误;蒸干 NaCl溶液应在蒸发皿中进行,C项正确;过滤不能分离胶体和溶液,应该使用渗析法,D项错误。
7、答案 D
命题透析 本题以正误判断为情境,考查中和反应、电离方程式、胶体的应用、粗盐的损失等知识,意在考查分析与推测能力,变化观念与平衡思想的核心素养。
思路点拨 申和反应指的是酸和碱反应生成盐和水、但生成盐和水的反应不一定属于中和反应,如氧化制和使酸反应生成硫酸铜和水,A项错误,Na2FeO4。在水溶液中的电离方程式为 Na2FeO4=2Na++FeO42-,B项铺误;除去粗食盐水中的Ca2+、Mg2+、SO42-时,所加试剂 Na2CO3为丁除去Ca²⁺以及过量的 Ba2+,C项错误;硫酸铝溶于水能形成胶体,可以吸附水中悬浮杂质,故硫酸铝能用作净水剂,D项正确。
8、答案 D
命题透析 本题以离于方程式立误判断为情境,考查离子反应等知识,意在考查理解与评析能力,变化观念与平衡思想的核心素养。
思路点拨 Fe(OH)3,溶于稀硫酸,正确的离子方程式为3H++Fe(OH)3=Fe3++3H2O,A 项错误; Fe粉投入 CuSO4溶液,正确的离子方程式为 Fe+Cu²=Cu+Fe²⁺,B 项错误;NaHCO3溶液和 NaOH溶液混合,正确的离子方程式为 HCO3-+OH-=CO32-+H2O,C项错误;向漂白粉溶液中通入少量CO2,正确的离子方程式为 Ca²⁺+2ClO⁻+CO₂+H₂O=CaCO3↓+2HClO,D项正确。
9.答案 B
命题透析 本题以阿伏加德歹常数的计算为情境,考查物质的量的计算等知识,意在考查理解与掷析能力,宏硬件识与恒观探析的核心素养。
思当点拨 标准状况下,11.2 LO2为0.5ml,其分子数为0.5NA,A项错误;16gO₂和O3组成的混合物中氧原子为1ml.其原子总数为NA,B项正确;无KOH 溶液的体积,无法计算,C项错误;标准状况下,H2O不是气体,不能利用气体摩尔体积计算H2O的物质的量,D项错误。
10.答案 D
命题透析 本题以 CuSO₄溶液的配制为素材,考查一定物质的量浓度溶液的配制等知识,意在考查探究与创新能力,科学探究与创新意识的核心素养。
思路点拨 10mLlml⋅L⁻¹CuSO₄溶液中含有溶质0.1ml,应称量: 25.0gCuSO₄⋅5H₂O,A 项错误;图1操作中玻璃棒的作用是搅拌,图2操作中玻璃棒的作用是引流,B项错误;定容时烧杯中溶液沿玻璃橡引流注人容量瓶中,玻璃棒下端应伸入容量瓶刻度线以下,C项错误;定容时仰视刻度线。造成所配溶液休积偏大,导致所配溶液浓度偏小,D项正确。
11.答案 B
命题透析 本题以物质转化为素材,考查离子反应等知识,意在考查分析与推测能力,变化观念与平衡思想的核心素养。
思路点拨 丙是 Fe(NO3)3时,不能产生白色沉淀,A项错误;甲是NaHCO3,与澄清石灰水反应生成白色沉淀CaCO3,盐酸溶解碳酸钙生成氯化钙,加入AgNO3与氯离子生成AgCl白色沉淀,B项正确;丙是BaCl2时,不能产生白色沉淀,C项错误;乙是H2SO4时,与碳酸钙反应生成的CaSO4微溶,不会出现“沉淀溶解”现象,D项错误。
12.答案 D
命题透析 本题以一定物质的量浓度的溶液为素材,考查物质的量的计算、钠与盐酸反应等知识,意在考查归纳与论证能力,宏观辨识与微观探析、变化观念与平衡思想的核心素养。
思路点拨 溶液的导电性与离子浓度有关;与体积无关,故导电性:②>①,A项正确;②中 nCl⁻= 2.0ml⋅L⁻¹×0.1L=0.2ml、③中 nCl⁻=1.5ml⋅L⁻¹×2×0.15L=0.45ml,Cl的物质的量:③>②,B项正确;将标准状况下4.48L HCl(0.2ml)溶于水配成200mL溶液可得①,C项正确;钠既与酸反应,又与溶剂水反应,故6.9g Na会产生标准状况下3.36LH2,D项错误。
13.答案 A
命题透析 本题以电导率为情境,考查离子反应、溶液的导电能力等知识,意在考查分析与推测能力,宏观拼识与微观探析、变化观念与平衡思想的核心素养。
思路点拨 由图可知,电导率随滴入溶液的体积发生三段变化,电导率出现折点意味着影响电导率的因素发生了变化(如离子浓度、离子所带电荷数和离子种类)。若M是NaHSO4、N是 BaOH₂,,在0-10 mL,发生反应: 2NaHSO₄+BaOH₂=BaSO₄↓+Na₂SO₄+2H₂O,该区间溶液体积增大,离子种类变化,离子浓度减小,电导率减小,在10-20mL,发生反应 Na₂SO₄+BaOH₂=BaSO₄↓+2NaOH,该区间溶液体积增大,离子浓度较小,离子种类变化,电导率出现折点,20 mL以后,Ba(OH)₂溶液过量,离子浓度变大,离子种类变化,电导串上升,A项符合题意;若M是NaOH、N是MgCl₂,在0-10 mL,发生反应 2NaOH+MgCl₂=MgOH₂↓+2NaCl,该区间溶液体积增大,离子浓度减小,离子种类变化,电导率减小,在10mL以后,MgCl₂溶液过量,电导率上升,B项不符合题意;若M是HCl、N是NaOH,在0 -20 mL,只发生反应 NaOH+HCl=NaCl+H₂O,该区间溶液体积增大,离子浓度减小电导率下降,在20 mL 以后,NaOH溶液过量,电导率上升,C项不符合题意;若M是 Ba(OH)2、N是CuSO4,在0-20mL,只发生反应 BaOH₂+CuSO₄=BaSO₄↓+CuOH₂↓,,该区间溶液体积增大,离子浓度减小直至接近无,20mL时溶液的电导率接近于零,在20mL以后,CuSO4溶液过量,电导率上升,D项不符合题意。
14.答案 D
命题透析 本题以离子框图推断为素材,考查离子推断与离子共存等知识,意在考查分析与推测能力,变化观念与平衡思想、证据推理与模型认知的核心素养。
思路点拨 原溶液加锌粒能生成气体,说明原溶液含有 H⁺,故CO32-与 HCO3-均不能存在,A项错误;白色沉淀A 是硫酸钡,没有碳酸钡,加入硝酸沉淀不能溶解,B项错误;根据“无色透明溶液”,则原溶液不含有 FeJ,根据原溶液中“各种离子的物质的量浓度相等”,利用溶液为电中性判断原溶液只含有K⁺、H⁺、SO₄²⁻,实验面iii和 iv只能证明滤液中含有Cl⁻,且该Cl⁻是实验 ii引入的Cl⁻,C项错误;将原溶液蒸发浓缩、冷却结晶,可析出 KHSO4这种纯净物质,D 项正确。
15.答案 160g⋅ml⁻¹(2分)
2VL⋅ml⁻¹(2分)
(3)11.2(x+y)(2分)
(4)0.5(2分)
(5)①0.4ml(2分) 36 g⋅ml⁻¹(2分)
②8.4(2分)
命题透析 本题以物质的量的相关计算为情境,考查物质的量、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗定律等知识,意在考查理解与辨析能力,宏观辨识与微观探析的核心素养。
思路点拨(1)CO32-的摩尔质量为60g⋅ml⁻¹。
(2)16 g CH₄的物质的量为1m l,气体摩尔体积 Vn=VL1ml=VL⋅ml-1。
(3)在标准状况下,2L的密闭容器中恰好可盛放x个 N2分子和y个O2分子组成的混合气体,则 2L22.4L⋅ml-1=x+γNA,NA=11.2x+yml-1。
410mL 0.2ml⋅L⁻¹Al₂SO₄₃溶液中SO₄²⁻的物质的量为0.06ml,50 mL 0.3ml⋅L⁻¹(NH4)2SO4溶液中SO₄²⁻的物质的量为0.015 ml,所得混合溶液中SO₄²⁻的物质的量为0.075ml,SO₄²⁻的物质的量浓度为0.075ml/0.15 L=0.5ml⋅L⁻¹。
(5)①甲、乙两处压强相等,根据阿伏加德罗定律,同温同压下体积之比等于物质的量之比。由图可知甲、乙体积比为4:1,根据乙中充入4.4g CO₂(0.1m l)可判断甲中气体的总物质的量为0.4ml,混合气体的 M= m5n2=⋅ml-1。②当隔板刚好处于该密闭容器的正中间时, n甲=n2=0.4ml,因此应向乙容器中再通入0.3m l N₂,其质量为0.3ml×28g⋅ml⁻¹=8.4g。
16.答案 (1) ab(2分)
(2)①(2分) ③④(2分)
320H-+SO2=SO32-+H2O(2分)能(1分)
(4)漏斗、烧杯、玻璃棒(3分)
5CO33-+SO2=SO32-+CO2(2分) 化合反应(1分)
命题透析 本题以硫代硫酸钠晶体制备为素材,考查物质的分类与性质、反应类型、实验基本操作等知识,意在考查理解与辨析能力,宏观辨识与微观探析、变化观念与平衡思想的核心素养。
思路点拨(1)Na2S2O3·5H2O从化学式看属于纯净物,从阳离子看属于钠盐,从阴离子看属于硫代硫酸盐。
(2)Na2CO3溶液属于盐溶液,能导电;酸碱盐属于电解质,即 NaOH、Na2S属于电解质;混合物、SO3等非金属氧化物、单质都不是电解质。
(3)酸性氧化物与碱反应生成盐和水,向NaOH溶液中通入SO2生成Na2SO3和H2O。
(5)书写离子方程式时,Na2CO3和Na2SO3均可以拆开;反应 ii是化合反应。
17.答案 1①Cl₂+H₂O=H⁺+Cl⁻+HClO(2分)
②大(1分) a(1分) N装置出现倒吸现象(合理即可,2分)
2HClO₄+NaOH=NaClO₄+H₂O(2分)
(3)①分液漏斗(1分)
②不合理(1分) 碱石灰含有CaO和NaOH,能与氯气反应(合理即可,2分)
③Cl₂+2OH⁻=Cl⁻+ClO⁻+H₂O(2分)
命题透析 本题以氯及其化合物的“价—类”二维图为素材,考查氯及其化含物性质及其应用、实验设计与评价等知识,意在考查探究与创新能力,科学探究与创新意识的核心素养。
思路点拨 (1)①氯气与水反应产生次氯酸,次氯酸具有杀菌消毒作用,该反应的离子方程式为:Cl₂+H₂O= H⁺+Cl⁻+HClO。。②丙为ClO₂,相对分子质量大于空气的平均相对分子质量,故其密度比空气大,收集时应选择向上排空气法,即从M装置的a端进气;因为ClO₂极易溶于水,若将ClO2从N装置的c端通人,则N装置中的水可能会出现倒吸现象。
(2)由题意可知,己为含氧酸和一元强酸,且其中的氯元素显+7价,则己为HClO4,与NaOH发生中和反应生成盐和水。
(3)②碱石灰含有CaO和NaOH,能与氯气反应,故不能用碱石灰除杂和干燥氯气。③NaOH溶液的作用是吸收尾气中的氯气。
18.答案 (1)煤油或石蜡油(1分) 隔绝空气和水(2分)
22Na₂O₂+2CO₂=2Na₂CO₃+O₂或 2Na₂O₂+2H₂O=4NaOH+O₂↑(2分) 16(2分)
(3)NaHCO₃ 热分解或与酸反应能产生大量气体(合理即可,2分)
(4)①NaHCO₃(1分) B(1分) Ca²⁺+2OH⁻+CO₂=CaCO₃↓+H₂O(2分)
②先将导气管从烧杯A、B中移出,再熄灭酒精灯(合理即可,2分)
命题透析 本题以钠及其化合物转化流程为素材,考查钠及其化合物性质及其应用、实验设计与评价等知识,意在考查理解与辨析、分析与推测能力,宏观辨识与微观探析的核心素养。
思路点拨 (2)Na2O2与H2O反应的化学方程式为 2Na2O2+2H2O=4NaOH+O2↑,若1ml物质完全是H₂O,反应产生0.5mlO₂,其质量是16g。Na2O2与CO₂反应的化学方程式为: 2Na₂O₂+2CO₂=2Na₂CO₃+O₂,若1m l 物质完全是 CO₂,反应产生0.5mlO₂,其质量是16g。故足量 Na₂O₂固体与1ml混合气体(含有水蒸气的CO2)充分反应,无论二者相对量的多少,都是反应产生16gO₂。
(3)NaHCO₃用作馒头膨松剂的原因为NaHCO₃热分解或与酸反应能产生大量气体。
(4)①在套管实验中,内管应该放NaHCO₃,外管放Na₂CO₃,使得Na₂CO₃直接受热,NaHCO₃间接受热。B烧杯中的澄清石灰水变浑浊,A烧杯中的澄清石灰水始终不变浑浊,证明Na₂CO₃比NaHCO₃稳定。②实验结束时要先将导气管从烧杯A、B中移出,再熄灭酒精灯,以免倒吸。
选项
A.
B
C
D
M
NaHSO₄
NaOH
HCl
Ba(OH)₂
N
Ba(OH)₂
MgCl₂
NaOH
CuSO₄
相关试卷
这是一份河南省南阳市六校2024-2025学年高一上学期期中联考化学试题 扫描版含解析,共13页。
这是一份河南省南阳市六校2024-2025学年高一上学期11月期中联考化学试题,共13页。
这是一份河南省南阳市六校2024-2025学年高一上学期10月第一次联考化学试题(含解析),共14页。试卷主要包含了已知标准状况下,下列说法中正确的有几个等内容,欢迎下载使用。









