






所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评优课课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物评优课课件ppt,共53页。
“人间炼狱”印尼伊真火山
为什么火山会有这样颜色的火焰?
这种颜色的火焰是有什么引起的呢?
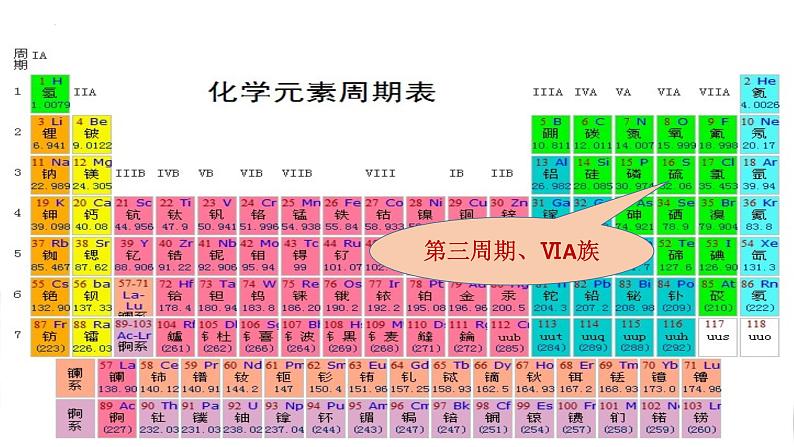
-2、0、+4、+6
硫元素的“位——构——性”
自然界的硫单质存在于火山口附近,人们可以直接开采,硫元素在自然界除了以游离态的形式存在,还以哪些化合态的形式存在?单质硫有什么样的性质?
火山喷口附近或地壳的岩层中
蛋白质、化石燃料(石油、煤)等硫化物:黄铜矿(CuFeS2)、黄铁矿(FeS2)等硫酸盐:石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)
硫(俗称硫黄),黄色晶体,质脆,易研成粉末,难溶于水,微溶于酒精,易溶于二硫化碳。
CS2可用于洗涤内壁附着硫的试管
(2)铜 2Cu+S===Cu2S (黑色)
(3)铁 Fe+S===FeS (黑色)
(1)汞 Hg+S===HgS(除汞)
硫的氧化性较弱,与Cu、Fe等变价金属反应生成低价的硫化物。
硫的化学性质比较活泼,能与许多金属单质及非金属单质发生化学反应。
不小心打碎水银温度计,如何处理?
氧化性:Cl2 ____ S
Fe 、Cu 在氯气中燃烧,产物是什么?从氧化还原角度分析,可得出什么结论?
反应现象:(火焰)空气中:淡蓝色, 纯氧中:明亮蓝紫色
反应现象:有臭鸡蛋气味
硫和金属/非金属单质反应,表现什么性质?
硫单质既有氧化性又有还原性。
3S+6NaOH === 2Na2S+ Na2SO3+3H2O
S + 2H2SO4(浓)=== 3SO2↑ + 2H2O
类比 Cl2 与 NaOH 溶液的反应,试着写出 S 与 NaOH 溶液加热时的反应。
从氧化还原的角度,试着写出 S 和浓硫酸在加热时的反应。
(1)S、Cl2与Fe、Cu反应的产物有何差异?原因是什么?
(2)如何洗涤附着在试管内壁上的硫?
原因:硫是一种弱氧化剂,与可变价金属(如Fe、Cu)反应时,生成低价金属硫化物,而Cl2的氧化性强于S,与可变价金属作用,生成高价态氯化物。
可用 CS2 或 热NaOH溶液洗涤试管内壁的硫。
(1)在自然界中有游离态的硫存在( )(2)试管内壁的硫粉可以用热碱液或 CS2 除去( )(3)硫与金属反应,生成金属的低价态化合物( )(4)硫的氧化性比氯气强( )(5)硫是一种黄色的能溶于水的晶体( )(6)硫的化合物常存在于火山喷出的气体中和矿泉水里( )(7)硫在空气中燃烧的产物是二氧化硫, 硫在纯氧中燃烧的产物是三氧化硫( )(8)我国古代四大发明之一的黑火药是以硫黄等为原料配制而成的( )
为什么硫与铁、铜反应生成的化合物中硫化合价为-2价,而与氧气反应生成二氧化硫中硫的化合价为+4价?
硫原子最外层电子有6个,在化学反应中容易得到2个电子,形成-2价硫的化合物。而与同族氧元素比较,硫元素多了一个电子层,得电子能力相对较弱,而失电子能力相对较强。
乐山大佛开凿于唐玄宗开元初年(公元713年),为世界第一大石刻弥勒佛,“佛是一座山,山是一尊佛”是其真实写照,请同学们仔细观察,历经千年时间的流逝,是什么物质使大佛鼻翼发黑,佛容暗淡呢?
二氧化硫是常见的硫的氧化物。但是二氧化硫有毒。无论是化学实验还是工业生产都不能向空气中排放SO2
思考:SO2的物理性质体现在哪些方面?
如图5-2所示,把充满SO2、塞有橡胶塞的试管倒立在水中,在水面下打开橡胶塞,观察试管内页面的上升。待液面高度不再明显变化时,在水下用橡胶塞塞紧试管口,取出试管,用pH试纸测定溶液的酸碱度(保留该溶液供实验5-2使用)。
二氧化硫和水演示实验视频:
思考:SO2溶于水仅仅是溶于水吗?有没有发生化学反应?其产物又是什么?能否设计实验验证你的猜测?
探究结论: SO2溶于水后形成的水溶液显酸性, 且体现了酸性氧化物的性质(类比CO2)。
亚硫酸是一种弱酸,不稳定
弱酸,不稳定,容易分解
思考:判断下列反应哪些不属于可逆反应?为什么?
2NO2 N2O42H2+O2 2H2O SO2+ H2O H2SO3 CO2+ H2O H2CO3
请写出SO2与氧化钙、氢氧化钠、Ca(OH)2溶液反应的化学方程式。
CaO + SO2 = CaSO3
CO2 通入NaOH溶液,如果通入过量CO2呢?
2NaOH + SO2 === Na2SO3 + H2O
NaOH + SO2 === NaHSO3
1.少量SO2 + NaOH溶液:
2. 过量SO2 + NaOH溶液:
SO2 通入NaOH溶液至过量,
NaOH + CO2 === NaHCO3
2NaOH + CO2 === Na2CO3 + H2O
1.少量CO2 + NaOH溶液:
2. 过量CO2 + NaOH溶液:
CO2 通入澄清石灰水,现象是?如果通入过量CO2呢?
Ca(OH)2 + SO2 === CaSO3↓ + H2O
Ca(OH)2 + 2SO2 === Ca(HSO3)2
1.少量SO2 + 澄清石灰水:
2. 过量SO2 + 澄清石灰水:
SO2 通入澄清石灰水至过量,现象是?
Ca(OH)2 + 2CO2 === Ca(HCO3)2
Ca(OH)2 + CO2 === CaCO3↓ + H2O
1.少量CO2 + 澄清石灰水:
2. 过量CO2 + 澄清石灰水:
SO2+2NaHCO3 === Na2SO3+2CO2+H2O
SO2+NaHCO3 === NaHSO3+CO2
请写出 SO2 与 NaHCO3 溶液反应的化学方程式。
H2SO3 > H2CO3
SO2能被O2、X2(Cl2、Br2、I2)、KMnO4( H+ )溶液等强氧化剂氧化。
1.与 O2 反应:2SO2+O2 2SO3,该反应为可逆反应。
与X2反应:X2+SO2+2H2O===2HX+H2SO4
2.与 Cl2 反应:Cl2+SO2+2H2O===2HCl+H2SO4
3 . 2KMnO4+5SO2+2H2O===K2SO4+2MnSO4+2H2SO4
5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
SO2 + 2H2S === 3S + 2H2O
结论:二氧化硫既具有氧化性又具有还原性
用试管取2 mL 在实验5-1中得到的溶液,向其中滴入1~2滴品红溶液,振荡,观察溶液的颜色变化。
然后加热试管,注意通风,再观察溶液的变化。
无色溶液又恢复原来的红色
SO2的漂白性是暂时的,不稳定,容易变回原来的颜色
注意:SO2遇到紫色石蕊试液,紫色石蕊试液变红不褪色。
(2)漂白原理:SO2可与某些有色物质生成不稳定的无色物质,但加热(或见光、长时间放置),不稳定物质又分解为原有色物质和SO2。
SO2+H2O+有色物质——→化合不稳定无色物质——→有色物质。
(1)SO2具有漂白作用,能使品红溶液褪色,但不能使酸碱指示剂褪色。
(3)工业上常用二氧化硫来漂白纸浆、毛、丝等
我们学过的,有漂白性的还有哪些物质?
将有色物质氧化成无色物质
疏松多孔,较大表面积,吸附有色物质
HClO、Ca(ClO)2Na2O2、H2O2
Al(OH)3、Fe(OH)3胶体
1.SO2和CO2的性质比较
无色、有刺激性气味、易溶于水(1∶40)
无色、无味、能溶于水(1∶1)
能使品红褪色,能使澄清石灰水变浑浊
不能使品红褪色,能使澄清石灰水变浑浊
2.把 SO2 和 Cl2 同时通入溶液中,溶液的漂白性是“强强联合”吗?
提示: 若将等物质的量的 Cl2 和 SO2 气体混合后,在溶液中发生反应:SO2+Cl2+2H2O === H2SO4+2HCl,从而失去漂白能力。
(1)原理: Na2SO3+H2SO4(浓) = Na2SO4 + H2O +SO2↑
(2)原料: 亚硫酸钠粉末和浓硫酸
(3)发生装置:固+液
(4)除杂装置:浓硫酸
(5)收集装置:向上排空气法
(6)尾气处理装置:用氢氧化钠溶液吸收SO2
在新闻报道中,我们经常听到有关酸雨的报道。酸雨对我们的环境和生活产生了巨大的影响。
① SO2有刺激性气味,有毒,排入空气中会污染空气
② SO2和NO2是形成酸雨的主要物质
③ 酸雨的PH值小于5.6
正常雨水的PH=5.6,是因为溶有CO2
④酸雨的防治:开发新能源,安装工业脱硫装置,尾气处理。
(1)工业上常用SO2来漂白纸浆、毛、丝等;
(2)SO2可用于杀菌消毒,还是一种食品添加剂。
2SO2 + O2 2SO3
SO3 + H2O = H2SO4
SO3+Ca(OH)2 === CaSO4↓+H2O
(1)物理性质:SO3的熔点16.8 ℃,沸点44.8 ℃,在常温下为无色透明状液体,在标准状态下SO3为固态。
四、硫的氧化物---SO3
(2)化学性质——酸性氧化物的通性:
注意:不能说在标准状态下1ml SO3 所占的体积为 22.4L
SO3+H2O === H2SO4
SO3+CaO === CaSO4
③与Ca(OH)2溶液反应:
(1)物理性质:硫化氢是一种无色、有臭鸡蛋气味的有毒气体, 溶于水即得到氢硫酸。
SO2+2H2S == 3S↓ + 2H2O
2FeCl3+H2S == 2FeCl2+S↓+2HCl
H2S ⇌ H++ HS-
HS- ⇌ H++ S2-
氢硫酸是一种二元弱酸,具有酸的通性。
SO2通入氢硫酸H2S中:
H2S通入FeCl3溶液:
H2S+2NaOH == Na2S+2H2O
【分析】①Cu和S反应生成Cu2S;②FeS可以由两者反应生成;③S和O2反应生成SO2;④H2S可以由两者反应生成;⑤Fe和Cl2反应生成FeCl3。故答案为:A
1.下列物质中,不能由单质直接化合生成 ( )①CuS ②FeS ③SO3 ④H2S ⑤FeCl2A.①③⑤ B.①②③⑤C.①②④⑤ D.全部
2.将SO2分别通入下表所列的溶液中,填写有关问题。
3.某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
(1)装置A中的化学方程式为:
(2)实验过程中,装置B中产生的现象为 这说明SO2具有 。
(3)装置C的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象 .(4)尾气可采用 溶液吸收。
品红溶液褪色后,关闭分液漏斗旋塞,点燃酒精灯加热,溶液恢复为红色
4、下列说法正确的是( )
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色B.能使品红溶液褪色的不一定是 SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.盐酸能使滴有酚酞的NaOH溶液褪色,所以盐酸也有漂白性
某化学实验兴趣小组的同学用如图装置通入SO2气体进行实验。
(2)写出③中发生反应的化学方程式_______________________________________。
I2+SO2+2H2O===H2SO4+2HI
[性质验证解题思维模型]
相关课件
这是一份高中第一节 硫及其化合物授课课件ppt,共28页。PPT课件主要包含了CO2,SO2,H2S,SO3,新旧草帽,新旧报纸书本,氧化性漂白,化合漂白,活性炭,吸附漂白等内容,欢迎下载使用。
这是一份化学必修 第二册第一节 硫及其化合物完美版ppt课件,共60页。PPT课件主要包含了第一节硫及其化合物,一硫和二氧化硫,三硫酸根离子的检验,练习与应用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课ppt课件,共29页。PPT课件主要包含了问题预设及反馈,第一节硫及其化合物,第1课时硫,硫原子的结构,硫元素的存在,①与金属反应,②与非金属反应,表现氧化性,表现还原性,用热碱溶液清洗硫等内容,欢迎下载使用。










