



所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
高中人教版 (2019)第一节 硫及其化合物优秀课件ppt
展开
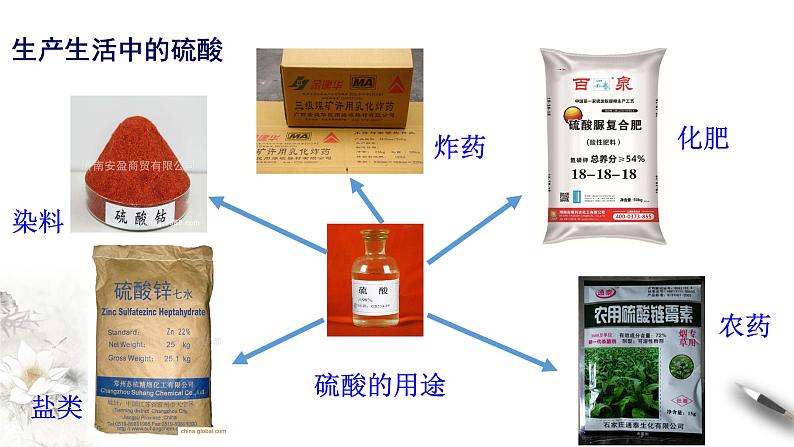
这是一份高中人教版 (2019)第一节 硫及其化合物优秀课件ppt,共38页。PPT课件主要包含了酸入水,生产生活中的硫酸,硫酸的用途,工业制硫酸,硫酸的制备,反应化学方程式,发烟硫酸,硫酸的物理性质,溶解性,浓硫酸等内容,欢迎下载使用。
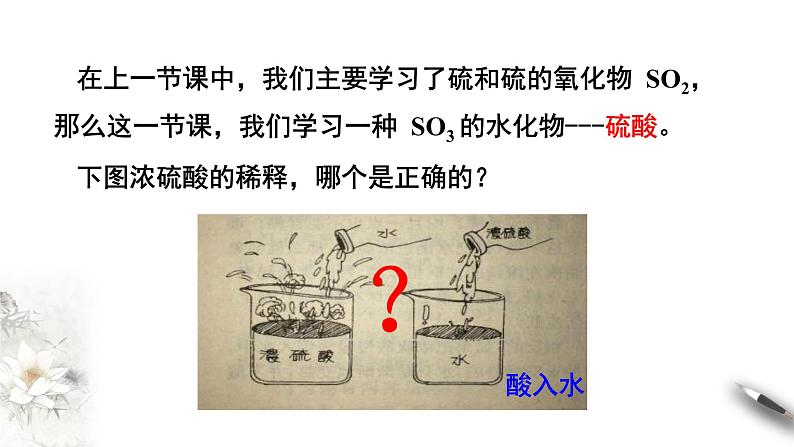
在上一节课中,我们主要学习了硫和硫的氧化物 SO2,那么这一节课,我们学习一种 SO3 的水化物---硫酸。
下图浓硫酸的稀释,哪个是正确的?
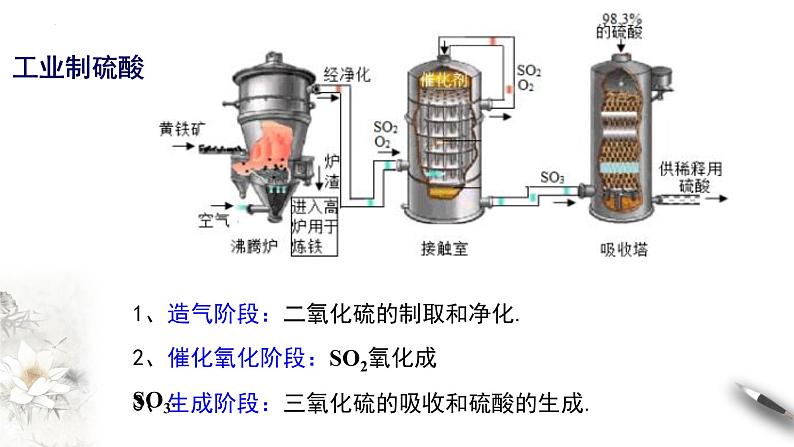
1、造气阶段:二氧化硫的制取和净化.
2、催化氧化阶段:SO2氧化成SO3.
3、生成阶段:三氧化硫的吸收和硫酸的生成.
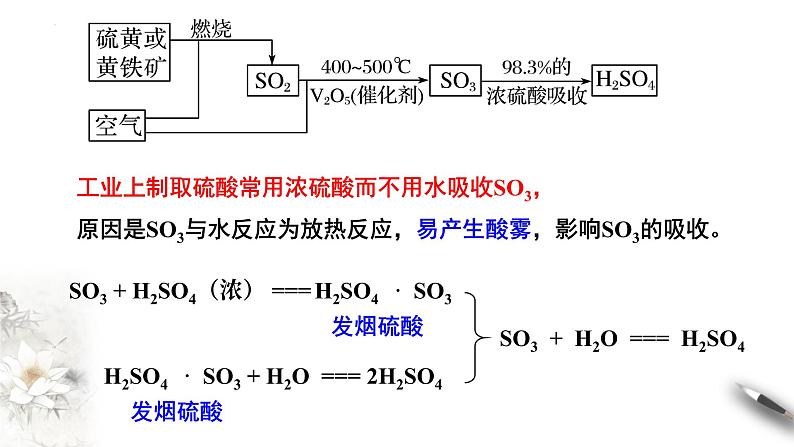
1.生产原理 工业上一般以硫磺或者其他含硫矿物(如黄铁矿)为原料来制备硫酸:
4FeS2 + 11 O2 ===== 2 Fe2O3 + 8 SO2
(S + O2 ===== SO2 )
2SO2 + O2 2 SO3
SO3 + H2O ==== H2SO4
工业上制取硫酸常用浓硫酸而不用水吸收SO3,原因是SO3与水反应为放热反应,易产生酸雾,影响SO3的吸收。
SO3 + H2SO4(浓) === H2SO4 · SO3
H2SO4 · SO3 + H2O === 2H2SO4
SO3 + H2O === H2SO4
1、纯硫酸是一种无色油状液体,沸点高(338 ℃),难挥发。
2、密度:密度为 1.84 g / cm3 (比水大)
4、浓硫酸的稀释方法:
浓H2SO4与水以_____比互溶,
将________沿器壁慢慢注入__中,并用玻璃棒不断搅拌。
1、稀硫酸——具有酸的通性
(1)完全电离,电离方程式:
H2SO4 = 2H+ + SO42-
(2)稀硫酸具有酸的五个通性:
如 Fe:________________________________
Fe + 2H+ === Fe2+ + H2↑
如 NaOH:______________________________
如 CuO :______________________________
CuO + 2H+ === Cu2+ + H2O
OH- + H+ === H2O
如 Na2CO3:_____________________________
CO32-+2H+===H2O+CO2↑
浓硫酸:主要以分子形式存在,所以具有和稀硫酸不同的化学性质。
(1)吸水性:浓硫酸能够吸收气体、液体、某些结晶水合物中的水分子,故常用做________。
碱性气体—NH3 、还原性气体—H2S、HBr、HI
不能用于干燥碱性气体和还原性气体
可用来干燥与它不起反应的气体(中性气体和酸性气体),
如 H2、O2、 N2、 CH4、
(浓硫酸吸收物质本来就有的水)
Cl2 、HCl 、CO2、CO、SO2、NO2、NO。
问:浓硫酸敞口放置于空气中,质量有什么变化?
答:质量变大了。因为浓硫酸有吸水性,吸收空气中的水分后使质量增加。
浓硫酸能将蔗糖、纸张、棉布和木材等有机物中的氢、氧元素按水的组成比(2:1)脱去,留下黑色的炭。
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的固体,并有刺激性气味的气体产生。
生成的气体有H2O、CO2、SO2
C + 2H2SO4(浓)===== 2SO2 ↑ + CO2 ↑ +2H2O
由于有水出来和浓硫酸放出大量的热
浓硫酸吸水性和脱水性的区别
二者的根本区别在于物质本身是否存在水分子
如果不慎在皮肤上沾上了浓硫酸,应该怎样做?
应该立刻用干布拭去溶液,然后再用大量的水冲洗。再涂上 2℅~3℅ NaHCO3溶液
【实验5-3】在带导管的橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝。在试管中加入2mL浓硫酸,塞好橡胶塞,使铜丝和浓硫酸接触。加热,将产生的气体先后通入品红溶液和石蕊溶液中,观察实验现象。向外拉铜丝,终止反应。冷却后,将试管里的物质慢慢倒入盛有少量水的另一只试管里,观察溶液的颜色。
注意!!!浓硫酸具有很强的腐蚀性,在实验中应注意安全防护!
浓硫酸与铜反应演示实验视频:
在反应中,浓硫酸作氧化剂,铜作还原剂。
在上述反应中,硫酸表现出了________和_____。
1.将铜片改为铜丝有什么好处?
增大接触面积,加快反应速率
来控制反应的发生或停止
可以吸收多余的SO2,以防止污染环境
加热时,除Au、Pt以外的绝大多数金属都能与浓硫酸反应,生成高价态金属的硫酸盐,本身被还原为SO2气体 。
1ml 的铜与足量的浓H2SO4 反应,可制得多少SO2 ?
被还原的浓H2SO4的物质的量是多少?
浓硫酸可以跟金属反应,为什么还可以用铁罐车运输浓硫酸?
加热时,浓硫酸与木炭反应的化学方程式为
C + 2H2SO4 (浓) ===== 2SO2 ↑ + CO2 ↑ +2H2O
体现了浓H2SO4的强氧化性
思考:如何用实验方法证明木炭与浓硫酸反应的产物?
S + 2H2SO4 (浓) ===== 3SO2 ↑ + 2H2O
2P + 5H2SO4 (浓) ===== 5SO2 ↑ + 2H2O + 2H3PO4
加热时,浓硫酸与硫单质反应的化学方程式为
加热时,浓硫酸与磷单质反应的化学方程式为
③与还原性化合物的反应:
※所以浓H2SO4作干燥剂时,不能干燥还原性气体。
利用浓硫酸高沸点难挥发性可以用来制易挥发性酸:
NaCl(固)+H2SO4(浓)
NaHSO4+HCl↑
NaNO3(固)+H2SO4(浓)
NaHSO4+HNO3↑
一些含 叫做矾。
胆矾 ,绿矾 ,皓(hà)矾 ,明矾 ,生石膏 ,熟石膏 , 重晶石 。
KAl(SO4)2·12H2O
四、生产生活中的硫酸盐
CaSO4·2H2O 2CaSO4·H2O 石膏 熟石膏
风化是指在室温和干燥空气里,结晶水合物失去结晶水的现象。
则由石膏制取熟石膏的过程不属于风化
晶体自发吸收空气中的水蒸气,在它们的固体表面逐渐形成饱和溶液,这种现象叫做潮解。
则由熟石膏变为生石膏的过程不是潮解
无水硫酸铜用于检测水的存在
CuSO4·5H2O(俗称胆矾)
胆矾可以和石灰乳混合制成一种常用的农药——波尔多液
(1)浓硫酸可用来干燥某些气体,是因为浓硫酸有难挥发性( )(2)在空气中敞口久置的浓硫酸,溶液质量增大, 体现了浓硫酸的脱水性( )(3)浓硫酸使蔗糖炭化变黑并放出气体, 体现了浓硫酸的脱水性和强氧化性( )(4)浓硫酸滴在润湿的蓝色石蕊试纸上, 试纸先变红后变黑,体现了浓硫酸的酸性、脱水性( )(5)浓硫酸与木炭粉反应,体现浓硫酸的酸性和强氧化性( )(6)铁制容器、铝制容器可盛放浓硫酸,是因为它们不发生化学反应( )(7)H2S不能用浓硫酸干燥,是因为浓硫酸的氧化性( )(8)浓硫酸在加热条件下与铜反应,体现了浓硫酸的酸性和氧化性( )
1.(2011·高考上海卷)下列溶液中通入SO2一定不会产生沉淀的是( )A.Ba(OH)2 B.Ba(NO3)2C.Na2S D.BaCl2
解析:选D。A中生成BaSO3,B中生成BaSO4,C中有S生成。
A、蔗糖炭化是浓硫酸脱水性;B、浓硫酸和铜反应需要加热;C、浓硫酸不能干燥氨气; D、浓硫酸可以使铁、铝钝化。
2.下列关于浓硫酸的叙述正确的是 ( ) A.浓硫酸具有吸水性,因而能使蔗糖炭化 B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 D.浓硫酸在常温下能够使铁、铝等金属钝化
3.足量Cu 与2ml的浓硫酸反应,在标准状态下制得的 SO2体积为什么小于 22.4 L?
答:因为浓硫酸消耗变为稀硫酸,不与铜反应,所以在标准状态下制的SO2体积小于22.4 L。
4. 硫酸厂有一辆存放过浓硫酸的铁槽车。某工人违反操作规程,边吸烟边用水冲洗铁槽车,结果发生了爆炸。下列对引起爆炸的原因说法正确的是( )A.浓硫酸遇明火爆炸B.浓硫酸遇水发热爆炸C.铁与水(常温下)反应产生的氧化物爆炸D.稀释后的硫酸与铁反应产生的氢气在空气中遇明火而爆炸
答案:D。浓硫酸可以和铁在常温下钝化,但是稀硫酸可和铁反应
相关课件
这是一份化学必修 第二册第一节 硫及其化合物完美版ppt课件,共60页。PPT课件主要包含了第一节硫及其化合物,一硫和二氧化硫,三硫酸根离子的检验,练习与应用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物教课ppt课件,共29页。PPT课件主要包含了问题预设及反馈,第一节硫及其化合物,第1课时硫,硫原子的结构,硫元素的存在,①与金属反应,②与非金属反应,表现氧化性,表现还原性,用热碱溶液清洗硫等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 硫及其化合物图片ppt课件,共25页。PPT课件主要包含了与水反应,分类酸性氧化物,2SO2化学性质,与碱反应,与碱性氧化物反应,体现较强还原性,3应用,4小结,⑶杀灭霉菌和细菌,⑴制造硫酸等内容,欢迎下载使用。









