




所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物一等奖课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物一等奖课件ppt,共49页。PPT课件主要包含了空气中的氮气,动植物蛋白质,一氮气与氮的固定,氮分子,蛋白质,硝酸盐,氮气的性质,密度比空气稍小,难溶于水,1物理性质等内容,欢迎下载使用。
第二节 氮及其化合物第一课时 氮气与氮的固定一氧化氮和二氧化氮
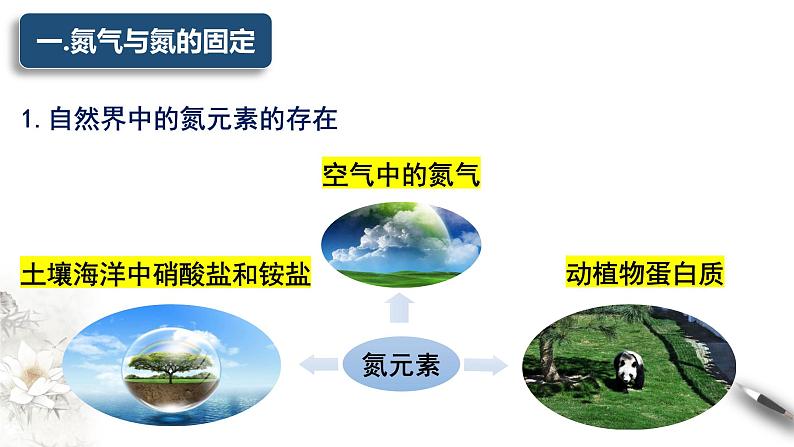
1.自然界中的氮元素的存在
土壤海洋中硝酸盐和铵盐
①游离态:主要以 的形式存在于空气中,约占空气的78%(体积分数)。②化合态:部分存在于动植物体内的 中;
部分存在于土壤、海洋里的 和 中。
熔点:-210℃沸点:-196℃密度:1.25g/L
收集氮气时用排水法不用排空气法
画出氮原子的结构示意图,分析氮的原子结构,推断含氮物质可能的化学特性。
氮原子的最外电子层有5个电子,既不容易得到3个电子,也不容易失去5个电子。
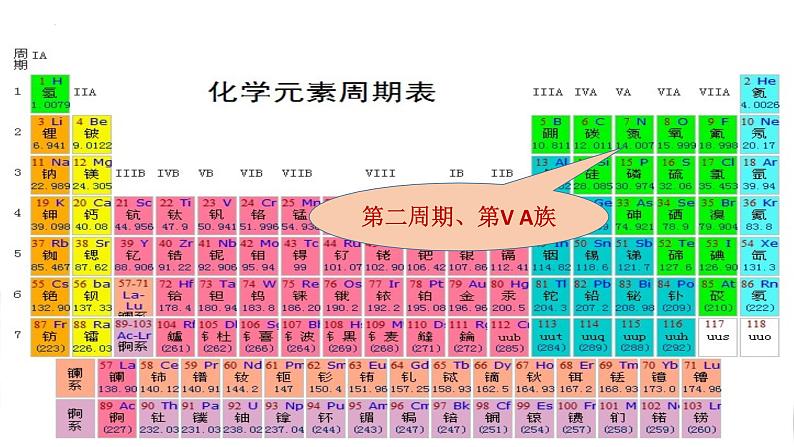
氮元素位于元素周期表的第二周期、第VA族。
因此,氮原子一般通过共用电子对与其他原子相互结合构成物质。
主要化合价:-3,0,+2,+4,+5
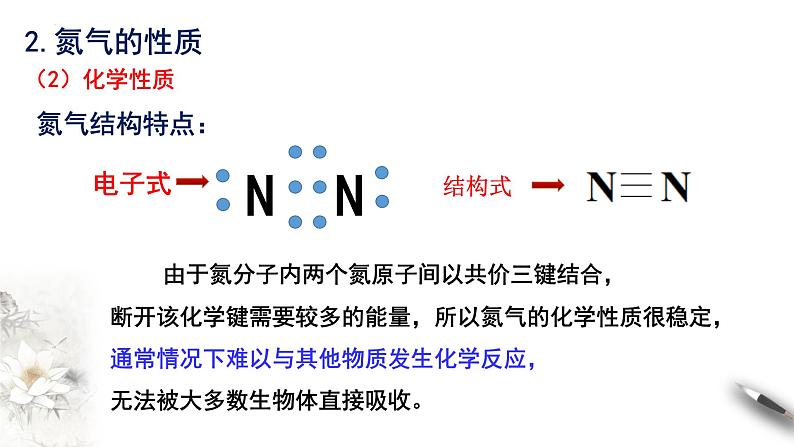
由于氮分子内两个氮原子间以共价三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下难以与其他物质发生化学反应,无法被大多数生物体直接吸收。
但在高温、放电等条件下,氮分子获得了足够的能量,使 N≡N 断裂,也可以和一些物质发生化学反应。
①金属镁:___________________ ,氮气表现 性;
③氢气:_______________________ ,氮气表现 性;
②氧气:_____________________ ,氮气表现 性。
镁条在空气中燃烧,固体产物有几种?
Mg3N2、MgO、C(镁条可以在 CO2 中燃烧)
氮气保护技术通常应用于珍贵文物的保存和保护,国内外不乏先例。美国的《独立宣言》就密封在氮气环境中;中国博物馆和中南海毛主席故居纪念馆也是应用氮气保护法;北京房山云居寺“99石经回藏”也是氮气保护的成功典范。
为什么氮气可以作为保护气?
氮气性质稳定,常温下不与物质发生反应,故可作保护气。
① 化合物制造:化肥、氨、硝酸等化合物的制造;
② 惰性保护:惰性保护介质,速冻食品;
③ 制冷剂:低温粉碎等的制冷剂、冷却剂;
1.含义----将大气中游离态的氮转化为氮的化合物的过程。
(1)自然固氮:大自然通过闪电释放的能量将空气中的氮气转化为含氮的化合物,或豆科植物根瘤菌将氮气转化为氨。
(2)人工固氮:如工业合成氨。
自然固氮和人工固氮都是化学变化
N2+O2 ==== 2NO
氮是自然界各种生物体生命活动不可缺少的重要元素,自然界是怎样通过氮的循环为生物体提供氮元素的呢?
工业合成氨为农作物为农作物的生长提供了必须的氮元素,为其他化工产品(如炸药、农药、染料等)的生产提供了重要原料。
(1)自然界:①豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮的化合物。②在放电条件下,空气中N2与氧气化合为氮的氧化物,并随降雨进入水体和土壤中。③微生物分解动植物中的蛋白质生成小分子的含氮化合物,回到水体和土壤中。
(2)人类活动:①将空气中N2合成氨,再进一步转化为其他含氮化合物,进入水体和土壤中。②化石燃料燃烧、森林和农作物的枝叶燃烧所产生的氮氧化物通过大气进入陆地和海洋。
1.自然界中的氮循环涉及氮气及氮的许多化合物,请指出它们的物质类别和其中氮元素的化合价?
2.人体里的蛋白质中的氮元素是从哪儿来的?
提示人体里蛋白质中的氮是从外界摄入的,特别是肉类、蛋类物质等。若溯本求源,则来自大气中的N2。
3.氮循环中含氮物质有多种形式的转化,对生产生活有益,或负面作用。
提示①有益:人工固氮如合成氨,为农作物的生长提供必需的氮元素,为其他化工产品的生产提供重要原料。②有害:工业废气、汽车尾气中的氮氧化物会造成大气污染等;工厂废液、生活废水中氮元素对水体造成污染。
N的氧化物的种类——它们都有毒,是大气污染物。
二.一氧化氮与二氧化氮
无色有甜味的气体,在室温下稳定,有轻微麻醉作用,并能致人发笑,已被列入《危险化学品目录》
上述氮的氧化物中属于酸性氧化物的是 。
N2O5 和 N2O3
+1,+2,+3,+4,+4,+5
N2O(笑气)、NO、N2O3、NO2、N2O4、N2O5 六种,其化合价分别是。
3CO+2NO2====3CO2+N2O
1、一氧化氮和二氧化氮的性质
【实验5-5】 如图5-10所示,在一支50mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象,打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察现象,振荡注射器,再观察现象。
注射器内气体变为红棕色
NO和O2反应生成红棕色NO2
注射器活塞继续向左移动
NO2 溶于水生成无色的NO
二氧化氮溶于水的实验视频:
1.实验5-5中发生了哪些化学反应?2.如果要将注射器中的NO充分转化,可以采取什么措施?3.上述实验对工业上生产硝酸有什么启示?
2NO+O2 === 2NO2
3NO2+H2O === 2HNO3+NO
在用水吸收NO2制取硝酸的反应过程中,要不断地补充一些空气,使NO2尽可能多地转化为硝酸
易被O2氧化为NO2
6NO + 4NH3 5N2 + 6H2O
催化剂 ==== 加热
2NO+O2 ==2NO2
2NO + 2CO N2 + 2CO2
难被氧化,易与水反应生成HNO3和NO
3NO2+H2O ==2HNO3+NO
NO2单独与NaOH溶液反应
2NO2+ 2NaOH ==NaNO3+ NaNO2 +H2O
NO与NO2一起与NaOH溶液反应
NO单独不与NaOH溶液反应
NO+ NO2+ 2NaOH ==2NaNO2 +H2O
NO NO2均为不成盐氧化物
NO2具有较强的氧化性,可使湿润的KI淀粉试纸变蓝
2NO2 N2O4
NO2 + SO2 === SO3 + NO
常温下易转化为 N2O4
【提示】由于NO2和Br2在性质上有不少相似性:
思考:NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?
但二者性质又有差别。可以用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗法。
①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
所以不能用淀粉-KI试纸、pH试纸、NaOH溶液来鉴别,
加溴产生淡黄色沉淀,加NO2不变色
溴溶于水即为溴水,橙黄色。NO2溶于水红棕色褪去
你知道“雷雨发庄稼”背后的原理吗?
2、氮的氧化物溶于水的计算
无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体,反应的实质是
3NO2+H2O==2HNO3+NO,
故若有气体剩余只能是NO或O2,不可能是NO2。
2NO+O2==2NO2,
(1)有关化学反应方程式
3NO2+H2O===2HNO3+NO①
2NO+O2===2NO2②
4NO2+O2+2H2O=4HNO3 ③
4NO+3O2+2H2O===4HNO3④
也就是按此比例的气体可以和水完全反应生成硝酸。
①若 NO2 通入水中,关系式为 3NO2+H2O===2HNO3 +NO 。
②若 NO 和 NO2 通入水中,总关系式为3NO2+H2O===2HNO3 +NO 。
③若 NO 和 O2 通入水中,总关系式为 4NO+3O2+2H2O===4HNO3。
当体积比V(NO)∶V(O2)
< 4∶3 O2过量,剩余气体为O2
= 4∶3 恰好完全反应,无气体剩余
> 4∶3 NO过量,剩余气体为NO
④若 NO2 和 O2 通入水中,总关系式为 4NO2+O2+2H2O===4HNO3。
< 4∶1 O2过量,剩余气体为O2
当体积比V(NO2)∶V(O2)
= 4∶1 恰好完全反应,无气体剩余
> 4∶1 NO2过量,剩余气体为NO
(过量NO2与H2O反应生成NO)
3NO2+H2O===2HNO3 +NO
当NO2或NO转化为HNO3时要失去电子,若上述两种气体与O2混合通入水中时,O2得电子,且得失电子数必须相等,这是电子守恒法解答此类题目的依据。
(1)光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
3、氮氧化物对环境的污染
(2)酸雨:NOx排入大气中后,与水反应生成HNO3和HNO2,随雨雪降到地面。
(3)破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒,与CO相同。
NO与血红蛋白的结合能力大于CO
2NO + O2 = 2NO2
4NO + 3O2 + 2H2O = 4HNO3
4NO2 + O2 + 2H2O = 4HNO3
4、一氧化氮和二氧化氮的性质比较
【效果自测】 1.判断正误,正确的画“√”,错误的画“×”。(1)N2在高温条件下与O2发生反应生成NO2。( )(2)氮原子与其他原子只能形成共价键,不能形成离子键( )(3)氮气常用作焊接金属、填充灯泡、保存食品的保护气( )(4)白磷(P4)空气中自燃而氮气稳定存在,说明非金属性P比N强( )(5)NO2与H2O反应时,NO2是氧化剂,H2O是还原剂。( )(6)闪电时氮气与氧气化合生成NO,属于自然固氮。( )(7)将氨转化为固态铵盐的过程属于人工固氮。( )(8)氮气化学性质很稳定,所以镁着火时,可用氮气灭火。( )(9)高温、高压、催化剂条件下,1mlN2与3mlH2混合可生成2mlNH3。( )
1.NO吸收治疗法可快速改善SARS重症患者的缺氧状况,缓解病情,病毒学研究同时证实,NO对SARS病毒有直接抑制作用。下列关于NO的叙述正确的是( )A.NO是一种红棕色气体B.常温常压下,NO不能与空气中的氧气直接化合C.含等质量的氧元素的NO和CO的质量相等D.NO难溶于水,可以用排水法收集
解析:NO是一种无色难溶于水的气体,可以用排水法收集;常温常压下,NO易与氧气直接化合生成NO2。答案:D
2.汽车尾气主要含有CO2、CO、SO2、NOx等物质,这种尾气逐渐成为城市空气污染的主要来源之一。汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应的化学方程式可表示为_______________________________。
3.汽油中氮元素及其微量,为什么汽车排放的尾气中因含有氮 的氧化物,而污染大气,造成产生氮的氧化物的主要原因是( )A.燃烧含氮化合物燃料引起的 B.燃烧含铅汽油引起的C.是由于燃烧不充分引起的 D.是在气缸中N2被氧化生成的
解析:汽车排放的尾气中因含有氮的氧化物而污染大 气.产生氮的氧化物的主要原因是在汽缸中N2被氧化生成的。
4.一定温度和压强下,将装有N2和NO2混合气体的试管 倒立在水中,经足够时间后,试管内气体体积缩小为 原体积的3/5,则混合气体中N2和NO2的体积比为( ) A.2∶3 B.3∶2 C.3∶5 D.5∶3
解析:3NO2+H2O=2HNO3+NO,所以设N2为a体积,NO2为b体积,则总体积为a+b。反应后为a+(1/3)b ,因为试管内气体的体积缩小为原体积的3/5所以 [a+(1/3)b ]/(a+b)=3/5,a:b=2:3
5.下列反应起了氮的固定作用的是( ) A、N2、H2在一定条件下反应生成NH3 B、NH3经催化剂氧化生成NO C、NO与O2反应生成NO2 D、由NH3制碳铵和硫铵
解析:将空气中游离态的氮转变为氮的化合物的方法,统称氮的固定。
将盛N2和NO2混合气体的试管倒立于水中,经过长时间后,试管内气体体积缩小为原来一半,则原混合气体中N2和NO2的体积比是( )。A.1∶1B.1∶2C.1∶3D.3∶1
解析:只有NO2与H2O反应,剩余气体为生成的NO与不反应的N2。设原混合气体的体积为V,NO2的体积为x,根据差量法求解。3NO2+H2O══2HNO3+NO ΔV减3 1 2x
相关课件
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt,共60页。PPT课件主要包含了第二节氮及其化合物,一氮气与氮的固定,二一氧化氮和二氧化氮,三氨和按盐,四硝酸,五酸雨及防治,练习与应用等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物教案配套课件ppt,共12页。PPT课件主要包含了氮元素,第二周期第ⅤA族,氮气与氮的固定,密度比空气稍小,1物理性质,2分子结构,占空气组成的78%,3化学性质,氧化性,还原性等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物图文ppt课件,共1页。










