




所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
人教版 (2019)第二节 氮及其化合物完整版课件ppt
展开
这是一份人教版 (2019)第二节 氮及其化合物完整版课件ppt,共55页。PPT课件主要包含了工业合成氨,想一想,实验5-7,铵根离子的检验,实验室制取氨气,实验室制取氨气实验,氨的工业制备等内容,欢迎下载使用。
同学们阅读第12页科学史话,讲一讲哈伯工业合成氨的发展对人类历史的影响。
合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
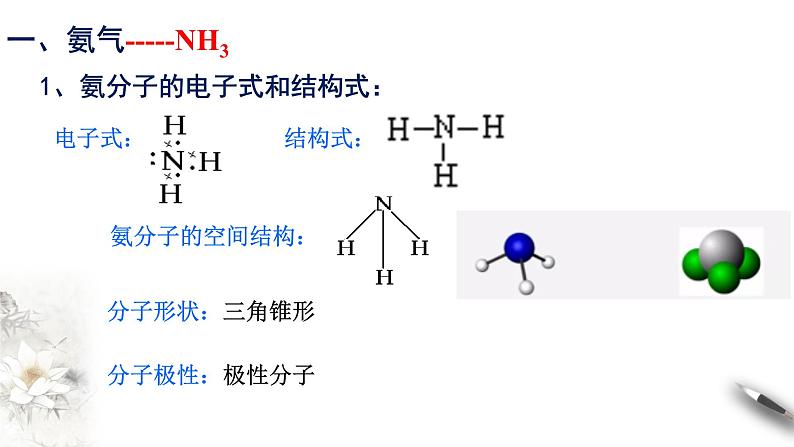
1、氨分子的电子式和结构式:
一、氨气-----NH3
氨是无色、有刺激性气味的气体,密度比空气的小。
氨很容易液化,液化时放热。液氨汽化时要吸收大量的热,使周围温度急剧降低。
因此,液氨可用作制冷剂
极易溶于水(1体积水溶解约700体积的氨气 1:700)。
【启发并实验】 氨极易溶解于水,用什么实验可以证明这一性质呢?
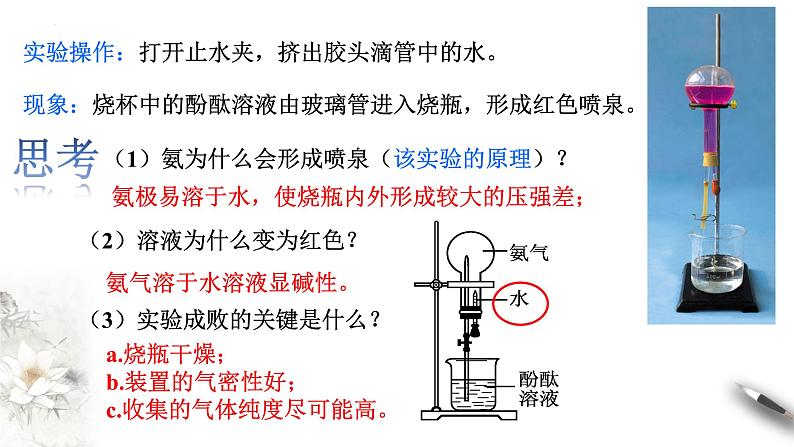
如图5-11所示,在干燥的圆底烧瓶里充满NH3,用带有玻璃管和胶头滴管(预先吸入水)的橡胶塞塞紧瓶口,倒置烧瓶,使玻璃管插入盛有水的烧杯中(预先在水里滴入少量酚酞溶液),打开弹簧夹,挤压胶头滴管,使水进入烧瓶,观察并描述现象,分析出现这些现象的可能原因。
【实验5-6】喷泉实验
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
(1)氨为什么会形成喷泉(该实验的原理)?
a.烧瓶干燥; b.装置的气密性好;c.收集的气体纯度尽可能高。
氨气溶于水溶液显碱性。
氨极易溶于水,使烧瓶内外形成较大的压强差;
现象:烧杯中的酚酞溶液由玻璃管进入烧瓶,形成红色喷泉。
实验操作:打开止水夹,挤出胶头滴管中的水。
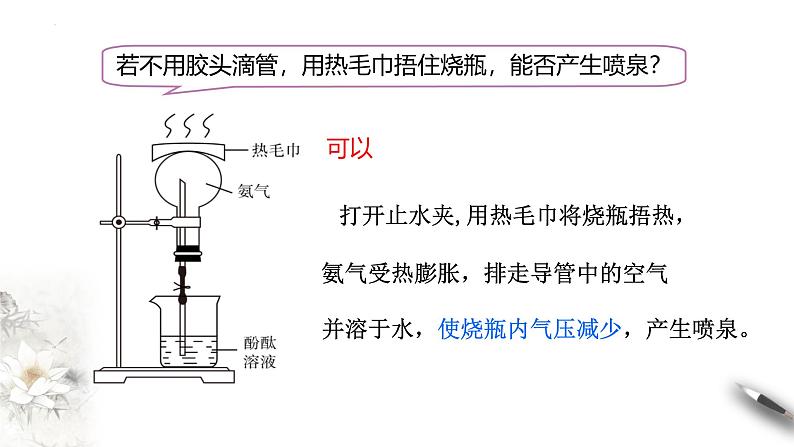
若不用胶头滴管,用热毛巾捂住烧瓶,能否产生喷泉?
打开止水夹,用热毛巾将烧瓶捂热,氨气受热膨胀,排走导管中的空气并溶于水,使烧瓶内气压减少,产生喷泉。
除了极易溶于水的NH3可以做喷泉实验,还有什么其他气体与溶液组合可以形成喷泉?
喷泉是一种常见的自然现象,其产生的原因是存在压强差。
产生喷泉的原理是什么?
NH3、HCl均属于极易溶于水(常温下,NH3—1:700,HCl—1:500)
三种气体均为酸性气体,均能与强碱溶液反应
城市中常见的人造喷泉及火山爆发的原理与上述的原理相似吗?
前者压强小于大气压后者压强大于大气压
氨是一种极易溶于水的气体,在常温常压下,1体积水大约可溶解700体积氨。
氨的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。
氨气溶于水时 ,大部分的NH3分子与 H2O分子结合成NH3·H2O(一水合氨)
NH3·H2O是弱碱,为弱电解质,可以部分电离。
氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水。通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里。
(1) 氨与水的反应:NH3+H2O NH3.H2O NH4++OH-
问题:氨水中含有哪几种微粒?
分子:NH3、H2O、NH3·H2O
离子:NH4+、OH-、H+
说明:一水合氨很不稳定,受热易分解。
实验探究——NH3与HCl 反应
氨气是一种碱性气体,氨几乎能与所有的酸(难溶性酸如H2SiO3除外)反应生成铵盐。
NH3 +HCI === NH4Cl
沾有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
NH3 是中学阶段唯一一种碱性气体
是不是所有的酸与氨反应,都能产生白烟?
NH3+HNO3 = NH4NO3
2NH3+H2SO4 = (NH4)2SO4
不是。只有挥发性的酸与氨气反应,才产生白烟,如浓盐酸,浓硝酸。
【应用】 管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生白烟,原理是什么?
(已知 2NH3 + 3Cl2 ==== N2 + 6HCl )
提示:若氯气管道漏气,发生反应:
2NH3+3Cl2====N2+6HCl
NH3+HCl====NH4Cl
产生的白烟是固体NH4Cl。
氨中氮元素的化合价为-3价。氨具有还原性,氨的催化氧化是工业制硝酸的基础。
氨除了上述课内反应,还可以发生哪些反应呢?
2NH3 + 3Cl2 == N2 + 6HCl
8NH3 + 3Cl2 == N2 + 6NH4Cl
4NH3 + 6NO === 5 N2 + 6H2O
8NH3 + 6NO2 === 7 N2 + 12H2O
2NH3+H2O+SO2===(NH4)2SO3
NH3+H2O+SO2===NH4HSO3
【例1】下列有关物质性质和用途说法错误的是( )A.液氨可用作制冷剂B.MgO熔点很高,可用于制造耐火材料C.SO2可用作食品防腐剂D.ClO2可用于杀菌消毒,H2O2不可以
【例2】如图装置中,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是( )A.若a为CO2,b为NaOH溶液,可出现无色喷泉B.若a为HCl,b为AgNO3溶液,可出现白色喷泉C.若a为NO,b为NaOH溶液,可出现无色喷泉D.若a为NH3,b为水(预先滴入少量酚酞溶液),可出现红色喷泉
【例3】同条件下,在容积相同的三个烧瓶内分别充满干燥的NH3、HCl、NO2气体,做喷泉实验,所得三种溶液的物质的量浓度比为( )A.3∶3∶2 B.2∶2∶3 C.1∶1∶1 D.无法比较
【例4】下列关于氨气的叙述中,正确是___________。①氨溶于水所得溶液中,除了水分子外,数目最多的微粒是 NH3·H2O②用蘸有浓氨水的玻璃棒靠近HCl、H2SO4时,均有白烟③氨气能使湿润的蓝色石蕊试纸变红④NH3通入MgCl2溶液中,产生白色沉淀⑤侯氏制碱法里,先通CO2,再通NH3⑥往溶液中加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+⑦氨的催化氧化是一种特殊的固氮方式
【例5】下列有关氨水和氯水的说法正确的是( )A.含有的微粒种类相同 B.敞口放置后溶液的pH均可能减小C.都能与SO2发生氧化还原反应 D.均具有强氧化性和挥发性
【例6】利用如图装置可以验证NH3和HCl的有关性质。下列有关说法不正确的是( )A.关闭活塞 c,打开活塞 a、b,挤压胶头滴管,Ⅱ 中产生喷泉B.关闭活塞 a,打开活塞 b、c,用热毛巾敷热烧瓶 I,I 中产生喷泉C.关闭活塞 b,打开活塞 a、c,用热毛巾敷热烧瓶 II,一段时间后,打开活塞 b,I、II 中均产生喷泉D.关闭活塞 b,打开活塞 a、c,用热毛巾敷热烧瓶 II,I 中会产生白雾
二、铵盐-----NH4+
绝大多数铵盐是( ) 或( )晶体, 都( )于水。
铵盐是NH4+和酸根离子组成的化合物。
氯化铵【NH4Cl,俗称氯铵】;
常用氮肥有铵态氮肥和尿素【CO(NH2)2 】
硫酸铵【(NH4)2SO4 ,俗称硫铵,又称肥粉】;
硝酸铵【NH4NO3,俗称硝铵、炸药】;
碳酸氢铵【NH4HCO3,俗称碳铵】
绝大多数铵盐都易溶于水,受热易分解,与碱反应会放出氨。
是不是所有铵盐受热分解都产生NH3?
大多数铵盐受热分解产生NH3,但有些例外,如 NH4NO3
硝酸铵受热分解生成的是氮气而不是氨气
加热试管中的氯化铵晶体,没有熔化就直接变成气体,气体在试管上方又变成氯化铵晶体,这个变化是升华过程吗?
【提示】不是。加热氯化铵晶体直接变成气体,是由于氯化铵受热分解成氨气和氯化氢气体;
气体在试管上方又变成氯化铵晶体,是由于氨气和氯化氢气体又反应生成了氯化铵晶体。
铵态氮肥不能和碱性物质混合施用的原因
(1)铵盐溶液与碱液混合,不加热:
(2)铵盐溶液与碱液混合,加热:
向盛有少量NH4CI溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
实验现象:红色石蕊试纸变红。
实验结论:说明反应中有碱性气体产生。
在实验室中,常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
根据上述实验,设计一个检验某白色固体是否为铵盐或者未知溶液中是否含有铵根离子的实验方案。
(1)检验某白色固体是否为铵盐的方法
①少许样品和碱混合于试管中加热,将湿润的紫色石蕊试纸靠近试管口,若试纸变蓝色,则证明样品中含铵盐(NH4+)。
②取少许样品和碱混合于试管中共热,用蘸有浓盐酸的玻璃棒检验产生的气体,若有白烟产生,则证明样品中含铵盐(NH4+)。
(2)检验无色溶液中是否存在NH4+的方法:
将待测物取出少量置于试管中,加入NaOH溶液后,加热,用湿润的红色石蕊试纸在管口检验,若试纸变蓝色,则证明待检物中含铵盐(NH4+)。
图5-13为实验室制取氨的简易装置示意图。请仔细观察实验装置,思考如何检验试管中已收集满氨,如何吸收处理实验中多余的氨。
氯化铵晶体、熟石灰固体
用碱石灰(CaO 与NaOH固体混合物)
向下排空气法,并在试管口塞上棉花
防止NH3和空气对流,保证NH3的纯度。
2.能否采用其他铵盐与强碱反应制取氨气?
受热分解,会爆炸,不安全
与反应时生成块状CaSO4,不利于NH3逸出,且反应后试管难清洗
(NH4)2CO3NH4HCO3
受热分解产生CO2,使收集到的NH3不纯
易吸水结块,且对玻璃腐蚀性较强
3.干燥时,能否用浓硫酸、无水CaCl2 或者P2O5来代替碱石灰干燥氨气?
氨气显碱性,不能用呈酸性的浓硫酸和五氧化二磷进行干燥;
氨气能与氯化钙发生反应生成络合物(CaCl2·8NH3 ),因此也不能使用无水氯化钙来干燥氨气。
4.用于气体发生装置的试管口为什么稍向下倾斜?
避免试管中水蒸气冷凝后形成水珠倒流至试管底部使试管受热不均而炸裂。
5.收集到的氨气如何验满?
(2)蘸有浓盐酸(或浓硝酸)的玻璃棒接近试管口(产生白烟)。
(1)用湿润的红色石蕊试纸(变蓝)
6.多余的氨气需不需要尾气处理?
氨气不能直接排放到空气中,可以用将多余的氨气通入水中进行吸收(要注意放倒吸)
易溶于水的要用防倒吸装置
7.实验室中还可以用哪些方法制氨气?
实验室中能否用如图装置制氧气?
8.实验室中还可以用哪些方法制氨气?
②浓氨水加碱石灰法(NaOH 、CaO )或生石灰:
NH3·H2O+CaO ==== NH3↑+ Ca (OH)2
固体烧碱或生石灰溶于水时放出大量的热,促使 NH3·H2O 分解放出氨气
能,可以用H2O2加MnO2的方法制取氧气
1.如图1为喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )
A、HCl和H2O B、O2和H2O
C、NH3和H2O D、CO2和NaOH
解析:形成喷泉,使烧瓶内外形成较大的压差,要么是气体溶解度比较大、要么是气体可以和烧杯中溶液发生反应。氧气在水中溶液度较小,不能形成喷泉。
①制取并收集NH3 ②吸收NH3 ③检查气密性 ④排空气法收集CO2 A.①③ B.②③ C.①④ D.②④
2.下列装置能达到实验目的的是( )
解析:①氨气密度比空气小,可以采用向下排空气法,但是试管口需要放置棉花;②分液法可以用来吸收氨气;③可以利用压强差检测气密性;④氯气密度比空气大,可以采用向上排空气法,要长进短出。
3.下列不属于铵盐的共同性质是( ) A、加热时一定有氨气生成 B、与碱共热时都产生氨气 C、都是晶体 D、易溶于水
解析:NH4NO3在400 ℃以上分解生成N2、NO2和H2O
4.只用一种试剂,就可区别NH4Cl 、 (NH4)2SO4 、 KCl Na2SO4 、 AlCl3 五种 无色溶液,这种试剂是( ) A、NaOH溶液 B、AgNO3溶液 C、BaCl2溶液 D、Ba(OH)2溶液
A.NaOH溶液溶液和NH4Cl 、 (NH4)2SO4 反应都产生氨气,无法鉴别;和KCl Na2SO4 、不反应,无法鉴别;B.AgNO3溶液和NH4Cl 、 (NH4)2SO4 、 KCl、 Na2SO4 、 AlCl3 均有白色沉淀,无法鉴别;C.BaCl2溶液和(NH4)2SO4、Na2SO4反应都生成白色沉淀;和NH4Cl 、 KCl 、 AlCl3 不反应,不可鉴别;D.Ba(OH) 2溶液和NH4Cl有氨气产生;和(NH4)2SO4有气体和沉淀;和KCl无现象;和Na2SO4有沉淀、和AlCl3四先产生沉淀,沉淀再溶液,现象不同,可以鉴别;
5、下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )
A.只有① B.只有③ C.①③ D.②③
【解析】实验室制备NH3的方法不只一种,除课本介绍的由NH4Cl与碱石灰反应制取之外,其他的只要合理亦可。①装置中NH4Cl加热分解产生的NH3、HCl很容易在管口重新化合成NH4Cl,而无法收集到NH3。③装置在加热时,管口应略向下倾斜,以防止冷凝水倒流使试管底部破裂。
一、氨的结构 和性质
相关课件
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt,共60页。PPT课件主要包含了第二节氮及其化合物,一氮气与氮的固定,二一氧化氮和二氧化氮,三氨和按盐,四硝酸,五酸雨及防治,练习与应用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物图文ppt课件,共1页。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物授课课件ppt,共30页。PPT课件主要包含了化合价,物质类别,氢化物,氧化物,自然固氮,N2的性质,NO的性质,化学性质,NO2的性质,物理性质等内容,欢迎下载使用。









