




所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
高中化学人教版 (2019)必修 第二册第三节 无机非金属材料优秀课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第三节 无机非金属材料优秀课件ppt,共60页。PPT课件主要包含了思考与交流,硅酸盐工业的特点,1原料,2反应条件,3反应原理,4生成物,含硅的物质,硅酸盐,硅酸盐材料,说一说硅酸盐的结构等内容,欢迎下载使用。
同学们想一想这些地标建筑可能会用到哪些材料,
材料是人类赖以生存和发展的物质基础,人类使用的材料除了金属材料,还有无机非金属材料等。从组成上看,许多无机非金属材料含有硅、氧等元素,具有耐高温、抗腐蚀、硬度高等特点,以及特殊的光学、电学等性能。随着工业生产和社会发展对材料性能要求的提高,一批新型无机非金属材料相继诞生,成为航空、航天、信息和新能源等高技术领域必需的材料。
一、传统无机非金属材料
以含硅物质为原料,经加工制得硅酸盐产品的工业称为硅酸盐工业。如制造水泥、玻璃、陶瓷等产品的工业都属硅酸盐工业。
复杂的物理、化学变化。
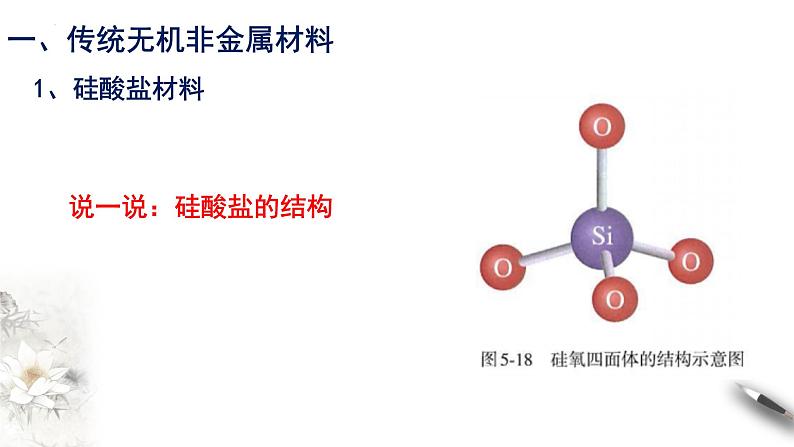
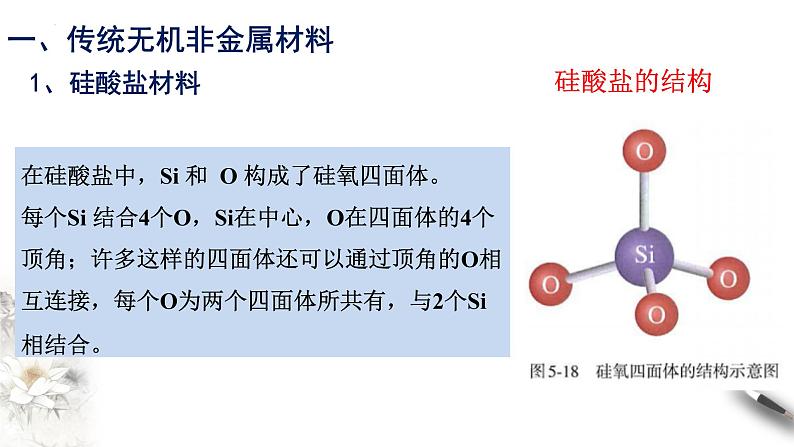
在硅酸盐中,Si 和 O 构成了硅氧四面体。每个Si 结合4个O,Si在中心,O在四面体的4个顶角;许多这样的四面体还可以通过顶角的O相互连接,每个O为两个四面体所共有,与2个Si相结合。
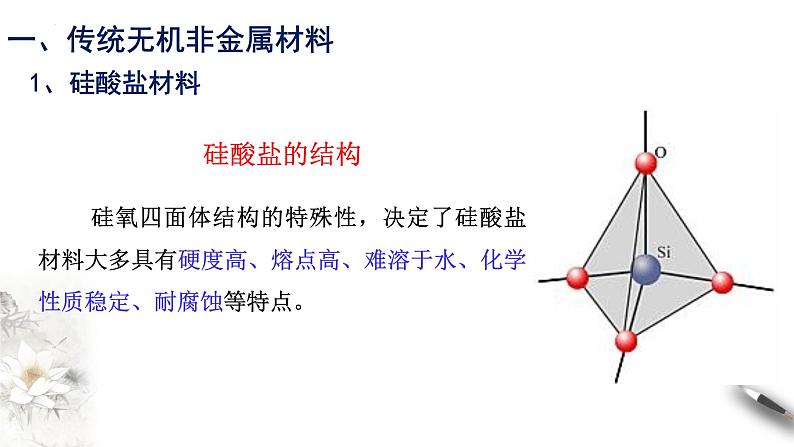
硅氧四面体结构的特殊性,决定了硅酸盐材料大多具有硬度高、熔点高、难溶于水、化学性质稳定、耐腐蚀等特点。
硅酸盐是由硅、氧和金属元素组成的化合物的总称。
硅酸盐是一类结构复杂的物质,一般都不溶于水,化学性质很稳定
(2)硅酸盐的丰富性和复杂性
普通玻璃Na2CaSi6O14
长石 K2Al2Si6O16
石棉Mg3CaSi4O12
黏土Al2Si2H4O9
(3)硅酸盐的表示方法:
①化学式法(表示组成简单的硅酸盐):
如:硅酸钠:Na2SiO3
②氧化物法(表示复杂的硅酸盐):
用二氧化硅和金属氧化物的形式来表示其组成
如:硅酸钠:Na2O · SiO2
硅酸钙: CaO · SiO2
各元素原子总个数比符合原来的组成;
如:CaMg3Si4O12:
CaO·3MgO·4SiO2
Al2(Si2O5)(OH)4:
Al2O3·2SiO2·2H2O
K2O·Al2O3·6SiO2
金属氧化物、二氧化硅、水;
按金属活动顺序表依次排列。
(4)最简单的硅酸盐——Na2SiO3
白色固体,可溶于水,其水溶液俗称水玻璃,有黏性。
多数硅酸盐难溶于水,常见易溶于水的硅酸盐有Na2SiO3、K2SiO3等。
---------易与酸反应。
Na2SiO3+2HCl === 2NaCl+H2SiO3↓
Na2SiO3+CO2+H2O === Na2CO3+H2SiO3↓
Na2SiO3+2CO2+2H2O === 2NaHCO3+H2SiO3↓
③用途:制备硅胶和防火剂的原料
1. Na2SiO3 硅酸钠 ——俗称 泡花碱
2. Na2SiO3 硅酸钠的水溶液 ——俗称水玻璃
3.浓硝酸和浓盐酸以体积比3:1的比例混合而成的溶液,可以使金溶解——王水
口诀:三言(盐)一笑(硝)
硅酸钠溶液加热失水后会变成白色发泡状固体,另外硅酸钠溶液呈碱性
泡花碱不是碱,是盐,但它的水溶液呈碱性。
硅酸是一种白色粉末状的固体,不溶于水。
硅酸是一种难溶于水的弱酸,酸性比碳酸 H2CO3 弱,
①H2SiO3的弱酸性:
酸性太弱,不能使指示剂变色,只能与强碱发生中和反应。
②H2SiO3的不稳定性:
不稳定(比 H2CO3 稳定),受热易分解。
H2SiO3 ==== SiO2 + H2O
我们知道二氧化碳与水反应生成碳酸,但是SiO2不能与水直接化合成H2SiO3,这是一个特例。
SiO2不能直接和水化合成H2SiO3,那怎样制备H2SiO3呢?
③硅酸的制备(强酸制弱酸):
Na2SiO3 + 2HCl === 2NaCl + H2SiO3↓
Na2SiO3 + CO2 + H2O === Na2CO3 + H2SiO3 ↓
注意:如果有特殊注明说是胶体
SiO32- + 2H+ === H2SiO3↓
SiO32- + H2O + CO2 === CO32- + H2SiO3↓
硅胶干燥剂主要有硅胶颗粒组成的,其特点是运用硅胶本身所具有的多个细孔小孔吸附空气中的水分,以达到除湿的目的。而且可以重复使用。
黏土(主要成分为含水的铝硅酸盐)
(Al2O3·2SiO2·2H2O )
反应原理:复杂的物理、化学变化
混合-成型-干燥-烧结-冷却
机场出口处的蓝色玻璃隔离墙
制造玻璃纤维用于高强度复合材料等
Na2SiO3 、CaSiO3、SiO2
主要特性:混合物,无固定的熔点
(Na2CO3、CaCO3、SiO2)
普通玻璃是以纯碱、石灰石和石英砂为原料,经混合、粉碎,在玻璃窑中熔融,发生复杂的物理变化和化学变化而制得。你能写出发生反应的化学方程式吗?
制备玻璃过程的化学方程式为?
1.制造玻璃时发生以下反应:Na2CO3+SiO2 ==== Na2SiO3+CO2↑。该反应能否说明H2SiO3的酸性比H2CO3强?为什么?
提示 不能。SiO2与Na2CO3反应,是在高温下,且生成的产物是CO2气体,可以脱离反应体系,并不能说明H2SiO3酸性强于H2CO3。
强酸制弱酸都是在溶液中进行的
生产中采用不同的原料和工艺,可以制得多种具有不同性能和用途的玻璃。例如,用含有铅的原料制造的光学玻璃,透光性好,折射率高,可以用来制造眼镜、照相机和光学仪器的透镜;加入硼酸盐制成耐化学腐蚀、耐温度急剧变化的玻璃,可用于实验室使用的玻璃仪器;加入一些金属氧化物或盐可以得到彩色玻璃,常用于建筑和装饰。
1.石英玻璃——成分为SiO2,以纯净的石英为主要原料制成。 用途比如化学仪器
2.钢化玻璃——普通玻璃在电炉中加热软化,然后急速冷却而成,机械强度是普通玻璃的4~6倍。用途比如汽车,火车窗玻璃等
3.有色玻璃——普通玻璃中加入一些金属氧化物,如Cu2O:红色玻璃,CuO:蓝绿色玻璃,C2O3:蓝色玻璃,MnO2:紫色玻璃等。
4.光学玻璃——透光性能好,有折光和色散性。用途比如眼镜片,照相机,显微镜,望远镜用凸凹透镜等光学仪器
水泥是最常用的建筑材料下图是1949—1998年我国水泥产量示意图
水泥、沙子和碎石等与水混合
( Al2O3·2SiO2·2H2O 、 CaCO3 )
硅酸二钙(2CaO•SiO2)
铝酸三钙(3CaO•Al2O3)等
硅酸三钙(3CaO•SiO2)、
都在高温下,发生了复杂的物理和化学变化。
玻璃、水泥、陶瓷生产的共同点:
原料都有含硅元素的物质,产品都含有硅酸盐,且都是混合物。
1.传统的硅酸盐材料有什么优、缺点?
2.新型无机非金属材料有哪些特性?
优点:抗腐蚀、耐高温; 缺点:质脆、经不起热冲击。
① 承受高温,强度高。 ② 具有光学特性。③ 具有电学特性。 ④ 具有生物功能。
二、新型无机非金属材料
说一说:根据元素周期表中硅的位置,为什么硅能成为应用最为广泛的半导体材料?
第三周期、第IV A族
请画出碳和硅的原子结构示意图
分析:既不易失去电子,又不易得到电子,主要形成四价的化合物。
Si位于元素周期表第三周期,第ⅣA族,处于金属与非金属过渡位置,为半导体材料
硅在自然界的存在形态:
没有游离态,只有化合态
硅在地壳中含量仅次于氧,居第2位,硅的氧化物和硅酸盐构成了地壳中大部分的岩石、沙子、土壤,约占地壳质量的90%以上。
硅是一种亲氧元素,在自然界它总是与氧相互化合的。
硅单质:灰黑色、有金属光泽、硬而脆的固体,是很好的半导体材料!
Si + 2F2 === SiF4
Si + 2Cl2 ==== SiCl4
Si + O2 ==== SiO2
Si + C ==== SiC
硅在常温下不活泼,加热条件下能与 O2 , Cl2 等反应:
常温下为无色,有毒,有刺激性臭味的气体。
非金属单质一般不与非氧化性酸反应,但 Si 能与 HF 反应:
硅与强碱溶液反应生成氢气:
Si + 4HF === SiF4↑ + 2H2↑
Si + 2NaOH + H2O === Na2SiO3 + 2H2↑
常见单质中能与NaOH溶液反应产生H2的有金属Al,非金属Si。
(4)单质 Si 的制备
在高温下让粗硅(Si)与氯气(Cl2)反应,其产物在高温下被氢气(H2)还原而得到较纯的硅
高纯硅的制备 工业上制备高纯硅,一般需要先制得纯度为98%左右的粗硅,再以其为原料制备高纯硅。例如,可以将粗硅转化为三氯硅烷(SiHCl3),再经氢气还原得到高纯硅。
写一写:根据高纯硅的制备流程,写一写相应的化学方程式。
SiO2+2C ======= Si+2CO
1800~2000℃
Si+3HCl ======= SiHCl3+H2
H2 和 HCl 可以循环利用
2.单质硅在常温下化学性质不活泼,所以硅在自然界中以游离态存在,这种说法是否正确?
提示 错误。硅是一种亲氧元素,在自然界中总是与氧相互化合,以熔点很高的氧化物及硅酸盐的形式存在。所以自然界中无游离态的硅存在。
SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫硅石;结晶的二氧化硅叫石英。
二氧化硅( 硅石 )存在
结晶形(石英晶体)无定形——硅藻土
二氧化硅中没有单个分子,用SiO2来表示二氧化硅的组成,表示Si 原子与O原子个数比为1:2,所以不是分子式而是化学式。
立体网状结构决定了SiO2具有优良的物理和化学性质
SiO2晶体中没有SiO2分子存在,只存在硅氧原子。因此性质稳定
SiO2是不溶于水的固体,熔、沸点高,硬度大。
SiO2虽然不溶于水,但它是一种酸性氧化物
①不溶于水,不能与水反应得到硅酸
②与碱性氧化物反应: 比如与CaO
SiO2 + CaO ==== CaSiO3
③与 NaOH 反应:
SiO2 + 2NaOH === Na2SiO3 + H2O
玻璃成分中含有二氧化硅,易于氢氧化钠溶液反应生成硅酸钠溶液,从而使瓶塞与瓶壁黏合在一起而难以打开。所以盛NaOH溶液的试剂瓶一般是玻璃瓶,橡胶塞。
SiO2 + 4HF === SiF4↑+ 2H2O
除氢氟酸外,SiO2一般不与其他酸反应。
玻璃中含有SiO2 ,所以HF可以用来刻蚀玻璃。
集成电路、晶体管、硅整流器、太阳能电池,计算机芯片等
3、硅和二氧化硅的用途
二氧化硅可用来生产光导纤维。光导纤维的通信容量大,抗干扰性能好,传输的信号不易衰减,能有效提高通信效率。
(2) 二氧化硅的应用
用石英、玛瑙制作饰物。
碳原子和硅原子通过共价键连接
碳化硅(SiC)俗称金刚砂,
几种典型的新型无机非金属材料
①高温结构陶瓷特点:耐高温、耐腐蚀、耐磨蚀、抗氧化等,用于火箭发动机,汽车发动机和高温电极材料,如氮化硅(Si3N4)和碳化硅(SiC--金刚砂)。
②压电陶瓷特点:主要有钛酸盐和锆酸盐,可实现机械能和电能的相互转化,用于滤波器、扬声器、超声波探伤器和但火气等。
③透明陶瓷:氧化铝、氧化钇、氮化铝、氟化钙等类型;特点:耐高温、绝缘性好,用于高压钠灯,激光器和高温探窗。
④超导陶瓷:特点为某临界温度下电阻为0,具有超导性,可用于电力、交通、医疗等。
新 型 陶 瓷 材 料
习惯上把陶瓷(ceramics)分为传统陶瓷和特种陶瓷。传统陶瓷是以粘土、长石、石英等天然矿物为原料经烧结而成的。特种陶瓷是以人工合成的氧化物、氮化物、碳化物、硅化物、硼化物超细微粒为原料特制而成。又称精细陶瓷、精密陶瓷。
碳纳米材料是近年来人们十分关注的一类新型无机非金属材料,主要包括富勒烯、碳纳米管、石墨烯等,在能源、信息、医药等领域有着广阔的应用前景。
富勒烯是由碳原子构成的一系列笼形分子的总称,其中的C60是富勒烯的代表物。C60的发现为纳米科学提供了重要的研究对象,开启了碳纳米材料研究和应用的新时代。
碳纳米管可以看成是由石墨片层卷成的管状物,具有纳米尺度的直径。碳纳米管的比表面积大,有相当高的强度和优良的电学性能,可用于生产复合材料、电池和传感器等。
石墨烯是只有一个碳原子直径厚度的单层石墨,其独特的结构使其电阻率低、热导率高,具有很高的强度。作为一种具有优异性能的新型材料,石墨烯在光电器件、超级电容器、电池和复合材料等方面的应用研究正在不断深入。
富 勒 烯-------笼形分子,以C60为代表.
碳纳米管-------石墨片层管状物,比表面积大,具有高强度和电学性能,用于生产复合材料,电池、传感器。
石 墨 烯-------单层石墨,电阻率低,热导率高,强度高用于光电器元件、超级电容器、电池和复合材料等。
1.下列叙述错误的是( )
A.硅在自然界中主要以单质形式存在 B.硅是应用最广泛的半导体材料
C.高纯度的硅可用于制造计算机芯片 D.二氧化硅可用于生产玻璃
2.有下列物品或设备:①陶瓷餐具②砖瓦③混凝土桥墩④门窗玻璃⑤水晶镜片⑥石英钟⑦水晶项链⑧硅太阳能电池⑨光导纤维⑩计算机芯片(1)使用了硅单质的是______.(用序号填写,下同)(2)使用了SiO2的是_________.(3)使用了硅酸盐材料的是____________.
3.氢氟酸是HF的水溶液,可与SiO2发生反应成SiF4和H2O。请写出该反应的化学方程式。想一想为什么可以用氢氟酸溶蚀玻璃生产磨砂玻璃。
答案:SiO2+4HF=SiF4↑+2H2O。玻璃种含有二氧化硅,所以可以用来制造磨砂玻璃
4.SiO2是一种酸性氧化物,能与强碱溶液反应。例如,SiO2与NaOH反应可生成Na2SiO3。Na2SiO3的水溶液俗称水玻璃,具有黏结力强、耐高温等特性,可以用作粘合剂和防火剂。实验室盛放碱溶液的试剂瓶应使用橡胶塞,而不用玻璃塞。请解释原因,并写出相关反应的化学方程式。
答案:用玻璃塞会导致瓶塞瓶口黏结在一起SiO2+2NaOH=Na2SiO3+H2O
5.氮化硅是一种性能优异的无机非金属材料,它的熔点高,硬度大,
电绝缘性好,化学性质稳定,但生产成本较高。
(1)根据以上描述,氮化硅可能有哪些用途:_____(填字母)
a.制作坩埚 b.用作建筑陶瓷 c.制作耐高温轴承 d.制作切削刀具
(2)请写出氮和硅的原子结构示意图,并根据元素周期律知识,写出氮化硅的化学式。
答案:(1)a,c,d;(2) N: Si: Si3N4
(3)氮化硅在19世纪已经被化学家合成出来,但直到100多年后才逐 渐应用于工业领域。材料的基础研究和实际应用之间存在着一定距 离,你认为二者之间的关系是怎样的?请查阅相关资料,与同学交 流你的观点。
答案:①二者作用是相辅相成的;②基础研究的成果指导着应用研究的进行;③实际需要和应用研究是基础研究的推动力;④应用研究的结果会丰富已有的理论。
相关课件
这是一份高中化学人教版 (2019)必修 第二册第三节 无机非金属材料说课课件ppt,共34页。PPT课件主要包含了问题导入,无机非金属材料,硅酸盐材料,新型无机金属材料,硅酸钠的性质与用途,硅单质,硅的工业制取,分馏蒸馏,新型陶瓷,高温抗氧化性能等内容,欢迎下载使用。
这是一份高中人教版 (2019)第五章 化工生产中的重要非金属元素第三节 无机非金属材料优秀ppt课件,共60页。PPT课件主要包含了第三节无机非金属材料,一硅酸盐材料,二新型无机非金属材料,练习与应用等内容,欢迎下载使用。
这是一份化学人教版 (2019)第三节 无机非金属材料授课课件ppt,共21页。PPT课件主要包含了传统的硅酸盐材料,归纳总结,新型无机非金属材料,硅的化学性质,高纯硅单质的制备,应用及存在,光导纤维光纤,新型陶瓷等内容,欢迎下载使用。










