
浙江省2023_2024学年高二化学上学期10月月考试题含解析
展开选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1. 化学与生产、生活密切联系。下列有关说法错误的是
A. 新冠变异病毒奥密克戎毒株中的蛋白质属于高分子化合物
B. 青蒿素在超临界CO2流体中溶解性很大,提取青蒿素可用其作萃取剂
C. “天宫课堂”过饱和乙酸钠溶液结晶形成温热“冰球”的现象,属于吸热反应
D. 大力推广使用新型节能光源,减少高楼玻璃幕墙的使用,都可有效防治光污染
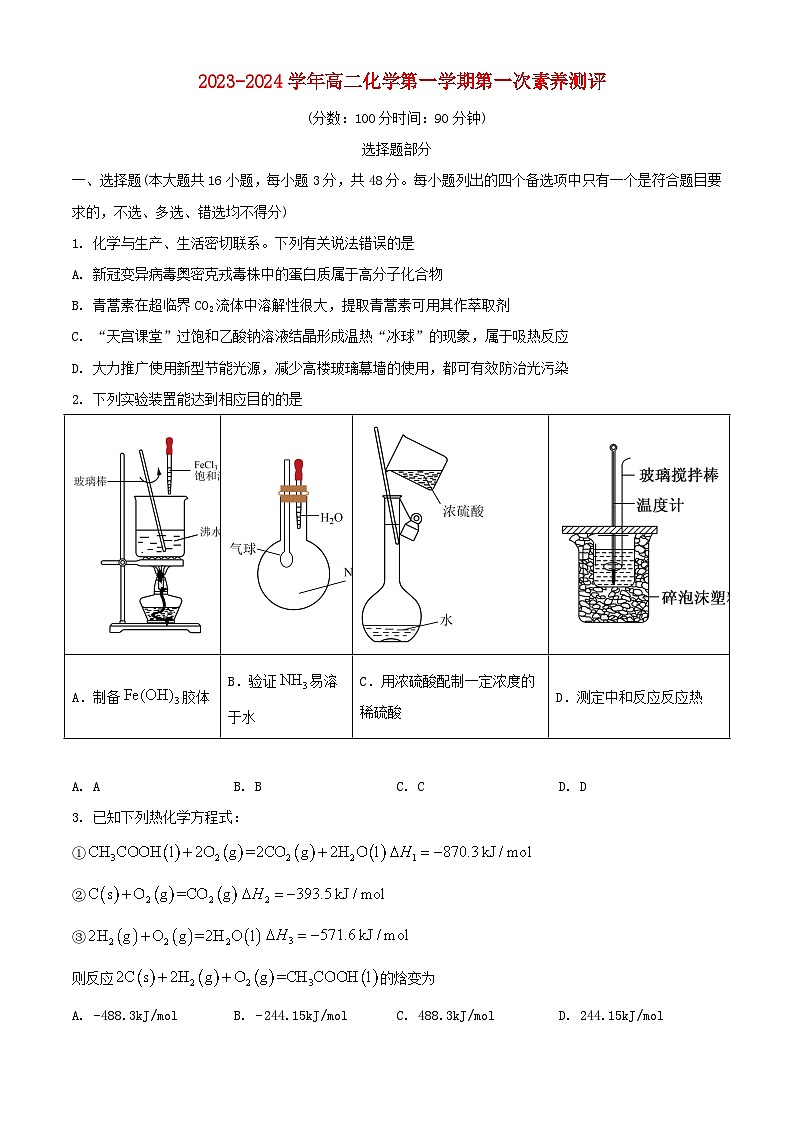
2. 下列实验装置能达到相应目的的是
A. AB. BC. CD. D
3. 已知下列热化学方程式:
①
②
③
则反应的焓变为
A. −488.3kJ/mlB. −244.15kJ/mlC. 488.3kJ/mlD. 244.15kJ/ml
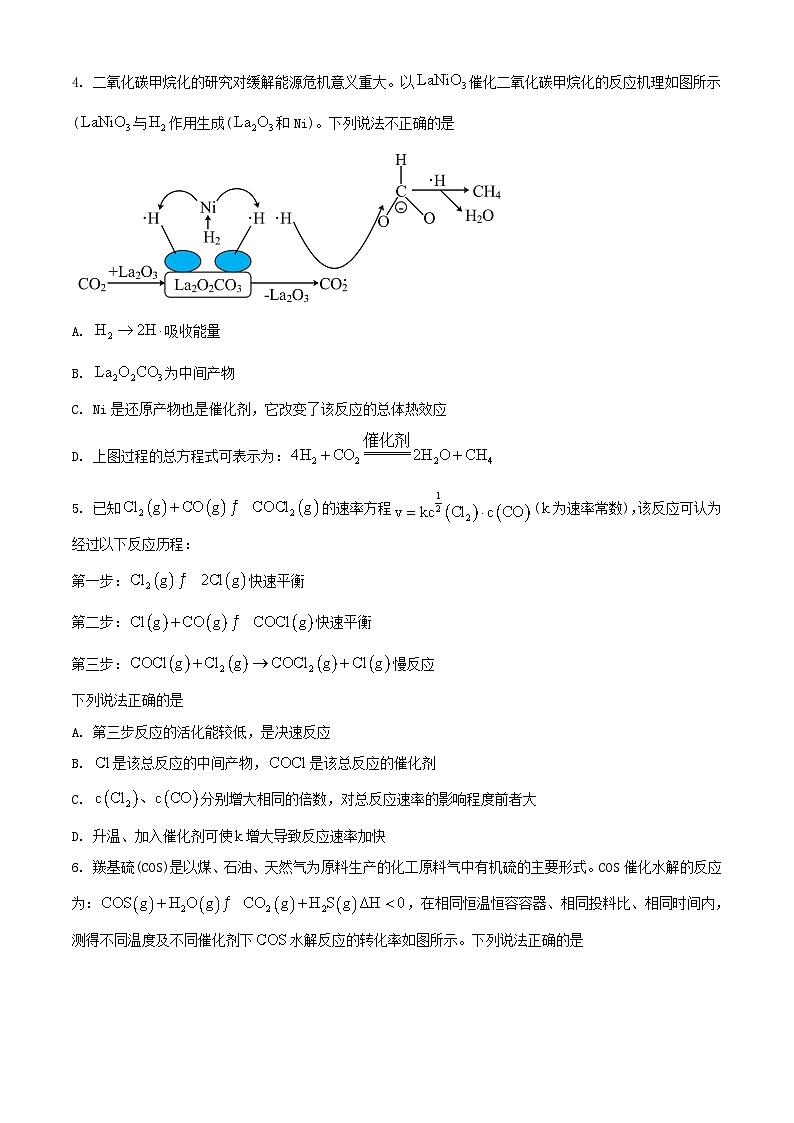
4. 二氧化碳甲烷化的研究对缓解能源危机意义重大。以催化二氧化碳甲烷化的反应机理如图所示(与作用生成(和Ni)。下列说法不正确的是
A. 吸收能量
B. 为中间产物
C. Ni是还原产物也是催化剂,它改变了该反应的总体热效应
D. 上图过程的总方程式可表示为:
5. 已知的速率方程(为速率常数),该反应可认为经过以下反应历程:
第一步:快速平衡
第二步:快速平衡
第三步:慢反应
下列说法正确的是
A. 第三步反应的活化能较低,是决速反应
B. 是该总反应的中间产物,是该总反应的催化剂
C. 分别增大相同的倍数,对总反应速率的影响程度前者大
D. 升温、加入催化剂可使增大导致反应速率加快
6. 羰基硫(COS)是以煤、石油、天然气为原料生产的化工原料气中有机硫的主要形式。COS催化水解的反应为:,在相同恒温恒容容器、相同投料比、相同时间内,测得不同温度及不同催化剂下水解反应的转化率如图所示。下列说法正确的是
A. 以浓度表示的该段时间内平均反应速率:
B. 线段上的点均是平衡点,点较点转化率降低的原因是平衡移动
C. 任何温度下,的催化效果都比好
D. 时,相较于,使用做催化剂,达平衡时的体积分数更大
7. 密闭容器中发生反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是
A. 时刻改变条件为升温
B. 时刻改变条件为使用催化剂
C. 的百分含量最高的时间段是
D. 时刻从反应体系中分离出部分,、立刻减小,且
8. 下列操作或现象可以用勒夏特列原理解释的是
A. 红棕色加压后颜色变深B. 用排饱和食盐水法收集氯气
C. 合成氨使用铁触媒催化剂D. 钢铁在潮湿的空气中易生锈
9. 对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
A. ①压强对反应的影响
B. ②温度对反应的影响
C. ③恒容平衡体系增加c(N2)对反应的影响
D. ④催化剂对反应的影响
10. 钠和氧气反应生成氧化钠的能量关系如左下图所示。下列说法正确的是
A.
B. ,则
C. 已知的结构如右下图所示,,则的数值等于S-S键能
D. 若,则与生成的反应在低温下自发
11. 压强一定的条件下,将和按一定流速通过装有催化剂的反应管,利用催化加氢制乙二醇。主要发生如下反应:
ⅰ.
ⅱ.
测得的转化率及的选择性与温度的关系如图所示。已知:选择性定义为。下列说法正确的是
A. 曲线表示转化率随温度变化曲线
B. 范围内,选择性随温度升高而增大
C. 保持其他条件不变,加快气体的流速可以提高的转化率
D. 时,生成的物质的量为
12. 肼(N2H4)又称联氨,为二元弱碱,在水中的电离与氨类似。已知常温下,N2H4第一步电离平衡N2H4+H2O+OH-,Kb1=8.7×10-7。下列说法错误的是
A. N2H4的水溶液中存在:c()+2c()+c(H+)=c(OH-)
B. 反应 N2H4+H+的平衡常数K=8.7×107
C. 联氨与硫酸形成酸式盐的化学式为N2H5HSO4
D. 向N2H4的水溶液中加水,不变
13. 某化学研究小组制备硫酸亚铁铵晶体并测定其纯度。
实验步骤如下:
①铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入溶液,加热、过滤、洗涤、干燥、称量,铁屑质量为。
②的制备。在盛有洗净铁屑的锥形瓶中加入一定量的稀硫酸,充分反应,过滤,收集滤液于蒸发皿中。将锥形瓶和滤纸上的铁屑收集干燥后称重,质量为。
③硫酸亚铁铵晶体的制备,按反应配比准确称取所需质量为的加入“步骤②”中的蒸发皿中,在水浴上蒸发混合液,浓缩至表面出现晶膜为止,静置,让溶液自然冷却至室温减压过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量为。
④测定硫酸亚铁铵晶体的纯度。称取产品,配制成溶液,取出置于锥形瓶中,用标准溶液滴定(不考虑杂质的反应),重复三次,平均消耗标准溶液。
对于上述实验,下列说法正确的是
A. 减压过滤时,布氏漏斗颈的斜口背向吸滤瓶支管口
B. 检漏时,关闭酸式滴定管旋塞,加水至最高标线,置于滴定管架上,若不漏水即可使用
C. 酸式滴定管排气泡的操作为将滴定管倾斜,迅速打开旋塞使溶液冲出
D. 滴定时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛观察滴定管内液面变化
14. 某同学拟用计测定溶液以探究某酸是否为弱电解质。下列说法正确的是
A. 时,若测得溶液,则是弱酸
B. 时,若测得溶液且,则是弱酸
C. 时,若测得溶液,取该溶液,加蒸馏水稀释至,测得,则是弱酸
D. 时,若测得溶液,取该溶液,升温至,测得,若是弱酸,则
15. 常温下,浓度均为、体积均为的两种一元酸HX、HY的溶液中,分别加入固体,随加入的物质的量的变化如图所示。下列叙述正确的是
A. HX的酸性弱于HY
B. a点由水电离出的
C. b点时酸碱恰好完全反应
D. b点溶液中的小于c点溶液
16. 探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
A. AB. BC. CD. D
非选择题部分
17. 化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)生活中的冷敷袋是利用_______(填“放热”或“吸热”)的化学变化或物理变化。
(2)图Ⅰ是1mlNO2(g)和1mlCO(g)反应生成CO2和NO过程中能量变化示意图,正向反应的活化能为_______,ΔH=_______。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+490 kJ·ml-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·ml-1
又已知③H2O(g)=H2O(l) ΔH=-44 kJ·ml-1,则表示甲醇燃烧热的热化学方程式为:_______。
(4)下表是部分化学键的键能数据:
已知1ml白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=_______kJ·ml-1(用含有a、b、c、d的代数式表示)。
(5)已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应∆H=_______。
(6)已知:H2和C3H8的燃烧热分别为285.8kJ·ml-1和2219.9kJ·ml-1,在25℃和101kPa,H2和C3H8的混合气体5ml完全燃烧生成CO2和液态水,放出6264.2kJ的热量。则混合气体中H2和C3H8的体积比是_______。
18. 实验室利用甲苯(,代表苯基)为原料制备苯甲酸。
Ⅰ.制备原理:
氧化:
酸化:
Ⅱ.实验流程及步骤:
Ⅲ.步骤①的装置如图甲:
Ⅳ.相关数据:
(1)苯甲酸相对分子质量:122
(2)苯甲酸在水中的溶解度水:0.34(25℃)、0.85(50℃)、2.2(75℃)。
请回答:
(1)步骤③的操作名称是_____。步骤④热水洗涤的目的是_____。
(2)有关实验流程Ⅱ步骤,下列说法正确的是_____。
A. 图甲装置中,冷凝管进水口为1
B. 图甲球形冷凝管的内芯管为球泡状,冷却面积大,可用于蒸馏实验
C. 图甲控制反应温度,以蒸气上升至内芯管下端为宜
D. 步骤⑧粗苯甲酸晶体的提纯可采用重结晶的方法
(3)步骤②中,除去多余反应的离子方程式为_____。
(4)用碱滴定法测纯度:称取产品,配成乙醇溶液,取溶液于锥形瓶中,滴加2~3滴酚酞试液,然后用溶液滴定,重复操作三次,到达滴定终点时消耗溶液分别为,。
①下列说法正确的是_____。
A.为防止酸式滴定管漏液,应将适量凡士林涂在如图中旋塞的a端和旋塞套内的c端
B.将溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.润洗滴定管时,待液体润湿全部滴定管内壁后,应将液体从滴定管上口倒入预置的烧杯中
D.接近终点时,需用蒸馏水冲洗锥形瓶壁和滴定管尖端悬挂的液滴
E.若滴定前滴定管尖嘴部分气泡未赶走,滴定后气泡消失,则测定结果偏高
②产品苯甲酸的纯度为_____。
19. 的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用与催化合成甲醇,相关反应如下:
请回答下列问题:
(1)___________(用含、的代数式表示)。
(2)已知平衡常数、、随温度变化的曲线如图所示:
①___________0(填“>”或“<”),判断依据为___________。
②___________(填“>”“<”或“=”)。
(3)一定温度下,向2 L的恒容密闭容器中充入3 ml 和1 ml ,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍,的平衡转化率为80%。
①0~10min内用表示的平均反应速率___________。
②平衡时___________。该温度下反应ⅱ的化学平衡常数___________。
(4)在催化剂作用下,向某密闭容器中按投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是___________。
20. 化学能与热能在生产生活中扮演者重要的角色,按照要求回答下列各题。
I、键能、焓变及热化学方程式相关考点:
(1)已知拆开1mlH-H键、1mlI-I键、1mlH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1ml氢气和1ml碘反应生成HI会___________(填“放出”或“吸收”)___________kJ的热量。
(2)1gH2燃烧生成液态水,放出142.9kJ热量,该反应的热化方程式为:___________。
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mL-1;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·mL-1;H2O(g)=H2O(l) ΔH=-44.0KJ·mL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式___________
II、中和热的测定
50mL0.55ml·L-1盐酸与50mL0.50ml·L-1NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(4)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是___________。
(5)烧杯间填满碎纸条的作用是___________。
(6)若大烧杯上不盖硬纸板,求得的中和热___________(填“偏大”“偏小”或“无影响”)。
(7)实验中若改用60mL0.50ml·L-1盐酸跟50mL0.55ml·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同)___________(填“相等”或“不相等”),所求中和热___________(填“相等”或“不相等”)。
(8)仍按50mL0.55ml·L-1盐酸与50mL0.50ml·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃,②3.5℃,③3.3℃,④3.4℃,则最终代入计算式的温差均值应该为___________℃。已知溶液的比热容4.18J/(g·℃),密度为1g/mL。计算所得中和热ΔH=___________kJ/ml(计算结果保留一位小数)。
21. 现有下列物质:①熔融的NaCl;②稀硫酸;③液氯;④冰醋酸;⑤铜;⑥BaSO4;⑦NaHSO4;⑧液氨;⑨SO2;⑩Cu(OH)2固体。请按要求回答下列问题。
(1)以上物质中属于弱电解质的是___________(填序号,下同):属于非电解质的是___________。
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:
①t1温度时,若盐酸中,则由水电离产生的___________。
②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=___________。
(3)①已知25℃,NH3·H2O的,的。亚硫酸电离常数为,改变亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,___________。
②将SO2通入氨水中,当降至时,溶液中的___________,
③将少量SO2通入NaNO2溶液发生反应的离子方程式为___________。浙江省舟山中学2023-2024学年高二第一学期第一次化学素养测评
(分数:100分时间:90分钟)
选择题部分
一、选择题(本大题共16小题,每小题3分,共48分。每小题列出的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分)
1. 化学与生产、生活密切联系。下列有关说法错误的是
A. 新冠变异病毒奥密克戎毒株中的蛋白质属于高分子化合物
B. 青蒿素在超临界CO2流体中溶解性很大,提取青蒿素可用其作萃取剂
C. “天宫课堂”过饱和乙酸钠溶液结晶形成温热“冰球”的现象,属于吸热反应
D. 大力推广使用新型节能光源,减少高楼玻璃幕墙的使用,都可有效防治光污染
【答案】C
【解析】
【详解】A.蛋白质的相对分子质量在10000以上,属于高分子化合物,故A正确;
B.青蒿素在超临界CO2中有很强的溶解性,则青蒿素可溶于超临界CO2,则萃取青蒿素可用超临界CO2作萃取剂,故B正确;
C.过饱和乙酸钠溶液结晶形成温热“冰球”的现象,属于放热过程,故C错误;
D.大力推广使用新型节能光源,都可减少不合理的光照,故D正确;
故选C。
2. 下列实验装置能达到相应目的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.制取胶体时,不能用玻璃棒搅拌,因为搅拌容易使胶体微粒形成大颗粒沉淀析出,故A错误;
B.向圆底烧瓶中滴入水,烧瓶中的氨气溶于水导致气压减小,气球变大,该装置可以验证易溶于水,故B正确;
C.用浓硫酸配制一定浓度的稀硫酸实验中,不能再容量瓶中稀释浓硫酸,故C错误;
D.测定中和反应反应热实验中,大烧杯中碎泡沫应该充满整个烧杯,故D错误;
故选B。
3. 已知下列热化学方程式:
①
②
③
则反应的焓变为
A. −488.3kJ/mlB. −244.15kJ/mlC. 488.3kJ/mlD. 244.15kJ/ml
【答案】A
【解析】
【详解】根据盖斯定律②的二倍加上③,再减去①得到反应的焓变为;
综上所述,答案为A。
4. 二氧化碳甲烷化的研究对缓解能源危机意义重大。以催化二氧化碳甲烷化的反应机理如图所示(与作用生成(和Ni)。下列说法不正确的是
A. 吸收能量
B. 为中间产物
C. Ni是还原产物也是催化剂,它改变了该反应的总体热效应
D. 上图过程的总方程式可表示为:
【答案】C
【解析】
【详解】A.为断键过程,吸收能量,A正确;
B.由图中反应可知,生成又被消耗,为中间产物,B正确;
C.催化剂可以降低反应的活化能,但不能改变该反应的总体热效应,C错误;
D.上图过程的总反应为氢气和二氧化碳在催化剂作用下生成水和甲烷,方程式可表示为:,D正确;
故选C。
5. 已知的速率方程(为速率常数),该反应可认为经过以下反应历程:
第一步:快速平衡
第二步:快速平衡
第三步:慢反应
下列说法正确的是
A. 第三步反应的活化能较低,是决速反应
B. 是该总反应的中间产物,是该总反应的催化剂
C. 分别增大相同的倍数,对总反应速率的影响程度前者大
D. 升温、加入催化剂可使增大导致反应速率加快
【答案】D
【解析】
【详解】A.第三步反应反应速率较小,则反应的活化能较大,总反应的速率主要取决于第三步反应,第三步反应是决速反应,故A错误;
B.Cl和COCl是该总反应的中间产物,但没有出现在第一个反应的反应物中,COCl不是该总反应的催化剂,故B错误;
C.从速率方程中可以看出,c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度c(CO)大,故C错误;
D.升温、加入催化剂可以提高反应物中活化分子的百分数,使增大导致反应速率加快,故D正确。
故选D。
6. 羰基硫(COS)是以煤、石油、天然气为原料生产的化工原料气中有机硫的主要形式。COS催化水解的反应为:,在相同恒温恒容容器、相同投料比、相同时间内,测得不同温度及不同催化剂下水解反应的转化率如图所示。下列说法正确的是
A. 以浓度表示的该段时间内平均反应速率:
B. 线段上的点均是平衡点,点较点转化率降低的原因是平衡移动
C. 任何温度下,的催化效果都比好
D. 时,相较于,使用做催化剂,达平衡时的体积分数更大
【答案】A
【解析】
【详解】A.相同时间内COS的转化率越大催化效率越高,正反应的平均反应速率:,A正确;
B.由图可知,相同温度下由TiO2做催化剂时转化率高于N点,可知N点并未达到平衡状态,B错误;
C.低温时对COS水解反应的催化效果好,C错误;
D.催化剂不改变平衡移动,在相同温度下,无论用哪种催化剂,达到平衡时的体积分数都一样,D错误;
故选A。
7. 密闭容器中发生反应,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。下列说法错误的是
A. 时刻改变的条件为升温
B. 时刻改变的条件为使用催化剂
C. 的百分含量最高的时间段是
D. 时刻从反应体系中分离出部分,、立刻减小,且
【答案】D
【解析】
【详解】A.时刻改变条件后正逆反应速率都加快,平衡逆向移动,说明是升高温度,故A正确;
B.该反应是体积减小的反应,时刻改变条件后正逆反应速率都加快,平衡不移动,则改变的条件为使用催化剂,故B正确;
C.t1时刻后平衡逆向移动,三氧化硫的百分含量减小,t3时刻后平衡不移动,三氧化硫的百分含量与t1时刻、t2时刻相等,t4时刻后平衡逆向移动,三氧化硫的百分含量减小,则的百分含量最高的时间段是,故C正确;
D.时刻从反应体系中分离出部分,三氧化硫物质的量浓度减小,此时刻不变,立刻减小,平衡正向移动即,故D错误。
综上所述,答案为D。
8. 下列操作或现象可以用勒夏特列原理解释的是
A. 红棕色加压后颜色变深B. 用排饱和食盐水法收集氯气
C. 合成氨使用铁触媒催化剂D. 钢铁在潮湿的空气中易生锈
【答案】B
【解析】
【详解】A.增大压强一半是通过压缩体积来实现的,体积减小,浓度变大,所以颜色变深,A错误;
B.氯气能够溶于水,存在,饱和食盐水中含有大量氯离子,促使平衡逆向移动,降低氯气在食盐水中的溶解度,可以用勒夏特列原理解释,B正确;
C.催化剂只改变反应速率,不能使平衡发生移动,C错误;
D.钢铁在潮湿的空气中容易生锈,是因为形成原电池,发生电化学腐蚀,与勒夏特列原理无关,D错误;
故选B。
9. 对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
A. ①压强对反应的影响
B. ②温度对反应的影响
C. ③恒容平衡体系增加c(N2)对反应的影响
D. ④催化剂对反应的影响
【答案】C
【解析】
【详解】A.增大压强,合成氨的化学反应速率加快,化学平衡正向移动,根据图示知道压强应该是p2
C.增加反应物的浓度,化学平衡向着正反应方向移动,正反应速率大于逆反应速率,故C正确;
D.加入催化剂可以加快反应速率,缩短达到平衡的时间,但是不会引起平衡的移动,D错误;
故本题选C。
10. 钠和氧气反应生成氧化钠的能量关系如左下图所示。下列说法正确的是
A.
B. ,则
C. 已知的结构如右下图所示,,则的数值等于S-S键能
D. 若,则与生成的反应在低温下自发
【答案】D
【解析】
【详解】A.根据盖斯定律,ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5,故A错误;
B.K比Na更容易失去电子,因此ΔH3′<ΔH3,故B错误;
C.已知S8的结构如图2所示,,则ΔH2′的数值等于S-S键能的2倍,故C错误;
D.已知:①4Na(s)+O2(g)═2Na2O(s) ΔH,②4Na(s)+2O2(g)═2Na2O2(s) ΔH′,根据盖斯定律②-①得反应2Na2O(s)+O2(g)═2Na2O2(s)ΔH1=ΔH′-ΔH<0,ΔS<0,低温时ΔG=ΔH1-TΔS<0,因此与生成的反应在低温下自发,故D正确;
答案准D。
11. 压强一定的条件下,将和按一定流速通过装有催化剂的反应管,利用催化加氢制乙二醇。主要发生如下反应:
ⅰ.
ⅱ.
测得的转化率及的选择性与温度的关系如图所示。已知:选择性定义为。下列说法正确的是
A. 曲线表示的转化率随温度变化曲线
B. 范围内,的选择性随温度升高而增大
C. 保持其他条件不变,加快气体的流速可以提高的转化率
D. 时,生成的物质的量为
【答案】D
【解析】
【详解】A.根据题意,随着温度升高,反应ⅰ、ⅱ均正向移动,的转化率增大,故曲线代表的转化率随温度变化曲线,A错误;
B.曲线是的选择性,时曲线与曲线相交,则曲线是的选择性,根据图像,范围内,的选择性随温度升高而减小,B错误;
C.加快气体的流速时,气体来不及在催化剂表面反应,的转化率会降低,C错误;
D.时的转化率为,即转化的,由图像知,时和的选择性相等,则,此时,D正确;
故选D。
12. 肼(N2H4)又称联氨,为二元弱碱,在水中的电离与氨类似。已知常温下,N2H4第一步电离平衡N2H4+H2O+OH-,Kb1=8.7×10-7。下列说法错误的是
A. N2H4的水溶液中存在:c()+2c()+c(H+)=c(OH-)
B. 反应 N2H4+H+的平衡常数K=8.7×107
C. 联氨与硫酸形成酸式盐的化学式为N2H5HSO4
D. 向N2H4的水溶液中加水,不变
【答案】C
【解析】
【详解】A.根据电荷守恒可知在N2H4的水溶液中存在:c()+2c()+c(H+)=c(OH-),A正确;
B.反应 N2H4+H+的平衡常数K==8.7×107,B正确;
C.联氨是二元弱碱,其与硫酸形成酸式盐的化学式为(N2H6)(HSO4)2,C错误;
D.温度不变电离平衡常数不变,加水稀释N2H4的水溶液中,×不变,D正确;故合理选项是C。
13. 某化学研究小组制备硫酸亚铁铵晶体并测定其纯度。
实验步骤如下:
①铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入溶液,加热、过滤、洗涤、干燥、称量,铁屑质量为。
②的制备。在盛有洗净铁屑的锥形瓶中加入一定量的稀硫酸,充分反应,过滤,收集滤液于蒸发皿中。将锥形瓶和滤纸上的铁屑收集干燥后称重,质量为。
③硫酸亚铁铵晶体的制备,按反应配比准确称取所需质量为的加入“步骤②”中的蒸发皿中,在水浴上蒸发混合液,浓缩至表面出现晶膜为止,静置,让溶液自然冷却至室温减压过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量为。
④测定硫酸亚铁铵晶体的纯度。称取产品,配制成溶液,取出置于锥形瓶中,用标准溶液滴定(不考虑杂质的反应),重复三次,平均消耗标准溶液。
对于上述实验,下列说法正确的是
A. 减压过滤时,布氏漏斗颈的斜口背向吸滤瓶支管口
B. 检漏时,关闭酸式滴定管旋塞,加水至最高标线,置于滴定管架上,若不漏水即可使用
C. 酸式滴定管排气泡的操作为将滴定管倾斜,迅速打开旋塞使溶液冲出
D. 滴定时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛观察滴定管内液面变化
【答案】C
【解析】
【详解】A.减压过滤时,布氏漏斗管下方的斜口要对着吸滤瓶的支管口,A错误;
B.对于酸管,先关闭活塞,装水至“0”线以上,直立约2 min,仔细观察有无水滴滴下,然后将活塞转180°,再直立2 min,观察有无水滴滴下;对碱管,装水后直立2 min,观察是否漏水即可,B错误;
C.将滴定管倾斜,迅速打开旋塞使溶液冲出,可以排出酸式滴定管气泡,C正确;
D.滴定时,左手控制酸式滴定管活塞,右手振荡锥形瓶,眼睛观察锥形瓶内溶液颜色的变化,D错误;
故选C。
14. 某同学拟用计测定溶液以探究某酸是否为弱电解质。下列说法正确的是
A. 时,若测得溶液,则是弱酸
B. 时,若测得溶液且,则是弱酸
C. 时,若测得溶液,取该溶液,加蒸馏水稀释至,测得,则是弱酸
D. 时,若测得溶液,取该溶液,升温至,测得,若是弱酸,则
【答案】B
【解析】
【详解】A.时,若测得溶液,则为强酸,A项错误;
B.时,若测得溶液且,可知溶液中,所以未完全电离,为弱酸,B项正确;
C.假设为强酸,取的该溶液,加蒸馏水稀释至测得此时溶液,C项错误;
D.若为弱酸,升温至,促进弱酸的电离,增大,减小,则,D项错误。
故选B。
15. 常温下,浓度均为、体积均为的两种一元酸HX、HY的溶液中,分别加入固体,随加入的物质的量的变化如图所示。下列叙述正确的是
A. HX的酸性弱于HY
B. a点由水电离出的
C. b点时酸碱恰好完全反应
D. b点溶液中的小于c点溶液
【答案】B
【解析】
【详解】A.未加氢氧化钠时,相同浓度溶液中,HX的=12,而HY的<9,由于c(H+)×c(OH-)=Kw,则HX溶液中氢离子浓度更大,故HX的酸性强于HY,故A错误;
B.a点溶液=12,结合c(H+)c(OH-)=10-14,可知c(OH-)=10-131ml/L,酸性溶液中水电离出的c(H+)等于溶液中c(OH-),即a点由水电离出的c(H+)=10-13ml∙L-1,故B正确;
C.HY为0.01ml,b点进入NaOH为0.008ml,二者按物质的量1:1反应,故HY有剩余,故C错误;
D.只受温度影响,b点和c点温度相等,相等,故D错误;
故选B。
16. 探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
A. AB. BC. CD. D
【答案】A
【解析】
【详解】A.向碘的四氯化碳溶液中加入等体积浓溶液,振荡,静置,溶液分层,下层由紫红色变为浅粉红色,上层呈棕黄色,说明碘的四氯化碳溶液中的与溶液中反应生成使上层溶液呈棕黄色,证明碘在浓溶液中的溶解能力大于在四氯化碳中的溶解能力,故A正确;
B.溶液具有强氧化性,能使有机色质漂白褪色,无法用试纸测定溶液的,故B错误;
C.溶液变血红色的原因,Fe3++3SCN-=Fe(SCN)3,与硫酸根离子和钾离子无关,加入少量固体对平衡体系无影响,故C错误;
D.新制氯水中的和都能与溶液反应生成使淀粉变蓝色的碘单质,则溶液变蓝色不能说明溶液中存在,无法证明氯气与水的反应存在限度,故D错误;
故答案选A。
非选择题部分
17. 化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)生活中的冷敷袋是利用_______(填“放热”或“吸热”)的化学变化或物理变化。
(2)图Ⅰ是1mlNO2(g)和1mlCO(g)反应生成CO2和NO过程中能量变化示意图,正向反应的活化能为_______,ΔH=_______。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·ml-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·ml-1
又已知③H2O(g)=H2O(l) ΔH=-44 kJ·ml-1,则表示甲醇燃烧热的热化学方程式为:_______。
(4)下表是部分化学键的键能数据:
已知1ml白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=_______kJ·ml-1(用含有a、b、c、d的代数式表示)。
(5)已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应∆H=_______。
(6)已知:H2和C3H8的燃烧热分别为285.8kJ·ml-1和2219.9kJ·ml-1,在25℃和101kPa,H2和C3H8的混合气体5ml完全燃烧生成CO2和液态水,放出6264.2kJ的热量。则混合气体中H2和C3H8的体积比是_______。
【答案】(1)吸热 (2) ①. 134kJ·ml-1 ②. -234 kJ·ml-1
(3)CH3OH(g)+O2(g)=CO2(g)+2H2O(l)ΔH=-7647 kJ·ml-1
(4)
(5)(EC+ED)—(EA+EB)
(6)1:1
【解析】
小问1详解】
冷敷袋是利用吸热,使周围温度降低;
故答案为:吸热;
【小问2详解】
正反应活化能为反应物到过渡态吸收的能量E1;焓变=E1-E2=134kJ/ml-368kJ/ml=-234kJ/ml
故答案为:134kJ·ml-1;-234 kJ·ml-1;
【小问3详解】
根据盖斯定律及燃烧热方程式要求,,则甲醇燃烧热的热化学方程式为;
故答案为:;
【小问4详解】
根据,1ml白磷完全燃烧需要断裂6mlP-P、5mlO=O、形成12mlP-O、4mlP=O,所以,;
故答案为:;
【小问5详解】
∆H=生成物总能量-反应物总能量=(EC+ED)—(EA+EB);
故答案为:(EC+ED)—(EA+EB);
【小问6详解】
假设混合气体中H2的物质的量为aml,C3H8的物质的量为(5-a)ml,则285.8a+2219.9(5-a)=6264.2,a=2.5ml,则温度压强相同下,H2和C3H8的物质的量为2.5ml,体积比为1:1;
故答案为:1:1。
18. 实验室利用甲苯(,代表苯基)为原料制备苯甲酸。
Ⅰ.制备原理:
氧化:
酸化:
Ⅱ.实验流程及步骤:
Ⅲ.步骤①的装置如图甲:
Ⅳ.相关数据:
(1)苯甲酸相对分子质量:122
(2)苯甲酸在水中的溶解度水:0.34(25℃)、0.85(50℃)、2.2(75℃)。
请回答:
(1)步骤③的操作名称是_____。步骤④热水洗涤的目的是_____。
(2)有关实验流程Ⅱ步骤,下列说法正确的是_____。
A. 图甲装置中,冷凝管进水口为1
B. 图甲球形冷凝管的内芯管为球泡状,冷却面积大,可用于蒸馏实验
C. 图甲控制反应温度,以蒸气上升至内芯管下端为宜
D. 步骤⑧粗苯甲酸晶体的提纯可采用重结晶的方法
(3)步骤②中,除去多余反应的离子方程式为_____。
(4)用碱滴定法测纯度:称取产品,配成乙醇溶液,取溶液于锥形瓶中,滴加2~3滴酚酞试液,然后用溶液滴定,重复操作三次,到达滴定终点时消耗溶液分别为,。
①下列说法正确的是_____。
A.为防止酸式滴定管漏液,应将适量凡士林涂在如图中旋塞的a端和旋塞套内的c端
B.将溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
C.润洗滴定管时,待液体润湿全部滴定管内壁后,应将液体从滴定管上口倒入预置的烧杯中
D.接近终点时,需用蒸馏水冲洗锥形瓶壁和滴定管尖端悬挂的液滴
E.若滴定前滴定管尖嘴部分气泡未赶走,滴定后气泡消失,则测定结果偏高
②产品苯甲酸的纯度为_____。
【答案】(1) ①. 趁热过滤 ②. 把苯甲酸钾洗出来,减少损失,提高产率 (2)CD
(3)
(4) ①. AE ②. 92.00%
【解析】
【分析】甲苯和高锰酸钾加入到水中,不断搅拌,加热回流2h,充分反应后,用饱和亚硫酸氢钠溶液将剩余的高锰酸钾溶液反应,趁热过滤,热水洗涤,将洗涤液加入盐酸,将苯甲酸钾变为苯甲酸,冷却结晶、过滤,用冷水洗涤,减少苯甲酸溶解,得到粗苯甲酸,再重结晶得到产品;
【小问1详解】
步骤③的操作名称是趁热过滤,热水洗涤,得到滤液;步骤④热水洗涤的目的是把苯甲酸钾洗出来,减少损失,提高产率;答案为趁热过滤;把苯甲酸钾洗出来,减少损失,提高产率;
【小问2详解】
A.图甲装置中冷凝管水流方向是"下进上出",因此进水口为2,选项A错误;
B.蒸馏实验常用直形冷凝管冷凝,球形冷凝管的内芯管为球泡状,冷却面积大,常用于冷凝回流,选项B错误;
C.控制反应温度,以蒸气上升至内芯管下端为宜,选项C正确;
D.步骤⑧粗苯甲酸晶体的溶解度在室温下较小、且随温度变化较明显,提纯可采用重结晶的方法,选项D正确;
答案选CD;
【小问3详解】
步骤②中,除去多余时亚硫酸氢根离子在碱性条件下将其还原为二氧化锰,同时被氧化为硫酸根离子,反应的离子方程式为;
【小问4详解】
A.为防止酸式滴定管漏液,应将适量凡士林涂在如图中旋塞的a端和旋塞套内的c端,选项A正确;
B.直接将待装溶液装入滴定管,不应借助烧杯、漏斗转移,选项B错误;
C.润洗酸式滴定管时,加少量待装液,倾斜着转动滴定管,使液体润湿全部滴定管内壁,可尽量将蒸馏水除去,然后轻轻转动控制活塞,将液体从滴定管下部放入预置的烧杯中,选项C错误;
D.接近终点时,需用蒸馏水冲洗锥形瓶壁的液滴,减小误差,但不能用蒸馏水冲洗滴定管尖端悬挂的液滴,溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,选项D错误;
E.若滴定前滴定管尖嘴部分气泡未赶走,滴定后气泡消失,读数偏大,则测定结果偏高,选项E正确;
答案选AE;
到达滴定终点时消耗溶液分别为,,其中第二个数据相差太大,舍去,平均消耗体积为23.00mL,根据题意和关系式苯甲酸~KOH,产品中苯甲酸的物质的量为0.1000 ml/L0.023L4=9.2×10-3ml,则产品中苯甲酸的纯度为×100%= 92.00%;故答案为:92.00%。
19. 的资源化利用能有效助力“碳中和”和“碳达峰”,工业上用与催化合成甲醇,相关反应如下:
请回答下列问题:
(1)___________(用含、的代数式表示)。
(2)已知平衡常数、、随温度变化的曲线如图所示:
①___________0(填“>”或“<”),判断依据为___________。
②___________(填“>”“<”或“=”)。
(3)一定温度下,向2 L的恒容密闭容器中充入3 ml 和1 ml ,只发生反应ⅰ和ⅱ,经过10 min后达到平衡状态,测得平衡时气体的压强是开始时的0.7倍,的平衡转化率为80%。
①0~10min内用表示的平均反应速率___________。
②平衡时___________。该温度下反应ⅱ的化学平衡常数___________。
(4)在催化剂作用下,向某密闭容器中按投料,发生反应ⅰ、ⅱ和ⅲ,研究发现,在180~250℃温度区域,随温度升高,平衡时混合气体的平均摩尔质量持续减小,在250℃以上区域,平衡时混合气体的平均摩尔质量几乎不变。试分析,250℃以上区域,随温度升高,平衡时混合气体的平均摩尔质量几乎不变的原因可能是___________。
【答案】(1)
(2) ①. > ②. 升高温度,平衡常数增大,平衡向正反应方向移动,则正反应为吸热反应 ③. >
(3) ①. 0.04 ②. 0.3 ③. 0.8
(4)当温度高于250℃时,以反应ⅱ为主
【解析】
【小问1详解】
ⅰ-ⅲ=ⅱ,故;
【小问2详解】
①对吸热反应而言,升高温度,平衡常数增大,结合图像,故反应ⅱ为吸热反应;
②由于,,;
【小问3详解】
①;
②反应ⅱ对气体压强不产生影响。根据恒温恒容下,气体的压强之比等于其物质的量之比可知,平衡时混合气体的总物质的量为4 ml×0.7=2.8 ml,结合差量法可得:
,故平衡时;
③结合上述计算可知,反应ⅱ消耗的为0.2 ml,则有:
,
;
小问4详解】
由于反应ⅰ和ⅲ为放热反应,反应ⅱ为吸热反应,且反应ⅱ前后气体分子数相等,说明温度高于250℃时以反应ⅱ为主,故混合气体的平均摩尔质量几乎不变。
20. 化学能与热能在生产生活中扮演者重要的角色,按照要求回答下列各题。
I、键能、焓变及热化学方程式相关考点:
(1)已知拆开1mlH-H键、1mlI-I键、1mlH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1ml氢气和1ml碘反应生成HI会___________(填“放出”或“吸收”)___________kJ的热量。
(2)1gH2燃烧生成液态水,放出142.9kJ热量,该反应的热化方程式为:___________。
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mL-1;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·mL-1;H2O(g)=H2O(l) ΔH=-44.0KJ·mL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式___________
II、中和热的测定
50mL0.55ml·L-1盐酸与50mL0.50ml·L-1NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(4)从实验装置上看,尚缺少一种玻璃仪器,这玻璃仪器名称是___________。
(5)烧杯间填满碎纸条的作用是___________。
(6)若大烧杯上不盖硬纸板,求得的中和热___________(填“偏大”“偏小”或“无影响”)。
(7)实验中若改用60mL0.50ml·L-1盐酸跟50mL0.55ml·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同)___________(填“相等”或“不相等”),所求中和热___________(填“相等”或“不相等”)。
(8)仍按50mL0.55ml·L-1盐酸与50mL0.50ml·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃,②3.5℃,③3.3℃,④3.4℃,则最终代入计算式的温差均值应该为___________℃。已知溶液的比热容4.18J/(g·℃),密度为1g/mL。计算所得中和热ΔH=___________kJ/ml(计算结果保留一位小数)。
【答案】(1) ①. 放出 ②. 11
(2)2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·ml-1
(3)2CO(g)+H2O(g)=2CO2(g)+H2(g) ΔH=-41.2kJ·mL-1
(4)环形玻璃搅拌棒 (5)保温隔热,减少热量损失
(6)偏大 (7) ①. 不相等 ②. 相等
(8) ①. 3.4 ②. -56.8
【解析】
【分析】测定中和热时,要确保热量不散失、两烧杯之间填满碎泡沫塑料、杯口齐平、有孔硬纸板盖住杯口,故装置保温性能好,小烧杯内放一定量盐酸、一次性迅速把NaOH溶液倒入小烧杯中,并用环形玻璃搅拌棒、量取最高温度。
【小问1详解】
在反应H2+I22HI中,断裂1mlH-H键,1mlI-I键共吸收的能量为:1×436kJ+151kJ=587kJ,生成2mlHI,共形成2mlH-I键,放出的能量为:2×299kJ=598kJ,吸收的能量少,放出的能量多,所以该反应为放热反应,放出的热量为:598kJ-587kJ=11kJ。
【小问2详解】
1gH2燃烧生成液态水,放出142.9kJ热量,则2mlH2燃烧生成液态水,放出571.6kJ热量,该反应的热化方程式为:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·ml-1。
【小问3详解】
已知:①2CO(g)+O2(g)=2CO2(g) ΔH =-566kJ·mL-1
②2H2(g)+O2(g)=2H2O(g) ΔH =-483.6kJ·mL-1
根据盖斯定律,①-②得2CO(g)+2H2O(g)=2H2(g)+2CO2(g) ΔH =-566kJ•mL-1-(-483.6kJ•mL-1)=-82.4kJ·mL-1,即CO和H2O(g)作用生成CO2和H2的热化学方程式为:2CO(g)+H2O(g)=2CO2(g)+H2(g) ΔH=-41.2kJ·mL-1
【小问4详解】
从实验装置上看,缺少的仪器是环形玻璃搅拌棒。
【小问5详解】
中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:保温隔热,减少热量损失。
【小问6详解】
若大烧杯上不盖硬纸板,会有一部分热量散失,由于放热反应焓变小于0,则求得的中和热偏大。
【小问7详解】
反应放出的热量和所用酸以及碱的量的多少有关,实验中若改用60mL0.50ml·L-1盐酸跟50mL0.55ml·L-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量不相等,但是中和热的均是酸和碱反应生成1ml水时放出的热,与酸碱的用量无关,所以所求中和热相等。
【小问8详解】
由题干中数据可知,数据①明显实验误差舍去,故其余三次的温差的平均值为:3.4℃,根据反应可知50mL0.55ml·L-1盐酸与50mL0.50ml·L-1NaOH溶液反应可生成0.025mlH2O,已知溶液的比热容4.18J/(g·℃),密度为1g/mL。计算所得中和热ΔH==-56.8 kJ/ml,故答案为:-56.8。
21. 现有下列物质:①熔融的NaCl;②稀硫酸;③液氯;④冰醋酸;⑤铜;⑥BaSO4;⑦NaHSO4;⑧液氨;⑨SO2;⑩Cu(OH)2固体。请按要求回答下列问题。
(1)以上物质中属于弱电解质的是___________(填序号,下同):属于非电解质的是___________。
(2)已知在t1、t2温度下水的电离平衡曲线如图所示:
①t1温度时,若盐酸中,则由水电离产生的___________。
②t2温度下将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,溶液的pH=___________。
(3)①已知25℃,NH3·H2O的,的。亚硫酸电离常数为,改变亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,___________。
②将SO2通入氨水中,当降至时,溶液中的___________,
③将少量SO2通入NaNO2溶液发生反应的离子方程式为___________。
【答案】(1) ①. ④⑩ ②. ⑧⑨
(2) ①. 1×10-10 ②. 6
(3) ①. 105 ②. 10-1 ③. SO2++H2O=HNO2+
【解析】
【小问1详解】
①熔融的NaCl能导电,完全电离,属于强电解质;
②稀硫酸能导电,属于混合物,既不是电解质也不是非电解质,③液氯是单质,既不是电解质也不是非电解质;
④冰醋酸水中部分电离,属于弱电解质;
⑤铜是金属单质,既不是电解质也不是非电解质;
⑥BaSO4溶于水部分完全电离,属于强电解质;
⑦NaHSO4溶于水完全电离,属于强电解质;
⑧液氨不能导电,不能电离,其水溶液虽然能够导电,但不是其本身发生电离,属于非电解质;
⑨SO2不能导电,不能电离,其水溶液虽然能够导电,但不是其本身发生电离,属于非电解质;
⑩Cu(OH)2固体,能溶于水的部分电离,属于弱电解质;
以上物质中属于弱电解质的是④⑩,属于非电解质的是⑧⑨,故答案为:④⑩;⑧⑨;
【小问2详解】
①t1温度时,Kw=1×10-14,若盐酸中c(H+)=1×10-4ml⋅L-1,则由水电离产生的c(H+)=c(OH-)==ml/L=1×10-10ml/L,故答案为:1×10-10;
②图中分析可知,t2温度下,Kw=1×10-12,中性溶液的pH=6,硫酸溶液中c(H+)=10-2ml/L,pH=10的KOH溶液中c(OH-)=ml/L=10-2ml/L,将pH=2的稀硫酸与pH=10的KOH溶液等体积混合后,恰好完全反应,溶液的pH=6,故答案为:6;
【小问3详解】
当c(H2SO3)=c()时,Ka1(H2SO3)=c(H+)=10-pH=10-2,当c()=c()时,Ka2(H2SO3)=c(H+)=10-pH=10-7,==105,将SO2通入氨水中,当c(OH-)降至1.0×10-8ml⋅L-1时,c(H+)==ml/L=10-6ml/L,溶液中的=×===10-1,上述计算由电离平衡常数可知,酸性H2SO3>HNO2>,将SO2通入NaNO2溶液发生反应的离子方程式为:SO2++H2O=HNO2+,故答案为:105;10-1;SO2++H2O=HNO2+。
A.制备胶体
B.验证易溶于水
C.用浓硫酸配制一定浓度的稀硫酸
D.测定中和反应反应热
选项
实验方案
现象
结论
A
往碘的溶液中加入等体积浓溶液,振荡
分层,下层由紫红色变为浅粉红色,上层呈棕黄色
碘在浓溶液中的溶解能力大于在中的溶解能力
B
用玻璃棒蘸取次氯酸钠溶液点在试纸上
试纸最终变为白色
次氯酸钠溶液呈中性
C
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
D
取两份新制氯水,分别滴加溶液和淀粉溶液
前者有白色沉淀,后者溶液变蓝色
氯气与水的反应存在限度
化学键
P—P
P—O
O=O
P=O
键能/kJ·ml-1
a
b
c
x
相关反应
化学平衡常数(K)
ⅰ
ⅱ
ⅲ
A.制备胶体
B.验证易溶于水
C.用浓硫酸配制一定浓度的稀硫酸
D.测定中和反应反应热
选项
实验方案
现象
结论
A
往碘的溶液中加入等体积浓溶液,振荡
分层,下层由紫红色变为浅粉红色,上层呈棕黄色
碘在浓溶液中的溶解能力大于在中的溶解能力
B
用玻璃棒蘸取次氯酸钠溶液点在试纸上
试纸最终变为白色
次氯酸钠溶液呈中性
C
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
D
取两份新制氯水,分别滴加溶液和淀粉溶液
前者有白色沉淀,后者溶液变蓝色
氯气与水的反应存在限度
化学键
P—P
P—O
O=O
P=O
键能/kJ·ml-1
a
b
c
x
相关反应
化学平衡常数(K)
ⅰ
ⅱ
ⅲ
浙江省台州市2023_2024学年高一化学上学期10月月考试题含解析: 这是一份浙江省台州市2023_2024学年高一化学上学期10月月考试题含解析,共20页。试卷主要包含了 下列离子能大量共存的是, 将101等内容,欢迎下载使用。
北京市顺义区2023_2024学年高二化学上学期10月月考试题含解析: 这是一份北京市顺义区2023_2024学年高二化学上学期10月月考试题含解析,共36页。试卷主要包含了5 Fe 56 Zn 65, 下列物质中,属于弱电解质的是, 汽车尾气处理存在反应, 下列说法正确的是, 下列热化学方程式书写正确的是,8kJ/ml等内容,欢迎下载使用。
安徽省2023_2024学年高二化学上学期10月月考试题含解析: 这是一份安徽省2023_2024学年高二化学上学期10月月考试题含解析,共18页。试卷主要包含了考试时间60分钟,满分100分,3kJ/ml,2kJ/mlB, 下列说法正确的是,3ml,因而Q1=0, 下列实验能达到目的的是等内容,欢迎下载使用。












