
江苏省无锡市江阴市六校2024-2025学年高一上学期11月期中联考化学试卷(Word版附答案)
展开命题人:糜红叶 复核人:陈海萍
考生注意:
本试卷分选择题和非选择题两部分,共100分。考试时间75分钟。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5
客观题请用2B铅笔填涂在答题卡上,主观题用黑色的水笔书写在答题卷上。
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意
1.航天科技的发展与化学密切相关。下列说法不正确的是
A.新一代运载火箭使用的液氢为非金属单质
B.光束通过空间站使用的纳米气凝胶时,可观察到丁达尔效应
C.空间站使用石墨烯存储器,石墨烯与金刚石互为同素异形体
D.航天飞船内安装盛有过氧化钠颗粒的装置,它的用途是再生氧气,过氧化钠属于碱性氧化物
2.化学与生活、环境和生产密切相关。下列过程不涉及氧化还原反应的是
A.用氯气对自来水进行消毒B.漂白粉失效
C.新切开的钠表面变暗D.用小苏打蒸制糕点
3.下列物质中属于电解质的是
A.蔗糖B.CO2 C.K2SO4 D.盐酸
4.下列各组中的离子,能在溶液中大量共存的是
A.K+、Ca2+、Cl-、COeq \\al(2-,3) B.Na+、Mg2+、SOeq \\al(2-,4)、Cl-
C.H+、Na+、OH-、 Cl- D.Cu2+、Ba2+、Cl-、SOeq \\al(2-,4)
5.在给定条件下,下列物质间转化能实现的是
A. B.
C. D.HClOCl2
6. 下列有关说法正确的是
A. 将5.85 g NaCl固体完全溶于1 L水中,所得氯化钠溶液物质的量浓度为0.1 ml/L
B. 0.1 ml/L MgCl2溶液中含有0.2 ml Cl-
C. 标准状况下18 g水的体积约为22.4 L
D. 同温同压下,等质量的CO与CO2的体积之比为11 :7
7.下列关于物质的性质与用途不具有对应关系的是
A.盐酸具有酸性,可用于金属除锈
B.Cl2能溶于水,可用于工业制盐酸
C.常温下氯气与铁不反应,液氯可以保存在干燥的钢瓶中
D.NaHCO3与盐酸反应,可用作抗酸药
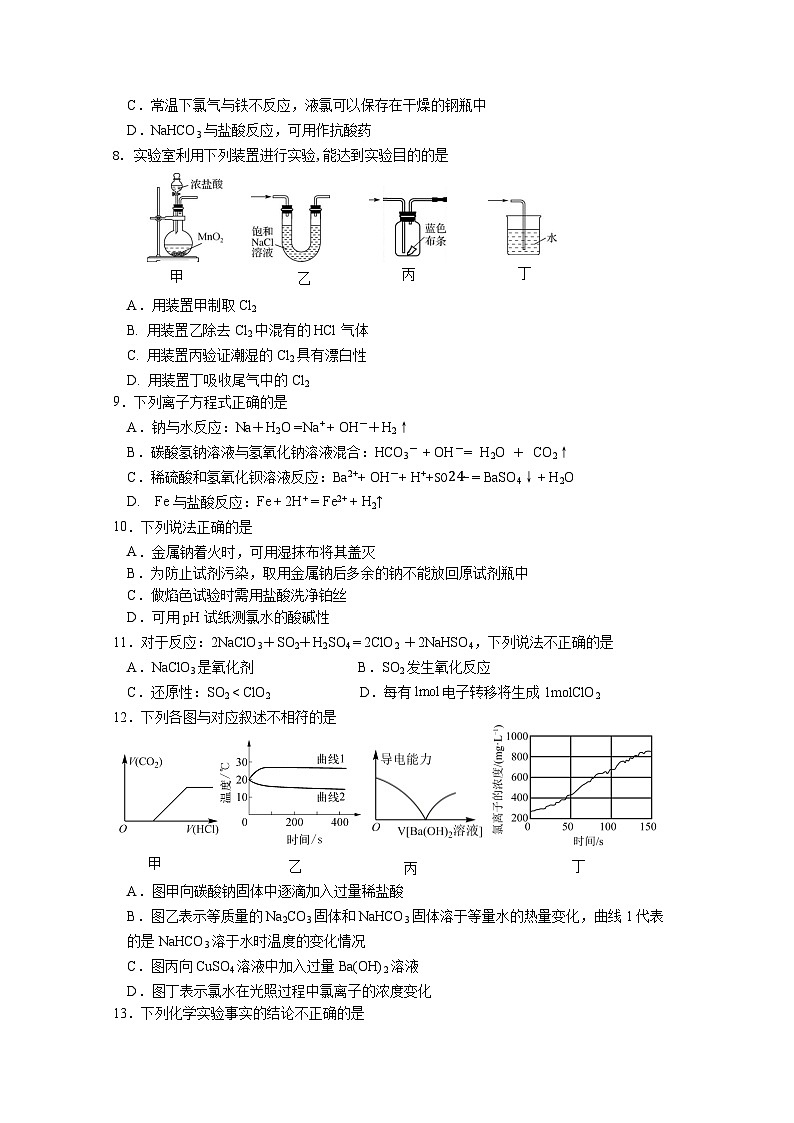
8. 实验室利用下列装置进行实验,能达到实验目的的是
甲
乙
丙
丁
A.用装置甲制取Cl2
B. 用装置乙除去Cl2中混有的HCl气体
C. 用装置丙验证潮湿的Cl2具有漂白性
D. 用装置丁吸收尾气中的Cl2
9.下列离子方程式正确的是
A.钠与水反应:Na+H2O = Na+ + OH-+H2↑
B.碳酸氢钠溶液与氢氧化钠溶液混合:HCO3- + OH-= H2O + CO2↑
C.稀硫酸和氢氧化钡溶液反应:Ba2++ OH-+ H++SOeq \\al(2-,4)= BaSO4↓ + H2O
D. Fe与盐酸反应:Fe + 2H+ = Fe2+ + H2↑
10.下列说法正确的是
A.金属钠着火时,可用湿抹布将其盖灭
B.为防止试剂污染,取用金属钠后多余的钠不能放回原试剂瓶中
C.做焰色试验时需用盐酸洗净铂丝
D.可用pH试纸测氯水的酸碱性
11.对于反应:2NaClO3+SO2+H2SO4 = 2ClO2 +2NaHSO4,下列说法不正确的是
A.NaClO3是氧化剂 B.SO2发生氧化反应
C.还原性:SO2 < ClO2 D.每有电子转移将生成1mlClO2
甲
乙
丙
丁
12.下列各图与对应叙述不相符的是
A.图甲向碳酸钠固体中逐滴加入过量稀盐酸
B.图乙表示等质量的Na2CO3固体和NaHCO3固体溶于等量水的热量变化,曲线1代表
的是NaHCO3溶于水时温度的变化情况
C.图丙向CuSO4溶液中加入过量Ba(OH)2溶液
D.图丁表示氯水在光照过程中氯离子的浓度变化
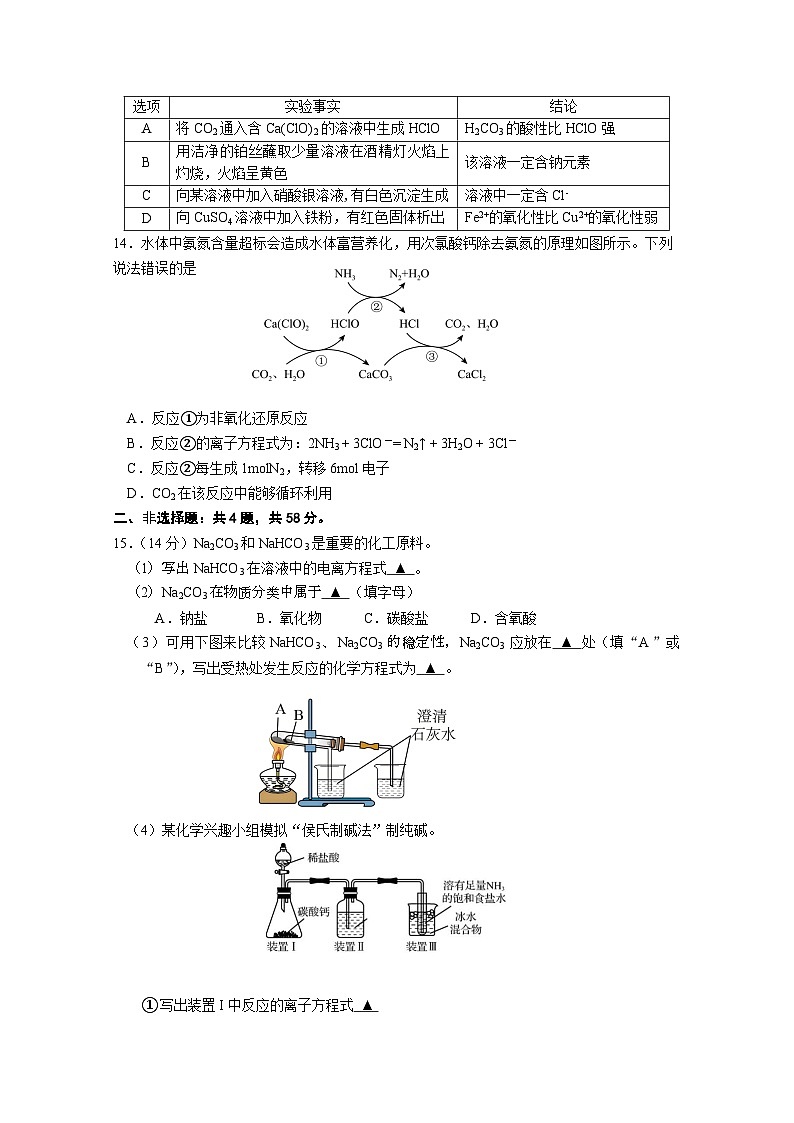
13.下列化学实验事实的结论不正确的是
14.水体中氨氮含量超标会造成水体富营养化,用次氯酸钙除去氨氮的原理如图所示。下列说法错误的是
A.反应①为非氧化还原反应
B.反应②的离子方程式为:2NH3 + 3ClO-= N2↑ + 3H2O + 3Cl-
C.反应②每生成1mlN2,转移6ml电子
D.CO2在该反应中能够循环利用
二、非选择题:共4题,共58分。
15.(14分)Na2CO3和NaHCO3是重要的化工原料。
(1)写出NaHCO3在溶液中的电离方程式 ▲ 。
(2)Na2CO3在物质分类中属于 ▲ (填字母)
A.钠盐 B.氧化物 C.碳酸盐 D.含氧酸
(3)可用下图来比较NaHCO3、Na2CO3的稳定性,Na2CO3应放在 ▲ 处(填“A”或“B”),写出受热处发生反应的化学方程式为 ▲ 。
(4)某化学兴趣小组模拟“侯氏制碱法”制纯碱。
①写出装置I中反应的离子方程式 ▲
②为除去CO2中的HCl,装置Ⅱ中的试剂为 ▲
③装置Ⅲ中析出的晶体是 ▲ (填化学式)
16.(12分)某同学进行实验时需要100 mL 0.10 ml·L-1 Na2CO3溶液,但实验室只有 Na2CO3•10H2O晶体和2.5 ml·L-1 Na2CO3溶液。该同学利用所给试剂配制所需溶液。完成下列填空
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、量筒、玻璃棒外,至少还需要的两种玻璃仪器是 ▲ 、 ▲
(2)若用Na2CO3•10H2O晶体配制100 mL所需溶液,需用电子天平称取晶体的质量为 ▲ g(保留两位小数);若用2.5 ml·L-1 Na2CO3溶液配制100 mL所需溶液,需要用量筒量取 ▲
mL溶液(保留一位小数)。
(3)下图是用Na2CO3•10H2O晶体配制溶液的部分过程如图所示,操作正确的是 ▲ 。
(4)在配制过程中,下列操作会使溶液浓度偏小的是 ▲ (填字母)。
A. 容量瓶内壁附有水珠而未干燥处理 B. 转移时,未洗涤烧杯内壁和玻璃棒
C.定容时加水超过刻度线 D.定容时俯视刻度线
17.(17分)某实验小组制取“84”消毒液(主要成分为NaClO)并探究其性质。
I.制取NaClO的装置如图1所示(夹持装置略):
图2
(1)装置A制取氯气的反应原理为:16HCl(浓)+2KMnO4=2MnCl2+8H2O+2KCl+5Cl2↑,
在该反应中,氧化剂与还原剂的物质的量之比为 ▲ 。该反应中盐酸表现的性质 ▲
(2)上述装置存在一个缺陷,会导致“84”消毒液的产率降低,改进的方法是 ▲
(3)装置B中得到“84”消毒液的化学方程式为 ▲ 。装置B中生成物的物质的量和溶液的温度随时间的变化如图2所示,经分析发现实验过程中装置B中温度上升过快会导致产物中存在杂质,为避免此状况的发生,应进行的操作为 ▲ 。
II.探究“84”消毒液的性质:
为探究“84”消毒液(含NaClO和NaCl)的性质,设计的实验与观察到的现象如下表所示。
(1)84消毒液的有效成分是次氯酸钠,由实验①可知:次氯酸钠溶液呈 ▲
A.酸性 B.中性 C.碱性
(2)对比实验①和②可知:在酸性条件下,NaClO的氧化性 ▲ (填“增强”或“减弱”)
(3)由实验③可知:产生的气体是Cl2,用离子方程式解释产生Cl2的原因 ▲ 。
18.(15分)自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
I.某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为:。
(1)冰水浴的作用是 ▲ 。
(2)用双线桥表示该反应电子转移的方向和数目 ▲ 。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2—),需将其转化为Cl—除去。下列试剂中,可将ClO2—转化为Cl—的是 ▲ (填字母序号)。
A. B. C. D.
(4)ClO2的定量测定:为测定某二氧化氯消毒液中ClO2的浓度,进行如下实验:量取 二氧化氯消毒液于锥形瓶中,加蒸馏水稀释至,再向其中加入过量溶液,充分振荡,发生反应2ClO2+2KI=2KClO2+I2;再用0.10 ml·L-1Na2S2O3标准溶液与I2反应,通过测定消耗Na2S2O3标准溶液的体积可计算出ClO2与KI反应生成I2的物质的量为2.75×10-4 ml。计算该二氧化氯消毒液中ClO2的物质的量浓度 ▲ 。(写出计算过程)
Ⅱ. 用过氧化钠制备高铁酸钾:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
2FeSO4+6Na2O2 eq \(=====,\s\up7(高温))2Na2FeO4+2Na2O+2Na2SO4+O2↑,再加入适量饱和KOH溶液反应得到K2FeO4。
(1)该反应的还原剂是 ▲ 。
(2)当该反应转移20ml电子时,产生标准状况下氧气的体积为 ▲ L
(3)上述反应在熔融状态下进行,而不在水溶液中进行的原因是 ▲ (用化学方程式表示)
选项
实验事实
结论
A
将CO2通入含Ca(ClO)2的溶液中生成HClO
H2CO3的酸性比HClO强
B
用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色
该溶液一定含钠元素
C
向某溶液中加入硝酸银溶液,有白色沉淀生成
溶液中一定含Cl-
D
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性比Cu2+的氧化性弱
实验
6 mL“84”消毒液+2滴石蕊试液
6 mL“84”消毒液+2滴石蕊试液
6 mL“84”消毒液+2滴石蕊试液
现象
混合后溶液呈蓝色,一段时间后蓝色褪去
混合后溶液呈紫色,紫色迅速褪去,无气体产生
混合后溶液呈红色,红色迅速褪去,并产生大量气体,该气体能使湿润的淀粉碘化钾试纸变蓝
2024-2025学年度秋学期期中联考试卷
高一化学参考答案
一、单项选择题(本题包括14小题,每小题3分,共42分)
二、非选择题(本题包含4大题,共58分)
15.(14分)
(1)NaHCO3 = Na+ + HCO3- (2分)
(2)AC (2分)
(3)A (2分) 2NaHCO3 eq \(=====,\s\up7(△))Na2CO3+H2O+CO2↑(2分)
(4)①CaCO3+2H+=Ca2++CO2↑+H2O (2分) ②饱和碳酸氢钠溶液 (2分)
③NaHCO3(2分)
16.(12分)
(1)100 mL容量瓶 (2分) 胶头滴管(2分)
(2)2.86 (2分) 4.0 (2分)
B (2分)
BC (2分)
(17分)
I.(1)1:5(2分) 还原性和酸性(2分)
在A、B之间安装一个装有饱和食盐水的洗气瓶(2分)
Cl2+2NaOH=NaCl+NaClO+H2O(2分)
向装置A中缓慢滴加浓盐酸或将装置B放入冰水浴中(2分)
II.(1)C (2分) (2)增强(2分) (3)Cl-+ ClO-+ 2H+= Cl2 ↑+ H2O(3分)
(15分)
得2e-
Ⅰ.(1)冷凝ClO2,与Cl2分离(2分)
失2e-
(2) (2分)
(3)AC(2分)
(4)n(ClO2)=5.5×10-4ml (1分)
(2分)
Ⅱ. (1)FeSO4和Na2O2 (2分)
(2)44.8(2分)
(3)2Na2O2+2H2O=4NaOH+O2↑(2分)序号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
D
D
C
B
A
D
B
C
D
C
C
B
C
B
江苏省无锡市江阴市两校联考2023-2024学年高一下学期3月月考化学试卷(Word版附答案): 这是一份江苏省无锡市江阴市两校联考2023-2024学年高一下学期3月月考化学试卷(Word版附答案),共5页。试卷主要包含了可能用到的相对原子量 , 下列有关金属的制法正确的是,下列关于乙烯的说法不正确的是等内容,欢迎下载使用。
江苏省无锡市江阴市四校2023-2024学年高一上学期期中联考化学试题(Word版附解析): 这是一份江苏省无锡市江阴市四校2023-2024学年高一上学期期中联考化学试题(Word版附解析),共17页。试卷主要包含了可能用到的相对原子质量等内容,欢迎下载使用。
江苏省无锡市江阴市四校2023-2024学年高一化学上学期期中联考试题(Word版附答案): 这是一份江苏省无锡市江阴市四校2023-2024学年高一化学上学期期中联考试题(Word版附答案),共8页。试卷主要包含了可能用到的相对原子质量, 每空2分,2%等内容,欢迎下载使用。












