




科粤版(2024)九年级下册8.2 常见的酸和碱教课内容ppt课件
展开
这是一份科粤版(2024)九年级下册8.2 常见的酸和碱教课内容ppt课件,文件包含第2课时稀酸的化学性质pptx、稀盐酸稀硫酸与碳酸钠石灰石反应mp4、稀硫酸和稀盐酸与氧化铜氧化铁反应mp4、酸与指示剂mp4等4份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
1.知道常见酸有相似的化学性质,了解一些反应的发生所需的条件。2.通过对酸的性质的开放性探究,养成“先个别后一般”的认识物质的科学方法,进一步发展科学探究能力。3.通过演示实验和分组实验,培养观察能力、逻辑思维能力和实验操作能力以及记录实验的能力。
用于清洁卫生间污渍、尿渍、水垢等。针对钢铁除锈能达到较好的效果。
问题探讨:为什么盐酸可以除锈?
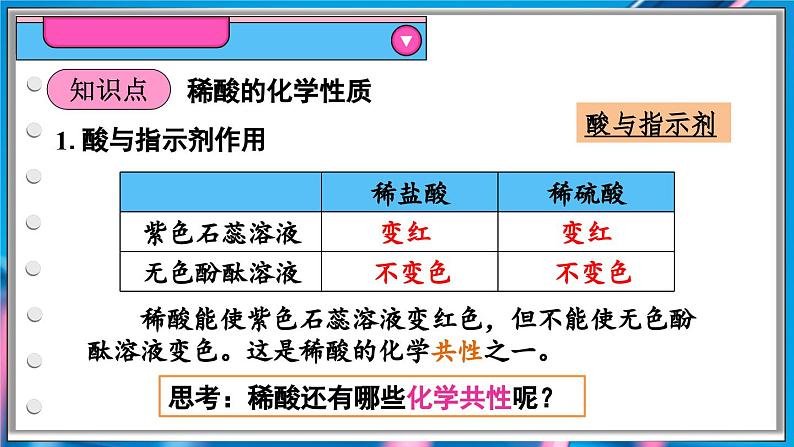
稀酸能使紫色石蕊溶液变红色,但不能使无色酚酞溶液变色。这是稀酸的化学共性之一。
思考:稀酸还有哪些化学共性呢?
【目的】 认识稀酸的化学性质
【提出问题】 稀酸具有哪些化学共性?
【形成假设】 除指示剂外,稀酸还可能与__________________________________等物质发生反应。
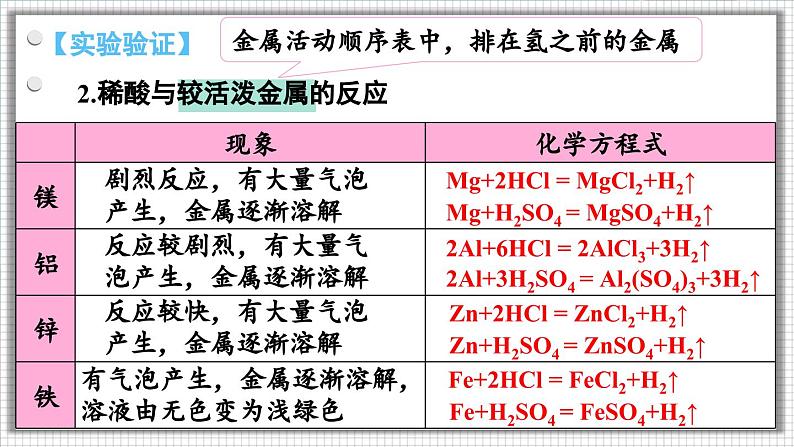
2.稀酸与较活泼金属的反应
金属活动顺序表中,排在氢之前的金属
剧烈反应,有大量气泡产生,金属逐渐溶解
反应较剧烈,有大量气泡产生,金属逐渐溶解
反应较快,有大量气泡产生,金属逐渐溶解
有气泡产生,金属逐渐溶解,溶液由无色变为浅绿色
Mg+2HCl = MgCl2+H2↑
Mg+H2SO4 = MgSO4+H2↑
2Al+6HCl = 2AlCl3+3H2↑
2Al+3H2SO4 = Al2(SO4)3+3H2↑
Zn+2HCl = ZnCl2+H2↑
Zn+H2SO4 = ZnSO4+H2↑
Fe+H2SO4 = FeSO4+H2↑
Fe+2HCl = FeCl2+H2↑
观察这些化学方程式,你发现了什么规律?
Mg+H2SO4 = MgSO4+H2↑
稀酸与较活泼金属反应的通式:
稀酸能够和较活泼金属反应,生成盐和氢气。
由金属离子(或铵根离子)和酸根离子组成的化合物通称为盐
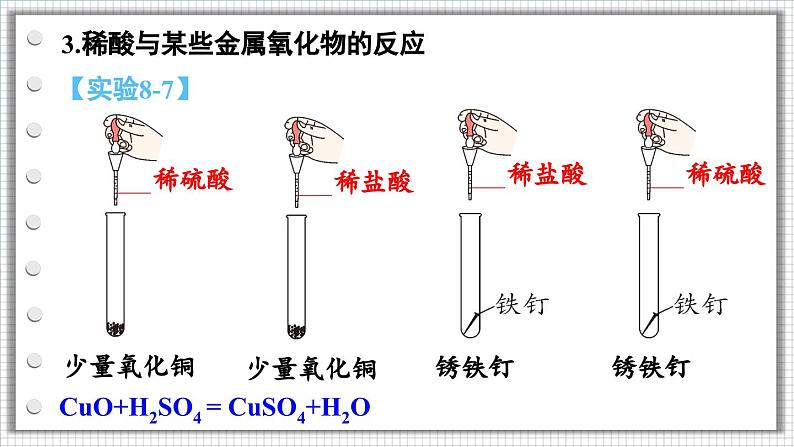
3.稀酸与某些金属氧化物的反应
CuO+H2SO4 = CuSO4+H2O
黑色固体逐渐溶解,溶液变为蓝色
铁钉表面的铁锈逐渐消失,溶液由无色变为黄色
CuO+2HCl=CuCl2+H2O
Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O
Fe2O3+6HCl = 2FeCl3+3H2O
CuO+2HCl = CuCl2+H2O
稀酸与金属氧化物反应的通式:
CaCO3+2HCl = CaCl2+H2O +CO2↑
石灰石部分溶解,产生气泡
碳酸钠被溶解,产生大量气泡
CaCO3+H2SO4 = CaSO4+H2O+CO2↑
Na2CO3+H2SO4 = Na2SO4+H2O +CO2↑
Na2CO3+2HCl = 2NaCl+H2O+CO2↑
不能使无色酚酞溶液变色
酸+较活泼金属→盐+氢气
酸+金属氧化物→盐+水
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
酸在水中都能解离出H+和酸根离子,即在不同酸的溶液中都含有H+,所以酸有一些相似的性质。
HCl在水中解离出离子示意图
稀盐酸、稀硫酸等酸为什么会有相似的化学性质呢?
依据物质类别认识物质性质的思路与方法由于同类物质的性质具有共性,在认识一类物质的性质时,可根据该类物质中某种物质的已知性质推测它们的共性,再选择同类其他物质设计实验进行验证。此外,在认识某物质的性质时,也可根据其所属类别物质的共性对该物质的性质作出推测,并设计实验进行验证。
1.写出下列反应的化学方程式。(1)稀硫酸与氧化镁反应,生成硫酸镁和水。
__________________________________________
(2)稀硫酸与氯化钡反应,生成硫酸钡沉淀和盐酸。
(3)稀硫酸与锌反应,生成硫酸锌和氢气。
H2SO4+MgO = MgSO4+H2O
H2SO4+ BaCl2 = BaSO4↓+2HCl
H2SO4+ Zn= ZnSO4+H2↑
2.举例说明以下转变关系(把上题的小题号对应填在括号内)。
1.如图表示化学反应中溶液的颜色变化,其中X表示稀盐酸或稀硫酸,则下列叙述错误的是( )
A.a可用于检验X溶液显酸性 B.b可能是氧化物C.c可能是黑色固体 D.d可能是单质
2.硫酸是一种重要的工业原料,下列说法不正确的是( )A.浓硫酸可用于干燥 O2B.浓硫酸可使纸张炭化C.实验室可用块状石灰石与稀硫酸制备 CO2D.稀硫酸可用于金属表面除锈
3.构建模型和构建知识网络是化学学习中重要的学习方法,李华同学利用左手构建酸的性质知识网络,如图所示,请结合图示回答下列问题:
(1)若用湿润的pH试纸测定盐酸的 pH,则结果会_______(填“偏大”“偏小”或“无影响”)(2)图中①的现象是______________________。
(3)写出一个符合图中③的化学方程式:______________________________。(4)图中⑤的性质在工业上可用于__________(填用途)。
HCl+ AgNO3 = AgCl↓
相关课件
这是一份初中化学科粤版(2024)九年级下册7.2 物质溶解的量背景图ppt课件,文件包含第2课时固体物质的溶解度pptx、固体溶解度曲线的应用mp4等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
这是一份化学九年级下册8.2 常见的酸和碱说课ppt课件,共56页。PPT课件主要包含了需密封保存,浓硫酸的稀释,往浓硫酸中加水,活动性在氢之前,稀酸与盐的反应,归纳总结酸的化学性质,物理变化,都能溶于水,至少有一种沉淀,归纳总结碱的化学性质等内容,欢迎下载使用。
这是一份科粤版九年级下册第八章 常见的酸、碱、盐8.2 常见的酸和碱图片课件ppt,共60页。PPT课件主要包含了逐点导讲练,课堂小结,作业提升,学习目标,课时讲解,课时流程,课时导入,感悟新知,酸的物理性质和特性,题型2浓硫酸的使用等内容,欢迎下载使用。









