




初中化学科粤版(2024)九年级下册第八章 常见的酸、碱、盐8.4 常用的盐课前预习ppt课件
展开
这是一份初中化学科粤版(2024)九年级下册第八章 常见的酸、碱、盐8.4 常用的盐课前预习ppt课件,文件包含第2课时盐的组成和化学性质复分解反应发生的条件pptx、硫酸钠和硝酸钡反应mp4、碳酸钠和氯化钙反应mp4、稀盐酸与硝酸银反应mp4、稀盐酸与碳酸氢钠反应mp4等5份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
1.了解盐的组成特点。2.在回顾酸、碱化学性质的基础上汇总盐的化学性质;了解碳酸根和硫酸根离子的检验方法。3.了解复分解反应发生的条件。学会判断复分解反应能否发生。
金属离子 + ____
金属离子(铵根离子)+ 酸根离子
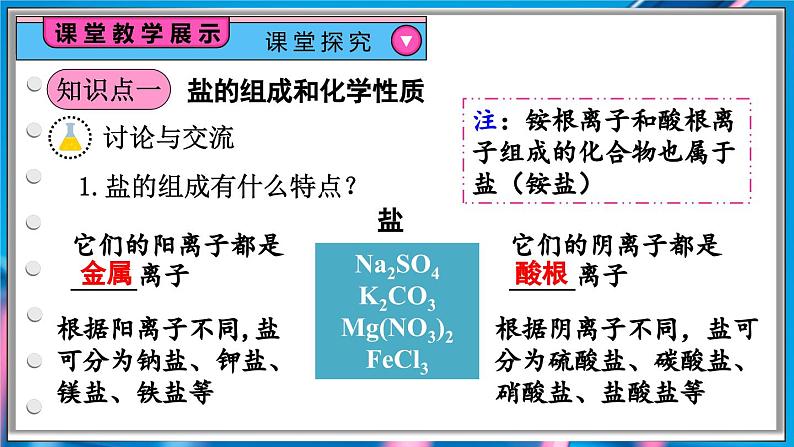
1.盐的组成有什么特点?
Na2SO4K2CO3Mg(NO3)2FeCl3
它们的阳离子都是_____离子
它们的阴离子都是_____离子
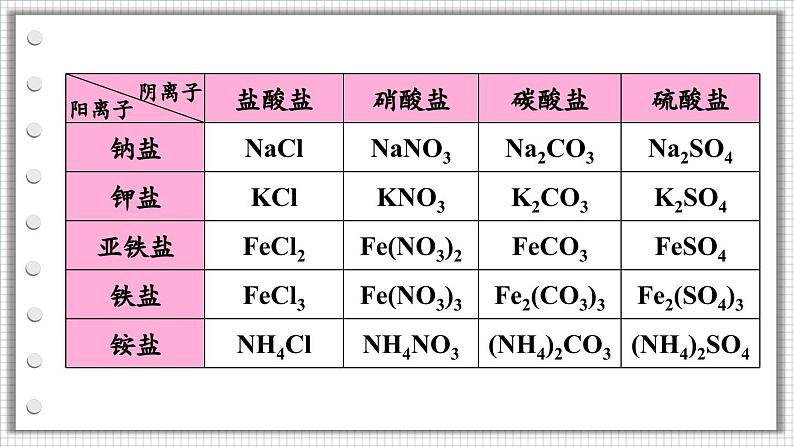
根据阳离子不同,盐可分为钠盐、钾盐、镁盐、铁盐等
根据阴离子不同,盐可分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等
注:铵根离子和酸根离子组成的化合物也属于盐(铵盐)
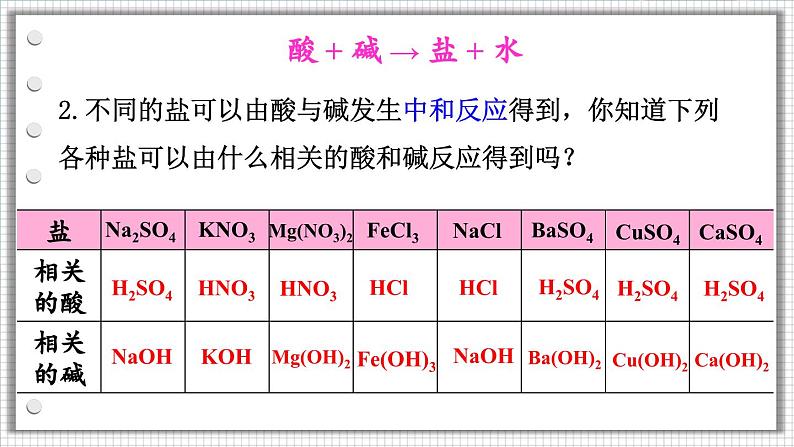
2.不同的盐可以由酸与碱发生中和反应得到,你知道下列各种盐可以由什么相关的酸和碱反应得到吗?
酸 + 碱 → 盐 + 水
(1)回顾实验室中是如何制取二氧化碳气体的,写出反应的化学方程式___________________________________。
盐 + 酸 → 新盐 + 新酸
CaCO3 + 2HCl ══ CaCl2 + H2O + CO2 ↑
由此可知:盐可能跟酸发生复分解反应,生成新盐和新酸。
(2)回顾碳酸钠与盐酸反应,写出反应的化学方程式______________________________________。
(3)回顾硝酸银与盐酸反应,写出反应的化学方程式___________________________________。
AgNO3 + HCl ══ AgCl ↓+ HNO3
Na2CO3 + 2HCl ══ 2NaCl + H2O + CO2 ↑
碳酸根离子或碳酸氢根离子的检验
检验原理:组成里含有碳酸根或者碳酸氢根的盐都能与盐酸反应生成二氧化碳气体。
检验试剂:稀盐酸和澄清石灰水
检验方法:取样品于试管中,加入适量的稀盐酸,有气体生成;把生成的气体通入澄清的石灰水,石灰水变浑浊,则证明此固体含有碳酸根或者碳酸氢根离子。
(1)回顾硫酸铜溶液与氢氧化钠溶液的反应,写出反应的化学方程式_____________________________________。
(2)回顾氯化铁溶液与氢氧化钠溶液的反应,写出反应的化学方程式_____________________________________。
(3)回顾碳酸钠溶液和氢氧化钙溶液的反应,写出反应的化学方程式_____________________________________。
盐 + 碱 → 新盐 + 新碱
CuSO4 + 2NaOH ══ Na2SO4 + Cu(OH)2 ↓
由此可知:盐可能跟碱发生复分解反应,生成新盐和新碱。
Na2CO3 + Ca(OH)2 ══ CaCO3 ↓+ 2NaOH
FeCl3 + 3NaOH ══ 3NaCl + Fe(OH)3 ↓
思考:是否所有的盐都能与碱发生反应呢?反应的条件是什么?
反应物盐、碱必溶;生成物新盐新碱至少有一种不溶。
【实验8-15】向装有少量碳酸钠溶液的试管中加入少量氯化钙溶液、装有少量硫酸钠溶液的试管中加入少量硝酸钡溶液,观察现象,并写出相应反应的化学方程式。
Na2CO3+CaCl2══CaCO3↓+2NaCl
Na2SO4+Ba(NO3)2══BaSO4↓+2NaNO3
由此可知:两种盐之间可能发生复分解反应,生成另外两种新盐。
盐1 + 盐2 → 新盐1 + 新盐2
(1)铁与硫酸铜溶液反应:_____________________________________。
(2)铜与硝酸银溶液反应:_____________________________________。
盐 + 金属 → 新盐 + 新金属
CuSO4 + Fe ══ FeSO4 + Cu
由此可知:盐可能跟金属发生置换反应,生成新盐和新金属。
2AgNO3 + Cu══ Cu(NO3)2+ 2Ag
思考:是否所有的盐都能与任何金属发生反应呢?反应的条件是什么?
在金属活动性顺序表中,只有位于前面的金属才能把位于后面的金属从它的盐溶液中置换出来,与氢的位置无关;盐要可溶。
1.盐与酸、碱、其他盐之间可能发生复分解反应:
①盐 + 酸 → 新盐 + 新酸;
②盐 + 碱 → 新盐 + 新碱;
③盐1 + 盐2 → 新盐1 + 新盐2
2.盐溶液与某些金属可能发生置换反应:
盐 + 活动性较强的金属 → 新盐 + 活动性较弱的金属
【目的】 了解复分解反应的条件
AgNO3+HCl══AgCl ↓+HNO3
NaHCO3+HCl══NaCl +CO2↑+H2O
归纳前面实验中所发生的复分解反应的生成物的特征:
由此可知:复分解反应发生的条件是生成物中有沉淀(难溶物)、气体或水等。
至少具备三个条件中的一个
AgNO3 + NaCl ══ AgCl ↓+ NaNO3
CaCO3+ 2HNO3 ══ Ca(NO3)2+ H2O + CO2↑
Cu(OH) 2+2HNO3 ══ Cu(NO3)2 + 2H2O
合作探究:检验SO42-的方法
Na2SO4 + BaCl2 ══ BaSO4↓+ 2NaCl
实验现象:有白色沉淀生成。
Na2CO3 + BaCl2 ══ BaCO3↓+ 2NaCl
如何将这两种沉淀区分开呢?
硫酸钡沉淀不溶于稀硝酸。根据这一特性,氯化钡溶液(BaCl2)是检验硫酸根离子(SO42-)的试剂,可用于检验硫酸和其他在溶液中能产生SO42-离子的化合物。
请你预测稀盐酸与硝酸钾溶液能否发生反应。
反应不能发生。因为NaCl和KNO3两种物质在溶液中互相交换成分后没有气体、沉淀或水生成,不符合复分解反应发生的条件。
在一定条件下通过化学反应可以实现物质的转化。可根据物质的性质确定物质之间的转化关系,设计物质间的转化途径,从而获得制取某类物质的方法。下图可表示生成盐的物质转化关系。若要制得氯化钙,可以通过哪些物质之间的反应来实现?
若要制得氯化钙,可以通过下列物质之间的反应来实现:
①HCl和Ca(OH)2;②CuCl2和Ca(OH)2;③CaCO3和HCl。
石灰岩地区溶洞岩石的主要成分是碳酸钙,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:
CaCO3+CO2 + H2O ══ Ca(HCO3)2
溶有碳酸氢钙的水遇热或压强突然减小时,溶解在水里的碳酸氢钙又会逐渐分解成难溶的碳酸钙沉积下来,同时产生二氧化碳和水:
Ca(HCO3)2══ CaCO3↓+CO2↑+ H2O
1.下列各组物质不能用水来鉴别的是( )A.CaCO3和 Na2CO3 B.K2SO4和 KNO3C.生石灰和熟石灰D.CuSO4 和 Fe2(SO4)3
2.下列各组物质中,不能发生复分解反应的是( )A.HCl 和 CuOB.Na2CO3和 H2SO4C.Ca(OH)2和 Na2CO3D.KCl 和 CuSO4
3.向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,反应过程中产生的沉淀质量与加入的氢氧化钠溶液的质量关系如图所示。下列说法不正确的是( )A.A点溶液中的溶质有2种B.E点溶液中的溶质有3种C.AB 段有沉淀生成D.F点溶液的 pH >7
4.下列各组离子在水中能大量共存,并形成无色溶液的是( )A.Na+、Ca2+、NO3-、Cl-B.Ag +、H +、Cl- 、NO3-C.Mg2+、K+、OH-、SO42-D.Na + 、Fe3+、 SO42- 、 Cl-
相关课件
这是一份科粤版(2024)九年级下册8.4 常用的盐课堂教学课件ppt,文件包含第1课时几种常见盐的用途pptx、侯氏联合制碱法mp4等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
这是一份科粤版(2024)九年级下册第八章 常见的酸、碱、盐8.4 常用的盐集体备课ppt课件,共27页。PPT课件主要包含了几种常见盐的用途,盐的分类,碳酸分解所得等内容,欢迎下载使用。
这是一份初中化学科粤版九年级下册8.4 常用的盐图片ppt课件,共20页。










