




四川省泸州市泸化中学2024-2025学年高二上学期期中化学试卷(Word版附解析)
展开
这是一份四川省泸州市泸化中学2024-2025学年高二上学期期中化学试卷(Word版附解析),文件包含四川省泸州市龙马潭区泸化中学2024-2025学年高二上学期11月期中化学试题Word版含解析docx、四川省泸州市龙马潭区泸化中学2024-2025学年高二上学期11月期中化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
注意事项:
1.答卷前考生务必把自己的姓名、准考证号填写在答题卡上。
2.回答选择题时用2B铅笔将答题卡上对应题目的答案标号涂黑;回答非选择题时,用0.5毫米黑色墨迹签字笔将答案写在答题卡上,写在本试卷上无效。
3.试卷满分100分,考试时间75分钟,考试结束后将本试卷和答题卡一并交回。
一、单选题(共42分)
1. 原电池中的能量转化形式是
A. 光能→化学能B. 化学能→光能C. 热能→电能D. 化学能→电能
【答案】D
【解析】
【详解】原电池中负极发生失电子的氧化反应,正极发生得电子的还原反应,发生电子转移,将化学能直接转化为电能,故选D。
2. 四种X溶液分别加入四个盛有10 mL 2 ml/L盐酸的烧杯中,均加水稀释到50 mL,假设混合和稀释是瞬间完成的,则开始的瞬间反应速率最大的是
A. 20 mL 2 ml/L 的X溶液B. 10 mL 4 ml/L 的X溶液
C. 20 mL 3 ml/L 的X溶液D. 10 mL 2 ml/L 的X溶液
【答案】C
【解析】
【详解】先计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则物质的量越大,浓度越大,则反应速率越大。
A、20mL2ml/L的X溶液,X的物质的量为0.02L×2ml/L=0.04ml;
B、10mL4ml/L的X溶液,X的物质的量为0.01L×4ml/L=0.04ml;
C、20mL3ml/L的X溶液,X的物质的量为0.02L×3ml/L=0.06ml;
D、10mL2ml/L的X溶液,X的物质的量为0.01L×2ml/L=0.02ml,所以四种情况下C中X的浓度最大,反应速率最大;
答案选C。
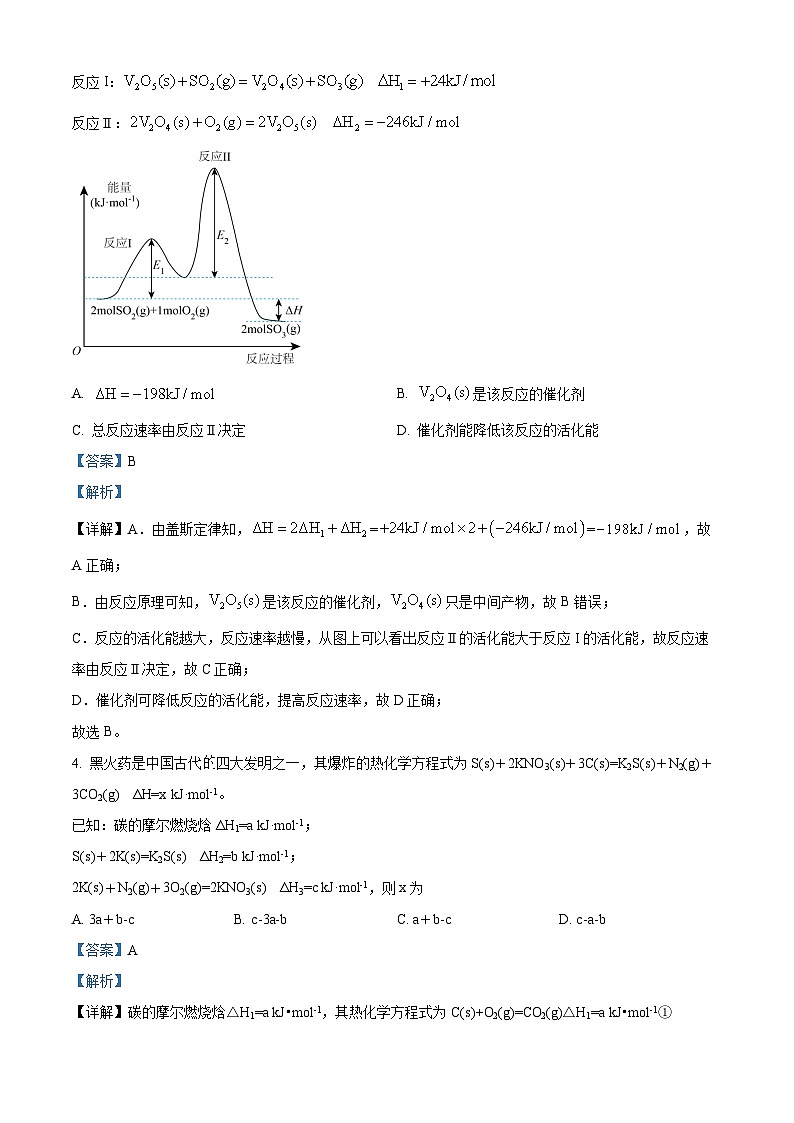
3. 已知的反应机理和反应过程中能量变化图如下,下列说法错误的是
反应I:
反应Ⅱ:
A. B. 是该反应的催化剂
C. 总反应速率由反应Ⅱ决定D. 催化剂能降低该反应的活化能
【答案】B
【解析】
【详解】A.由盖斯定律知,==,故A正确;
B.由反应原理可知,是该反应的催化剂,只是中间产物,故B错误;
C.反应的活化能越大,反应速率越慢,从图上可以看出反应Ⅱ的活化能大于反应I的活化能,故反应速率由反应Ⅱ决定,故C正确;
D.催化剂可降低反应的活化能,提高反应速率,故D正确;
故选B。
4. 黑火药是中国古代四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) ΔH=x kJ·ml-1。
已知:碳的摩尔燃烧焓ΔH1=a kJ·ml-1;
S(s)+2K(s)=K2S(s) ΔH2=b kJ·ml-1;
2K(s)+N2(g)+3O2(g)=2KNO3(s) ΔH3=c kJ·ml-1,则x为
A. 3a+b-cB. c-3a-bC. a+b-cD. c-a-b
【答案】A
【解析】
【详解】碳的摩尔燃烧焓△H1=a kJ•ml-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•ml-1①
S(s)+2K(s)═K2S(s) △H2=b kJ•ml-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•ml-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=x kJ•ml-1=(3a+b-c)kJ•ml-1,所以x=3a+b-c,故答案为A。
5. 当下列反应达到平衡时,保持温度不变,无论等容或等压时向容器中充入氩气,平衡一定不移动的是
A. N2(g)+3H2(g) 2NH3(g)B. 2HI(g)H2(g)+I2(g)
C. PCl5(g)PCl3(g)+Cl2(g)D. 2SO2(g)+O2(g)2SO3(g)
【答案】B
【解析】
【详解】A.该反应是一个反应前后气体体积减小的可逆反应,若恒压下通入氩气,容器体积变大,相等于减小压强,平衡向逆反应方向移动,选项A不选;
B.该反应是一个反应前后气体体积不变的可逆反应,压强对平衡移动无影响,选项B选;
C.该反应是一个反应前后气体体积增大的可逆反应,若恒压下通入氩气,容器体积变大,相等于减小压强,平衡向正反应方向移动,选项C不选;
D.该反应是一个反应前后气体体积减小的可逆反应,若恒压下通入氩气,容器体积变大,相等于减小压强,平衡向逆反应方向移动,选项D不选;
故答案为B。
6. 氢气在氯气中燃烧生成氯化氢,同时产生苍白色火焰。下列说法正确的是
A. 该反应的
B. 参加反应的氢气和氯气的总能量小于生成的氯化氢的总能量
C. 断裂键放出能量
D. 形成键放出能量
【答案】D
【解析】
【分析】
【详解】A.该反应是燃烧反应,放出能量,其中一部分以光的形式(苍白色火焰)体现出来,则,A项不符合题意;
B.该反应是放热反应,所以氢气和氯气的总能量高于氯化氢的总能量,B项不符合题意;
C.断裂化学键需要吸收能量,C项不符合题意;
D.形成化学键需要释放能量,D项符合题意;
故正确选项为D
7. 下列热化学方程式书写正确的是
A. 2SO2+O22SO3 ΔH=-196.6 kJ·ml-1
B. H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·ml-1
C. 2H2(g)+O2(g)===2H2O(l) ΔH=+ 571.6 kJ·ml-1
D. C(s)+O2(g)===CO2(g) ΔH=393.5 kJ
【答案】B
【解析】
【详解】A.方程式中没有注明物质的状态,物质的状态不同,所具有的能量也不同,故A错误;
B.符合热化学方程式的书写要求,故B正确;
C.氢气和氧气化合生成水的反应为放热反应,反应的△H应小于0,故C错误;
D.反应热的单位应为kJ/ml,不是kJ,故D错误;
答案选B。
【点睛】与普通化学方程式相比,书写热化学方程式应注意以下几点:
1.热化学方程式中各物质化学式前的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数。因此化学计量数以“ml”为单位,数值可以是小数或分数。
2.反应物和产物的聚集状态不同,反应热△H也不同。因此,必须注明物质的聚集状态,g( 气态)、l(液态)、S(固态)、aq(溶液),由于已经注明物质的聚集状态,所以热化学方程式中不用↓和↑。
3.反应热△H与测定条件如温度、压强等有关。因此书写热化学方程式应注明△H的测定条件。若不注明,则表示在298K、101325Pa下测定的。
4.在所写的化学方程式的右边写下△H的“+”与“-”、数值和单位,方程式与△H应用空格隔开。若为放热反应,△H为“-”,若为吸热反应,△H为“+”,由于△H与反应完成的物质的量有关,所以化学计量数必须与△H相对应。当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。△H的单位为kJ/ml。
8. 反应NH4HS(s)NH3(g)+H2S(g)在某一温度下达到平衡,下列各种情况中,能使化学平衡正向移动的是
A. 加入NH4HS固体B. 压强、温度不变,充入少量氩气
C. 容积、温度一定,充入氦气D. 温度、容积一定,充入H2S气体
【答案】B
【解析】
【详解】A.由于硫氢化铵是固体,不影响化学平衡,故A错误;
B.压强温度一定,充入少量氩气,体积增大,压强减小,平衡正向进行,故B正确;
C.容积、温度一定,充入氦气,各组分的浓度没有发生变化,化学平衡不移动,故C错误;
D.温度、容积一定,充入H2S气体,增大生成物浓度,化学平衡向着逆方向移动,故D错误;
故选B。
9. 下列离子方程式正确的是
A. 将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓
B. KMnO4与浓盐酸反应制Cl2:2+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O
C. 0.1mlCl2和100mL1ml/LFeBr2反应:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
D. 用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O
【答案】D
【解析】
【详解】A.当沉淀的质量恰好最大时,KAl(SO4)2溶液和Ba(OH)2溶液按物质的量之比为1:2反应,Al3+完全转化为[Al(OH)4]-,这时离子方程式是Al3++2+4OH-+2Ba2+=2BaSO4↓+[Al(OH)4]-,A错误;
B.浓盐酸应写成离子形式,离子方程式是2+16H++10Cl-=2Mn2++5Cl2↑+8H2O,B错误;
C.Fe2+的还原性强于Br-,由于Cl2的量不足,只能有一半的Br-被氧化,反应的离子方程式是:2Cl2+2Fe2++2Br-=4Cl-+2Fe3++Br2,C错误;
D.用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O,D正确;
答案选D。
10. 下列说法不正确的是
A. 对于有气体参加的反应,增大压强能提高单位体积内活化分子的数目
B. 弱电解质的电离平衡右移,电离平衡常数可能增大
C. 铅蓄电池放电时,正极与负极质量均增加
D. 升高温度能增大吸热反应反应速率,降低放热反应反应速率
【答案】D
【解析】
【详解】A.增大压强,容器的体积减小,使得单位体积内活化分子的数目增加,从而加快了反应速率,故A正确;
B.当温度升高时,电离平衡右移,电离产生的离子浓度增大,电离平衡常数增大,故B正确;
C.铅蓄电池的负极反应为:,反应前后负极质量增加;正极反应为:,反应前后正极质量也增加,故C正确;
D.升高温度能增大反应速率,无论是吸热反应还是放热反应速率均增大,故D错误;
故选:D。
11. 下列各组离子能大量共存,且溶液为无色透明的是
A K+、S2-、、H+B. 、H+、K+、Cl-
C. Ba2+、Na+、、OH-D. K+、、S2-、Na+
【答案】D
【解析】
【详解】A.S2-具有还原性,在酸性环境下具有强氧化性,因此会发生氧化还原反应而不能大量共存,故A项错误;
B.有颜色,且在酸性环境下存在平衡,因此不能大量共存,故B项错误;
C.、OH- 反应生成,与Ba2+反应生成BaCO3沉淀,不能大量共存,故C项错误;
D.各离子间不反应,故可大量共存于溶液中,且溶液为无色,故D项正确;
答案选D。
12. 在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3 ④Na2S,所含带电微粒的数目由多到少的顺序是
A. ①=④>③=②B. ①=④>③>②C. ①>④>③>②D. ④>①>③>②
【答案】D
【解析】
【详解】等体积等物质的量浓度的4种稀溶液,根据物质的量=浓度与体积的乘积,各溶质的物质的量相等。硫酸钠,亚硫酸氢钠和硫化钠是强电解质,在水中完全电离,硫酸钠和硫化钠中阳离子和阴离子个数比为2:1,亚硫酸氢钠中阳离子和阴离子个数比为1:1,所以硫酸钠和硫化钠的溶液中阴阳离子数大于亚硫酸氢钠溶液中的阴阳离子数,硫酸钠是强酸强碱盐,在水中不水解,硫化钠是强碱弱酸盐,在水中水解导致溶液中带电荷的微粒数增多,所以硫化钠溶液中的带电微粒数达于硫酸钠溶液中的带电微粒数,亚硫酸是弱电解质,只有部分电离,所以亚硫酸溶液中带电微粒数最少,所以顺序为④>①>③>②,选D。
13. 25℃时,下列溶液中有关微粒的物质的量浓度关系错误是
A. pH=4 的 0.1ml/L 的 NaHA 溶液:c(HA-)>c(H+)>c(A2-) >c(OH-) >c(H2A)
B. 10 mL0.1ml/LCH3COOH 溶液与 20mL0.1ml/lNaOH 混合后, 溶液中离子浓度关系:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
C. 两种醋酸溶液的物质的量浓度为c1 和c2,PH分别为a和a+1,则 c1Kb(NH3·H2O)>Ka2(H2CO3)
B. pH=13时,溶液中不存在的水解平衡
C. pH由8~11时, 不变
D pH=3时,有c()+c(NH3·H2O)=c()+c()+c(H2CO3)
【答案】C
【解析】
【分析】A、1.0ml/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,根据盐类越弱越水解的原理分析;
B、据图象分析,pH=13时仍有HCO3-;
C、为HCO3-的电离平衡常数表达式,其大小只受温度影响;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳。
【详解】A、根据越弱越水解原理,1.0ml/L NH4HCO3溶液pH=8.0,说明铵根水解程度小于碳酸氢根离子,应有Kb(NH3•H2O)>Ka(H2CO3)>Ka2(H2CO3),选项A错误;
B、只要存在碳酸氢根离子就存在HC03-的水解平衡,选项B错误;
C、温度不变,碳酸氢根离子的电离平衡常数不变,选项C正确;
D、pH=3时,NH4HCO3会与氢离子反应生成二氧化碳,所以c(NH4+)+c(NH3•H2O)>c(HCO3-)+c(CO32-)+c(H2CO3),选项D错误;
答案选C。
【点睛】本题考查了盐类水解、根据图象分析溶液组成、电离平衡常数影响因素等,题目难度不大,易错题为D,注意pH=3时,NH4HCO3会与氢离子反应生成二氧化碳。
二、解答题(共58分)
15. 2020年11月24日,长征五号运载火箭搭载嫦娥五号成功发射,开启中国探月新篇章。火箭常用的推进剂燃料有偏二甲肼()、肼()煤油等。
(1)用偏二甲肼()作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
①写出该反应的化学方程式:___________。
②反应物的总能量___________(填“大于”、“小于”或“等于”)生成物的总能量。
(2)肼在碱性环境下可以形成肼一空气燃料电池,肼被氧化为,该电池负极的反应式为___________,每生成要转移电子的物质的量为___________。
(3)肼类推进剂在使用过程中要注意进行环境监测以免造成环境污染。臭氧是理想的烟气脱硝试剂,其脱硝反应为,向甲、乙两个体积均为的恒容密闭容器中均充入和,分别在、温度下,经过一段时间后达到平衡。反应过程中随时间变化情况见下表:
①根据表格数据分析,该反应温度T1____T2。(填“”、“”或“”,下同)
②甲容器中,内的平均反应速率___________。
③乙容器中平衡转化率为___________。
④下列叙述能说明该反应达到化学平衡状态的是___________。
a.混合气体的平均相对分子质量不变b.
c. 与的转化率之比不变d. 混合气体密度不变
e. 容器内气体的总压强保持不变
(4)航天煤油是石油经过___________炼制的。
【答案】 ①. ②. 大于 ③. ④. ⑤. ⑥. ⑦. ⑧. a e ⑨. 分馏
【解析】
【分析】
【详解】(1) ①偏二甲肼()与四氧化二氮发生氧化还原反应,生成氮气和二氧化碳气体。该反应的化学方程式:。
②该反应能提供飞船飞行所需能量,故此反应为放热反应,则反应物的总能量大于生成物的总能量。
(2) 原电池中负极发生氧化反应,根据肼−空气燃料电池是一种碱性燃料电池,肼转化为氮气与水可知肼在负极发生氧化反应,该电池负极的反应式为,由电极方程式知,每生成1ml即28gN2转移4ml电子,则每生成要转移电子的物质的量为。
(3)①由表中数据可知,12s时甲容器已处于平衡、而乙还没有平衡,说明甲容器中温度高,即该反应温度T1T2。
②甲容器中,△n(O2)=0.36ml,根据方程式,△n(NO2)=0.72ml,则内的平均反应速率。
③从开始到平衡,乙容器中,△n(O2)=0.85ml,根据化学方程式,△n(O3)=0.85ml,平衡转化率为。
④a.反应前后气体的化学计量数之和不等,混合气体的总质量不变,若混合气体的平均相对分子质量不再改变,说明混合气体的总物质的量不变,即反应达到化学平衡状态,故a选;
b.均指正反应速率,任何时候都正确,不能说明反应达到化学平衡状态,故b不选;
c.恒容密闭容器中充入和,等于化学计量数之比,则与的转化率之比始终不变,不能说明反应达到化学平衡状态,故c不选;
d.混合气体的总质量不变,恒容密闭容器则气体体积不变,所以密度始终不变,混合气体的密度不再改变无法判断反应是否达到化学平衡状态,故d不选,
e.反应中,气体的物质的量、压强会随着反应而变化,故容器内压强不随时间的变化,说明气体的物质的量不随时间变化,则说明反应已达平衡,故e选;
则答案为a e。
(4) 石油分馏得到汽油、煤油、柴油等产品,航天煤油是石油经过分馏炼制的。
16. 如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是____;
(2)做一次完整的中和热测定实验,温度计需要使用______次;
(3)实验中用50mL 0.5ml·L-1盐酸与50mL 0.5ml·L-1NaOH反应,各溶液密度均为1g·cm-3,水及溶液的比热均视为4.18J·g-1·℃-1,实验起始温度为T1℃,最终温度为T2℃。试写出中和热的计算式ΔH=____;
(4)实验中改用60 mL 0.50ml·L-1 HCl跟50 mL 0.55ml·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会____(填“偏大”“偏小”或“无影响”)。
【答案】 ①. 环形玻璃搅拌棒 ②. 3 ③. 16.72(T2-T1) kJ/ml ④. 不相等 ⑤. 相等 ⑥. 偏小
【解析】
【详解】(1)实验时,应使用环形玻璃搅拌棒,以使反应充分进行,故缺少的玻璃仪器为环形玻璃搅拌棒;
(2)中和热测定实验中需要温度计测量酸、碱和反应后的最高温度3次,故共需要使用3次;
(3)将两溶液混合后,溶液质量为100g,反应所放出的热量Q=cmΔt=4.18J·g-1·℃-1×100g×(T2-T1)℃=418(T2-T1) J,此时反应生成的水的物质的量为0.025ml,当反应生成1ml水时的中和热ΔH==16720(T2-T1) J,故酸碱中和反应的ΔH=16720(T2-T1) J/ml=16.72(T2-T1) kJ/ml;
(4)反应放出的热量和所用酸以及碱的用量有关,用60 mL 0.50ml·L-1 HCl跟50 mL 0.55ml·L-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热均是强酸和强碱反应生成1ml水放出的热量,与酸碱用量无关,所以60 mL 0.50ml·L-1 HCl跟50 mL 0.55ml·L-1 NaOH溶液进行上述实验,测得的中和热的数值相等,故答案为:不相等、相等;
(5)NH3为弱碱,电离过程为吸热过程,所以用氨水代替稀NaOH溶液反应,反应放出的热量小于中和热的数值,故答案为:偏小。
17. 某工厂使用石油热裂解副产物CH4来制取H2,其生产流程如图所示:
(1)第II步反应为CO(g)+H2O(g)⇌H2(g)+CO2(g) ΔH”、“0)mlC2H4和2mlCH4,在T1K、p1kPa下进行上述反应。为了使该反应逆向进行,a的范围为_____________________。
(3)该实验小组在研究过程中得出固体表面催化裂解甲烷时,几种气体平衡时分压(Pa)与温度(°C)的关系如图2所示。
副反应为2CH4(g)⇌C2H2(g)+3H2(g) ΔH=+376.4kJ·ml-1。温度高于1145℃时,C2H2(g)的平衡分压高于C2H4(g);温度低于1145℃时,C2H4(g)的平衡分压高于C2H2(g),其原因是______________。
【答案】(1)+114.8
(2) ①. 50% ②. > ③. KM>KN=KQ ④. ⑤. a>1
(3)不同温度下催化剂的选择性不同,温度高于1145℃以C2H2为主,温度低于1145℃以C2H4为主
【解析】
【小问1详解】
已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·ml-1;②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH2=-1323.8kJ·ml-1;③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·ml-1;根据盖斯定律,由①×2-②-③可得热化学方程式2CH4(g)⇌C2H4(g)+2H2(g) ΔH=ΔH1×2-ΔH2-ΔH3=+。
【小问2详解】
①在某密闭容器中投入1mlCH4(g),在不同条件下发生反应:2CH4(g)⇌C2H4(g)+2H2(g),M点n(C2H4)=0.25ml,则CH4的转化率为=50%,由(1)可知该反应是吸热反应,升高温度,平衡正向移动,CH4的转化率增大,则温度:T1>T2;
②由(1)可知该反应是吸热反应,升高温度,平衡正向移动,平衡常数增大,由M、N、Q三点温度的大小关系可知,三点的平衡常数由大到小的顺序为KM>KN=KQ;
③根据已知条件列出“三段式”:
设反应起始总压为p1,则反应平时总压为p1×=1.25p1,压强平衡常数Kp=;
④若在某密闭容器中充入2mlH2、a(a>0)mlC2H4和2mlCH4,Qp=,为了使该反应逆向进行,Qp>Kp,则,a>1。
【小问3详解】
由图可知,不同温度下催化剂的选择性不同,温度高于1145℃以C2H2为主,温度低于1145℃以C2H4为主。
19. 完成下列问题
(1)向某体积固定的密闭容器中加入0.3mlA、0.1mlC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。
已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:
①若,则内反应速率_______。
②写出该反应的化学方程式:________。
(2)已知部分化学键的键能如表:
①已知生成1ml放出46kJ热量,则____。
②已知工业合成氨反应,在恒温(200℃)、恒容条件下,下列描述能作为判断t时刻合成氨反应达到化学平衡状态的依据有____ (填序号)。
A.t时刻N2、H2、NH3的浓度不再改变
B.t时刻及其前后容器内气体的密度不再改变
C.t时刻及其前后容器内气体的平均相对分子质量相等
D.t时刻断裂的H−H键数目和生成的N−H键数目相等
③不同催化剂下合成氨反应的历程如下图所示,吸附在催化剂表面的物质用“*”表示。催化剂的催化效果更好的是____(填“A”或“B”)。
【答案】(1) ①. 0.006ml/(L•s ) ②. 3A(g)B(g)+2C(g)
(2) ①. 391 ②. AC ③. B
【解析】
【小问1详解】
①从图中看出,C的浓度变化量为0.11ml/L -0.05ml/L =0.06ml/L,反应速率为:=0.006 ml/(L•s );
②在反应过程中混合气体的平均相对分子质量没有变化,说明反应前后气体分子数不变,从图中看出A的浓度减少,A为反应物,C的浓度增加,C为生成物,相同时间(t0-t1)A的浓度与C的浓度变化之比为0.09:0.06=3:2,由于反应前后气体分子数不变,故反应方程式为:3A(g)B(g)+2C(g);
【小问2详解】
①反应的焓变等于反应物键能和减去生成物的键能和,已知生成1mlNH3放出46kJ热量,即热化学方程式:N2(g)+3H2(g)2NH3(g),则(946+3×436) kJ/ml -6a=-92kJ/ml,则a=391;
②A.t时刻N2、H2、NH3的浓度不再改变,说明正逆反应速率相等,能说明反应达到化学平衡,A符合题意;
B.已知反应体系中均为气体,容器体积不变,则反应过程中反应体系的气体密度一直保持不变,故t时刻及其前后容器内气体的密度,不能说明化学反应达到平衡状态,B不合题意;
C.已知合成氨反应正反应是一个气体体积减小的方向,即反应过程中恒容容器中气体质量不变,物质的量改变,即平均相对分子质量改变,故t时刻及其前后容器内气体的平均相对分子质量不变,说明反应达到化学平衡,C符合题意;
D.断裂H-H表示正反应,生成N-H表示正反应,故t时刻断裂的H―H键数目和生成的N―H键数目相等,不能说明反应达到化学平衡,D不合题意;
故答案为:AC;
③活化能越低催化效果越好,有图可知B催化剂活化能低,则B的催化效果更好。0
3
6
12
24
36
甲容器()
0
0.36
0.60
0.80
0.80
0.80
乙容器()
0
0.30
0.50
0.70
0.85
0.85
温度T/℃
400
500
830
1000
平衡常数K
10
9
1
0.6
化学键
N≡N
H−H
N−H
键能/()
946
436
a
相关试卷
这是一份四川省泸州市泸化中学2024-2025学年高一上学期期中化学试卷(Word版附解析),文件包含四川省泸州市龙马潭区泸化中学2024-2025学年高一上学期11月期中化学试题Word版含解析docx、四川省泸州市龙马潭区泸化中学2024-2025学年高一上学期11月期中化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份精品解析:四川省泸州市龙马潭区泸化中学2024-2025学年高一上学期11月期中化学试题,文件包含精品解析四川省泸州市龙马潭区泸化中学2024-2025学年高一上学期11月期中化学试题原卷版docx、精品解析四川省泸州市龙马潭区泸化中学2024-2025学年高一上学期11月期中化学试题解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份四川省内江市威远中学2024-2025学年高二上学期期中考试化学试卷(Word版附解析),文件包含四川省内江市威远中学校2024-2025学年高二上学期期中考试化学试题Word版含解析docx、四川省内江市威远中学校2024-2025学年高二上学期期中考试化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共28页, 欢迎下载使用。









