

精品解析:北京市北京师范大学第二附属中学2024-2025学年高二上学期期中考试化学试题
展开一、每小题只有一个选项符合题意,每题3分
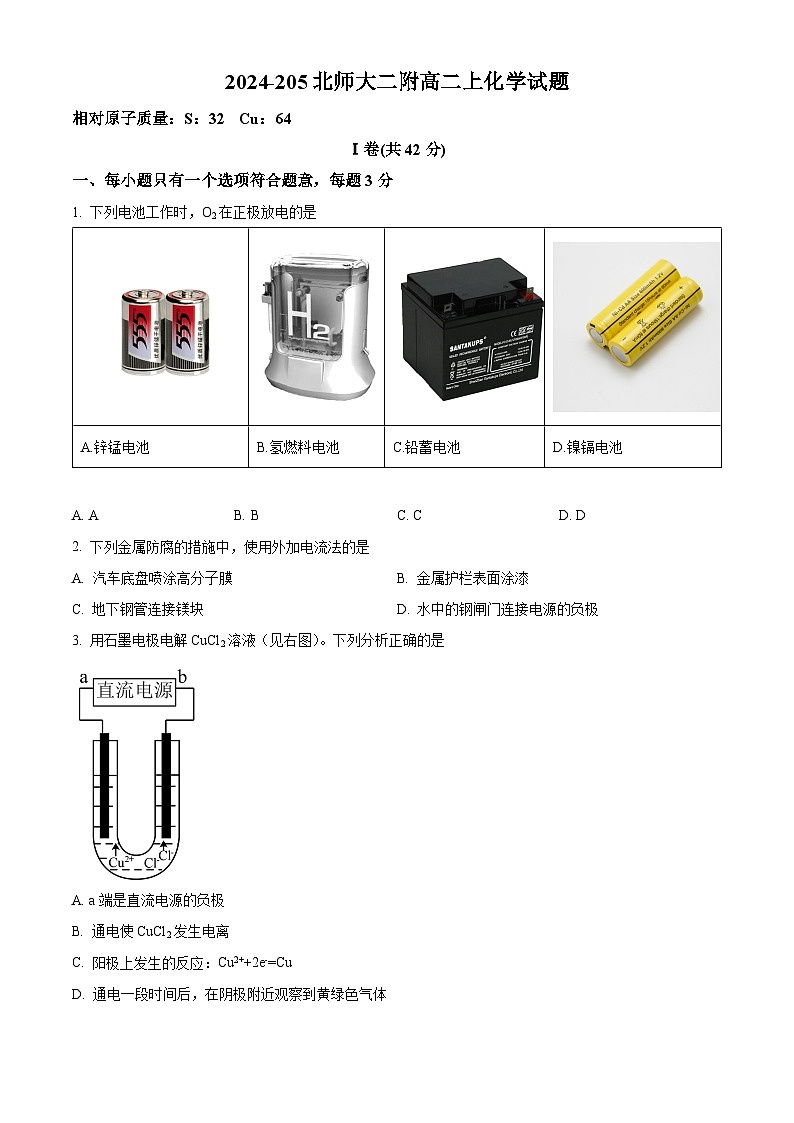
1. 下列电池工作时,O2在正极放电的是
A. AB. BC. CD. D
【答案】B
【解析】
【详解】A.锌锰干电池中电极反应式,负极反应为Zn-2e-═Zn2+,正极反应为2MnO2+2+2e-=Mn2O3+2NH3+H2O,故A错误;
B.酸性氢氧燃料电池电极反应式为2H2-4e-=4H+、O2+4H++4e-=2H2O,碱性氢氧燃料电池电极反应式为2H2-4e-+4OH-=4H2O、O2+2H2O+4e-=4OH-,故B正确;
C.铅蓄电池放电时负极电极反应为Pb-2e-+=PbSO4 ,正极电极反应为PbO2+2e-+4H++=PbSO4+2H2O,故C错误;
D.镍镉电池放电正极反应为2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-,负极反应为Cd+2OH--2e-=Cd(OH)2,故D错误;
故答案选B。
2. 下列金属防腐的措施中,使用外加电流法的是
A. 汽车底盘喷涂高分子膜B. 金属护栏表面涂漆
C. 地下钢管连接镁块D. 水中的钢闸门连接电源的负极
【答案】D
【解析】
【详解】A.汽车底盘喷涂高分子膜阻止了铁与空气、水的接触,从而防止金属铁防锈,没有连接外加电源,A不符合题意;
B.金属护栏表面涂漆使金属和空气、水等物质隔离而防止生锈,没有连接外加电源,B不符合题意;
C.镁的活泼性大于铁,用牺牲镁块的方法来保护地下钢管而防止铁被腐蚀,属于牺牲阳极的阴极保护法,C不符合题意;
D.水中的钢闸门连接电源负极,阴极上得电子被保护,所以属于使用外加电流的阴极保护法,D符合题意;
故选D。
3. 用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
A. a端是直流电源的负极
B. 通电使CuCl2发生电离
C. 阳极上发生的反应:Cu2++2e-=Cu
D. 通电一段时间后,在阴极附近观察到黄绿色气体
【答案】A
【解析】
【详解】A、依据装置图可知,铜离子移向电极为阴极,阴极和电源负极相连,a为负极,故A正确;
B、通电氯化铜发生氧化还原反应生成氯气和铜,电离是氯化铜离解为阴阳离子,故B错误;
C、与b连接的电极是阳极,氯离子失电子发生氧化反应,电极反应式为:2Cl﹣﹣2e﹣=Cl2↑,故C错误;
D、通电一段时间后,氯离子在阳极失电子发生氧化反应,在阳极附近观察到黄绿色气体,故D错误;
故选A.
4. 下列实验事实不能用平衡移动原理解释的是
A.
B.
C.
D.
【答案】C
【解析】
【分析】勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该过程必须是可逆过程,否则勒夏特列原理不适用。
【详解】A.氨水浓度变为原来的,溶液pH的改变小于1,是因为氨水中存在一水合氨的电离平衡,浓度越稀,电离程度越大,稀释后的c(OH-)大于原来的,能用平衡移动原理解释,A不符合题意;
B.水的电离是可逆过程,电离吸热,升高温度促进水的电离,Kw增大,能用平衡移动原理解释,B不符合题意;
C.加入少量硫酸铜后,锌置换出铜,形成锌铜原电池,反应速率加快,不能用平衡移动原理,C符合题意;
D.溶液中存在,增加氯离子的量,平衡正向移动,溶液从蓝色变成绿色,能用平衡移动原理解释,D不符合题意;
答案选C。
5. NO2和N2O4存在平衡:2NO2(g)⇌N2O4(g) △H<0。下列分析正确的是
A. 1 ml平衡混合气体中含1 ml N原子
B. 断裂2 ml NO2中的共价键所需能量小于断裂1 ml N2O4中的共价键所需能量
C. 恒温时,缩小容积,气体颜色变深,是平衡正向移动导致的
D. 恒容时,水浴加热,由于平衡正向移动导致气体颜色变浅
【答案】B
【解析】
【详解】A.1mlNO2含有1mlN原子,1mlN2O4含有2mlN原子,现为可逆反应,为NO2和N2O4的混合气体,1 ml平衡混合气体中所含N原子大于1 ml 小于2ml ,A项错误;
B.反应2NO2(g)⇌N2O4(g)为放热反应,反应热=反应物总键能-生成物总键能,故完全断开2mlNO2分子中的共价键所吸收的热量比完全断开1mlN2O4分子中的共价键所吸收的热量少,B项正确;
C.气体体积压缩,颜色变深是因为体积减小,浓度变大引起的,C项错误;
D.放热反应,温度升高,平衡逆向移动,颜色加深,D项错误;
答案选B。
6. 下列关于醋酸溶液的说法正确的是
A. 等pH的盐酸和醋酸溶液分别与NaOH溶液反应,所消耗NaOH的物质的量:HCl>
B. 等物质量浓度的盐酸和醋酸溶液分别与足量Mg反应,产生的体积(标况):HCl>
C. pH=3的醋酸溶液加水稀释10倍,pH>4
D. 室温下,pH=3的醋酸溶液中,由水电离出的
【答案】D
【解析】
【详解】A.醋酸是一元弱酸,HCl是一元强酸,等pH的醋酸溶液和盐酸溶液中c(CH3COOH)>c(HCl),相同体积的两溶液中n(CH3COOH)>n(HCl),分别与NaOH溶液反应,消耗NaOH的物质的量:CH3COOH>HCl,故A错误;
B.醋酸是一元弱酸,HCl是一元强酸,由于盐酸和醋酸溶液的体积关系未知,无法计算等物质量浓度的盐酸和醋酸溶液分别与足量Mg反应,产生体积的关系,故B错误;
C.醋酸是弱电解质,醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,pH=3的醋酸溶液加水稀释10倍后氢离子浓度:0.0001ml/L<c(H+)<0.001ml/L,则溶液的pH<4,故C错误;
D.室温下,pH=3的醋酸溶液中,水的电离被抑制,溶液中的OH-全部是由水电离出来的,由水电离出的,故D正确;
故选D。
7. 溶液与稀硫酸反应的化学方程式为,某小组设计如下实验探究影响该反应速率的因素,结合实验数据判断正确的是
A. x=10
B. 依据实验①③可探究反应温度对反应速率的影响
C. 各组实验反应中最先变浑浊的是②
D. 实验②中t min时生成了0.016g S,则t min内的平均反应速率为ml/(L•min)
【答案】D
【解析】
【详解】A.根据变量控制法,各组的体积不变,故有5+10+x=5+5+10,x=5,故A错误;
B.实验①③温度不同,Na2S2O3浓度不相同,不可以探究温度对反应速率的影响,故B错误;
C.四组实验中实验③温度较高,反应物浓度最高,速率最大,最先变浑浊,故C错误;
D.实验②中,,反应消耗tmin,平均反应速率v(Na2S2O3)=ml/(L•min),故D正确;
答案选D。
8. 如图为电镀实验装置,下列有关叙述不正确的是
A 电镀时,待镀铁制品应与直流电源负极相连
B. 通电后,溶液中的移向阳极
C. 镀铜时,理论上阳极和阴极的质量变化相等
D. 待镀铁制品增重0.64g,电路中通过的电子为0.01ml
【答案】D
【解析】
【分析】电镀时,镀层金属作阳极,镀件作阴极。待镀铁制品作阴极发生还原反应,铜片作阳极发生氧化反应。
【详解】A.电镀时,镀层金属作阳极,镀件作阴极,待镀铁制品作阴极应与直流电源负极相连,A正确;
B.电镀时溶液中的阴离子移向阳极,故移向阳极,B正确;
C.镀铜时,阴极发生还原反应;铜片作阳极发生氧化反应,理论上阳极减少的铜和阴极的增加的铜的质量相等,C正确;
D.待镀铁制品增重0.64g,即阴极生成的铜为0.01ml,根据电极反应式可知电路中通过的电子为0.02ml,D错误;
故答案为:D。
9. 已知(橙色)(黄色),BaCrO4难溶,BaCr2O7可溶。下列实验叙述不正确的是
A. 向溶液中加少量的浓硫酸,浓度增大
B. 向溶液中加少量固体会使溶液的pH升高
C. 为使溶液变成黄色,可加入少量KOH固体
D. 交警检查司机是否酒后驾车,常根据所用检测仪中的酸性与乙醇反应前后颜色变化来判断,该反应利用的是的氧化性
【答案】B
【解析】
【详解】A.向溶液中加少量的浓硫酸,溶液中c(H+)增大,平衡逆向移动,浓度增大,A正确;
B.向溶液中加少量固体,生成BaCrO4沉淀,平衡正向移动,溶液中c(H+)增大,会使溶液的pH降低,B不正确;
C.为使溶液变成黄色,加入少量KOH固体,溶解后中和H+,使平衡正向移动,浓度减小,浓度增大,溶液变为黄色,C正确;
D.检测仪中的酸性与乙醇反应,溶液由橙色变为绿色,表明被乙醇还原,该反应利用的是的氧化性,D正确;
故选B。
10. 如图是某压强下,与按体积比1:3投料时,反应混合物中氨的体积分数随温度的变化曲线。其中一条是经过一定时间反应后的曲线,另一条是平衡时的曲线。下列说法不正确的是
A. 图中曲线Ⅰ是平衡时的曲线
B. 图中c点,v(正)>v(逆)
C. 图中b点,容器内气体
D. 550℃后曲线Ⅱ下降的原因可能是催化剂活性下降
【答案】C
【解析】
【分析】条件相同的情况下,平衡状态时氨气的体积分数应该是最大的,因此I表示平衡时的曲线,II表示经过一定时间反应后的曲线。
【详解】A.根据分析可知,曲线I表示平衡时的曲线,A正确;
B.从图中可知,c点温度下,氨气的体积分数小于该温度下平衡状态时的体积分数,说明此时反应还在正向进行,v(正)>v(逆),B正确;
C.图中b点氨气的体积分数为25%,不妨令开始时氮气和氢气的物质的量为1ml和3ml,设反应消耗氮气xml,则消耗氢气3xml,生成氨气2xml,平衡时气体总物质的量为(4-2x)ml,氨气的体积分数为2x÷(4-2x)=0.25,解得x=0.4ml,此时容器中氮气和氨气的物质的量之比为3:4,C错误;
D.550℃以后曲线II下降,可能的原因高温导致催化剂活性降低,使得反应速率减小,氨气的体积分数减小,D正确;
故答案选C。
11. 已知H―H的键能为I―I的键能为反应经历了如下反应历程:①,②,反应过程的能量变化如图所示。下列说法正确的是
A. H―I的键能为
B. 升高温度,反应①速率增大,反应②速率减小
C. 升高温度,反应②的限度和速率均增大,有利于提高的转化率
D. 为防止反应过程中有大量累积,应选择合适的催化剂降低反应②的焓变
【答案】A
【解析】
【详解】A.由图可知,,设H―I的键能为x,则,可得,,故A正确;
B.升高温度,反应速率加快,正反应①、反应②反应速率都加快,故B错误;
C.由图可知,反应②为放热反应,升高温度,反应②速率增大,平衡逆向移动,的转化率降低,故C错误;
D.为防止反应过程中有大量累积,应选择合适的催化剂降低反应②的活化能,加快反应,故D错误;
答案选A。
12. 在通风橱中进行下列实验:
下列说法不正确的是
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化膜,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【答案】C
【解析】
【分析】I中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮;Ⅱ中Fe遇浓硝酸钝化,表面形成致密的氧化层,阻止Fe进一步反应,所以产生少量红棕色气泡后,迅速停止;Ⅲ中构成原电池,Fe作为负极,且Fe与浓硝酸直接接触,会产生少量二氧化氮,Cu作为正极,发生得电子的反应,生成二氧化氮。
【详解】A.I中铁和稀硝酸生成一氧化氮,一氧化氮遇空气生成二氧化氮,化学方程式为: 2NO+O2=2NO2,A正确;
B.常温下,Fe遇浓硝酸易钝化,表面形成致密的氧化层,阻止Fe进一步反应,B正确;
C.对比Ⅰ、Ⅱ中现象,实验Ⅱ反应停止是因为发生了钝化,不能用来比较浓HNO3和稀HNO3的氧化性强弱,物质氧化性强弱只能通过比较物质得电子能力强弱来分析,C错误;
D.Ⅲ中构成原电池,在Fe、Cu之间连接电流计,可判断Fe是否持续被氧化,D正确;
故选C。
13. 一种高性能的碱性硼化钒()—空气电池如下图所示。电池的总反应为:,该电池工作时,下列说法不正确的是
A. 电子由电极经外电路流向复合碳电极
B. 正极室溶液的pH降低、负极室溶液的pH升高
C. 电极发生反应:
D. 若有0.112L(标准状况)参与反应,有0.02ml 通过阴离子交换膜移到负极
【答案】B
【解析】
【分析】根据图示的电池结构,电池的总反应为:,左侧VB2发生失电子的反应生成和,为负极,反应的电极方程式为: ,右侧空气中的氧气发生得电子的反应生成OH-,为正极,反应的电极方程式为O2+4e-+2H2O=4OH-,据此分析。
【详解】A.原电池中,电子由负极流向正极,故电子由VB2电极经负载流向复合碳电极,A正确;
B.反应过程中正极生成大量的OH-使正极区pH升高,负极消耗OH-使负极区OH-浓度减小pH降低,B错误;
C.根据分析,电极发生反应:,C正确;
D.若有0.112L(标准状况,为0.005ml)O2参与反应,由O2+4e-+2H2O=4OH-可知转移电子0.02ml,会有0.02mlOH-通过阴离子交换膜移到负极,D正确;
故选B。
14. 以、为原料合成涉及的主要反应如下:
①
②
的平衡转化率()、的选择性()随温度、压强变化如下:
已知:
下列分析不正确是
A.
B. 400℃左右,体系发生的反应主要是②
C. 由图可知,,
D. 初始、,平衡后、,若只发生①、②,则的平衡转化率为24%
【答案】D
【解析】
【详解】A.反应①的正反应为气体体积减小的方向,反应②反应前后气体体积不变,故增大压强,反应①正向移动,CO2的转化率增大,反应②不移动,因此 P1>P2,A正确;
B.400℃时,由图可以看出, CH3OH 的选择性趋近为0,意味着转化为CH3OH的CO2为0,因此此时体系发生的反应主要是②,B正确;
C.由图看出,随着温度升高,的选择性()逐渐降低,反应①向逆方向进行,因此正反应<0;同时,随着温度升高,前期的平衡转化率()逐渐降低,此阶段体系发生的反应主要是反应①,后期的平衡转化率()逐渐升高,此阶段体系发生的反应主要是反应②,因此>0,C正确;
D .平衡后,根据CO2的平衡转化率为30%,得出两个反应共消耗0.3ml CO2,又因为可知0.3ml CO2中有80%发生反应①转化为CH3OH,而0.3ml CO2中有20%发生反应②转化为CO,根据三段式可得:
,
两个反应中氢气的转化总量为0.78ml,所以氢气的转化率=,D错误;
故答案为:D。
Ⅱ卷(共58分)
15. 改进工艺,降低能耗是氯碱工业发展的重要方向。
(1)写出氯碱工业原理的离子方程式___________。
(2)将氢燃料电站应用于氯碱工业,其示意图如下:
①a极的电极反应式为:___________。
②下列关于乙装置说法中,正确的是___________。
A.在c极区获得氯气 B.在d极区获得的产物,可供甲装置使用
C.乙装置中向c极移动
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用___________。
(4)向乙装置中的阴极区通入,能够替代水中的H+获得电子,降低电解电压,减少电耗。写出在阴极区发生反应的电极反应式___________。
(5)杂质离子可造成交换膜损伤,导致迁移至阳极区,对产品质量造成不良影响。请结合化学用语说明原因___________(写出2点)。
(6)用下图所示的装置模拟更换电极材料电解氯化钠溶液,请回答下列问题。
①a、d处试纸变___________色。
②b处变红,局部褪色,请结合化学用语解释___________。
③开始反应时c无明显,此时发生反应的电极方程式为___________。
【答案】(1)
(2) ①. ②. AB
(3)Cl2+H2OHCl+HClO,用盐酸控制阳极的pH,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集
(4)
(5)若氢氧根迁移至阳极区,会代替Cl-失电子,生成氧气,使氯气不纯;也可能在阳极区氢氧根与氯气反应生成氯化钠和次氯酸钠,减少氯气产量
(6) ①. 蓝 ②. 石墨(b)电极氯离子失去电子生成Cl2,2Cl--2e-=Cl2↑,Cl2+H2OHCl+HClO,盐酸显酸性,次氯酸具有漂白性,故b处变红,局部褪色 ③. Fe-2e-=Fe2+
【解析】
【小问1详解】
氯碱工业原理是采用电解食盐水的方法产生氯气和烧碱,故称为氯碱工业,离子方程式;
【小问2详解】
由图甲可知,甲装置为氢氧碱性燃料电池,通入燃料 H2 的a电极为负极,通入空气(O2)的b电极为正极,则c为阳极,d为阴极;
①负极电极反应为;
②A.根据分析,c电极为阳极,发生氧化反应,即,故A正确;
B.根据分析,d电极为阴极,发生还原反应,即,获得氢气可以继续供给甲装置使用,故B正确;
C.c为阳极,d为阴极,阳离子移向阴极,向d电极移动,故C错误;
故选AB;
【小问3详解】
阳极产生的氯气,氯气能够溶于水,存在着下列平衡,Cl2+H2OHCl+HClO,加入盐酸,增大氢离子浓度,平衡逆向移动,有利于氯气逸出收集;
【小问4详解】
若向乙装置阴极区通入氧气,氧气得电子生成氢氧根,其电极反应式为;
【小问5详解】
杂质离子可造成交换膜损伤,导致迁移至阳极区,对产品质量造成不良影响,原因为若氢氧根迁移至阳极区,会代替Cl-失电子,生成氧气,使氯气不纯;也可能在阳极区氢氧根与氯气反应生成氯化钠和次氯酸钠,减少氯气产量;
【小问6详解】
石墨电极阳极,铁电极为阴极,则c为阳极,d为阴极,石墨(b)电极氯离子失去电子生成Cl2,2Cl--2e-=Cl2↑,c电极发生Fe-2e-=Fe2+,a、d电极发生2H2O+O2+4e-=4OH-。
①a、d电极发生2H2O+O2+4e-=4OH-,a、d处试纸变蓝色。
②b处变红,局部褪色,原因为石墨(b)电极氯离子失去电子生成Cl2,2Cl--2e-=Cl2↑,Cl2+H2OHCl+HClO,盐酸显酸性,次氯酸具有漂白性,故b处变红,局部褪色。
③开始反应时c无明显现象,此时发生吸氧腐蚀,反应的电极方程式为Fe-2e-=Fe2+。
16. 某小组同学研究了如下酸、碱、盐之间的反应,请回答下列问题。
(1)反应在室温下可自发进行,则该反应的ΔH___________0(填“>”、“=”或“<”)。
(2)常温下,用0.10 NaOH溶液分别滴定20.00mL 0.10 HCl溶液和20.00mL 0.10 溶液,得到两条滴定曲线,如图所示。
①Ⅰ表示滴定醋酸的曲线,理由是___________。
②b点溶液中,___________(填“>”、“=”或“<”)。
③下列有关a处溶液的说法正确的是___________。
A.溶质为、
B.
C.
④滴定时若选用酚酞为指示剂,滴定终点的现象是___________。
(3)已知,常温下几种酸的电离平衡常数如下表:
①常温下,0.1ml/L的HCN溶液中,约为___________。
②根据电离平衡常数判断,以下反应不能由发进行的是___________。
A.
B.
C.
(4)实验室常用酸碱中和滴定法测定尿素样品含氮量(氮的质量分数)。
步骤ⅳ中标准NaOH溶液浓度和消耗的体积分别为c和V,计算样品含氮量还需要的实验数据有___________。
【答案】(1)< (2) ①. 属于弱酸、不能完全电离, 0.10 溶液中氢离子浓度小于0.10,所以起点pH大于1 ②. = ③. A ④. 滴入最后半滴氢氧化钠溶液时,锥形瓶内溶液由无色变为浅红色、30秒内不褪色
(3) ①. ②. B
(4)尿素样品的质量、步骤ⅲ中所加硫酸溶液的体积和浓度
【解析】
【小问1详解】
是气体体积减小的熵减反应,根据复合判据ΔG=ΔH-TΔS<0,在常温下能自发进行,则该反应ΔH<0。
【小问2详解】
①Ⅰ表示滴定醋酸的曲线,理由是:醋酸属于弱酸、不能完全电离, 0.10 溶液中氢离子浓度小于0.10,所以起点pH大于1。
②20.00mL 0.10 NaOH溶液与20.00mL 0.10 HCl溶液恰好完全中和,所以b点溶液为氯化钠溶液,呈中性,=。
③V(NaOH)=10.00mL时所得为a处溶液,生成的醋酸钠与剩余醋酸浓度相等,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),下列有关:
A.溶质为、,正确;
B.据分析,c(CH3COO-)>c(Na+)>c(H+)>c(OH-),错误;
C.按物料守恒可得,错误;
选A。
④氢氧化钠和盐酸恰好反应呈中性,氢氧化钠和醋酸恰好反应生成醋酸钠溶液,溶液呈碱性,则滴定时若选用酚酞为指示剂,滴定终点的现象是:滴入最后半滴氢氧化钠溶液时,锥形瓶内溶液由无色变为浅红色、30秒内不褪色。
【小问3详解】
根据酸的电离平衡常数可知,酸性强弱顺序为:HCOOH>H2CO3>HCN>;
①常温下,0.1ml/L的HCN溶液中,,,。
②根据电离平衡常数判断,以下反应不能由发进行的是:
A.酸性强弱顺序为:HCOOH>H2CO3>HCN>,根据强酸制弱酸原理,可以发生,正确;
B.H2CO3溶液和NaCN溶液反应的离子方程式为:H2CO3 + CN- = HCN +,不能发生,错误;
C.少量甲酸可以和碳酸根发生,正确;
选B。
【小问4详解】
由题给流程可知,将尿素样品中氮元素全部转变为氨气,加入过量硫酸吸收反应生成的氨气,并用氢氧化钠溶液滴定过量的硫酸,并依据实验所得数据计算尿素样品含氮量。
已知步骤ⅳ中标准氢氧化钠溶液的浓度和消耗的体积分别为c和V,可据此计算出过量的硫酸的物质的量,只要知道步骤ⅲ中所加硫酸溶液的体积和浓度,即可计算出逸出的全部氨气的物质的量,再根据尿素样品的质量,即可计算样品含氮量。故计算样品含氮量还需要的实验数据为尿素样品的质量、步骤ⅲ中所加硫酸溶液的体积和浓度。
17. 二甲醚()是一种洁净液体燃料,工业上以CO和为原料生产。工业制备二甲醚在催化反应室中(压强:2.0~10.0MPa,温度:230~280℃)进行下列反应:
反应ⅰ:
反应ⅱ:
(1)①在该条件下,若反应ⅰ的起始浓度分别为,,8min后达到化学平衡状态,CO的转化率为50%,则8min内CO的平均反应速率为___________。
②反应ⅰ的CO平衡转化率与温度、压强的关系如下图所示,图中X代表___________(填“温度”或“压强”),简述理由:___________。
(2)在t℃时,反应ⅱ的平衡常数为400,此温度下,反应到某时刻测得各组分的物质的量浓度如下表:
此时刻反应ⅱ的v(正)___________(填“>”“<”或“=”)v(逆)。
(3)在使用催化剂、压强为5.0MPa、反应时间为10分钟的条件下,通过反应ⅰ、ⅱ制备,结果如下图所示,260℃时CO转化率高但产率很低的原因可能是___________。
(4) ,利用和计算时,还需要利用___________反应的ΔH。
【答案】(1) ①. 0.075ml∙L−1∙min−1 ②. 温度 ③. CO的平衡转化率随温度升高而减小、随压强增大而增大
(2)< (3)反应ⅰCO转化成的速率快,但反应ⅱ转化成的速率慢,因此在固定时间内CO转化率高但产率很低
(4)CO(g)+H2O(g)=CO2(g)+H2(g)
【解析】
【小问1详解】
①根据题给数据,CO的反应量为1.2ml/L×50%=0.6ml/L,则8min内CO的平均反应速率为:v(CO)==0.075ml∙L−1∙min−1;
②该反应为总体积减小的放热反应,CO的平衡转化率随温度升高而减小、随压强增大而增大,则图中X代表温度;
【小问2详解】
该时刻反应的浓度熵为:Q=>400,反应逆向进行,所以,v正<v逆;
【小问3详解】
ⅰ
ⅱ
CO的转化主要体现在ⅰ的进行,据图推测,反应ⅰ是快反应,很快达到平衡,因此,CO转化率实际上就是平衡转化率随温度的变化;但是反应ⅱ由合成是个慢反应,的产率既与CO平衡转化率有关,也与自身速率有关。温度越高,CO平衡转化率越低,但是反应ⅱ速率越快,因此在不同温度范围内呈现不同的变化规律。根据上述分析,260℃时CO转化率高但产率很低的原因可能是反应ⅰCO转化成的速率快,但反应ⅱ转化成的速率慢,因此在固定时间内CO转化率高但产率很低。
【小问4详解】
ⅰ
ⅱ
ⅲ
根据盖斯定律,ⅲ-ⅱ-2×ⅰ得CO(g)+H2O(g)=CO2(g)+H2(g),故需要CO(g)+H2O(g)=CO2(g)+H2(g)得ΔH。
18. 为探讨化学平衡移动原理与氧化还原反应规律的联系,某同学通过改变浓度研究“”反应中和的相互转化。实验如下:
(1)待实验Ⅰ溶液颜色不再改变时,再进行实验Ⅱ,目的是使实验Ⅰ的反应达到___________。
(2)ⅲ是ⅱ的对比实验,目的是排除ⅱ中___________造成的影响。
(3)ⅰ和ⅱ的颜色变化表明平衡逆向移动,向转化。用化学平衡移动原理解释原因:___________。
(4)根据氧化还原反应的规律,该同学推测ⅰ中向转化的原因:外加使降低,导致的还原性弱于。用右图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转。b作___________极。
②当指针归零(反应达到平衡)后,向U形管左管中滴加0.01 溶液。产生的现象证实了其推测。该现象是___________。
(5)按照(4)原理,该同学用上图装置进行实验,证实了ⅱ中向转化的原因。
①转化原因是___________。
②与(4)实验对比,不同的操作是___________。
(6)实验Ⅰ中,还原性;而实验Ⅱ中,还原性:。将(3)和(4)、(5)作对比,得出的结论是___________。
(7)用氯化铁溶液洗涤银镜反应后的试管比用硫酸铁效果好,请根据(6)中的结论进行解释___________。
【答案】(1)化学平衡状态
(2)因为溶液的稀释对颜色变化的影响
(3)在ⅰ加入溶液后,发生反应:,使减小,平衡向左移动,被消耗,溶液褪色;在ⅱ加入溶液后,增大了,平衡向左移动,减小,颜色变浅
(4) ①. 正 ②. 产生黄色沉淀,同时指针向左偏转
(5) ①. 随反应进行,逐渐增大,还原性逐渐增强,最终还原性强于 ②. 在U形管右端加入溶液
(6)反应是一个可逆的氧化还原反应,可以通过改变浓度的方式来影响物质的氧化性、还原性实现平衡的左右移动
(7)因为AgCl溶解度比Ag2SO4小,所以加入FeCl3溶液更有利降低溶液中银离子的浓度,使平衡正向移动,故溶液除银效果更好的是FeCl3溶液
【解析】
【分析】研究改变浓度使反应中和实现相互转化:通过实验I中溶液与溶液反应后等分为三份,进行实验II的对比实验来探究和的相互转化,据此回答。
【小问1详解】
待实验Ⅰ溶液颜色不再改变时,即先让实验I达到平衡状态,再进行实验Ⅱ,才能更好的进行对比。
故答案为:达到平衡状态。
【小问2详解】
i和ii对比,ii加的液体体积多,颜色的变化可能会受体积改变的影响,因此采用iii来加水进行对比实验,排除ii中因溶液稀释对颜色变化的影响。
故答案为:因溶液稀释对颜色变化的影响。
【小问3详解】
根据反应,溶液的颜色主要是单质溶解在溶液中产生,ⅰ和ⅱ的颜色变化表明平衡都产生了逆向移动,发生了向的转化,其产生的原因可能是在ⅰ加入溶液后,发生反应:,使减小,平衡向左移动,被消耗,溶液褪色;在ⅱ加入溶液后,增大了,平衡向左移动,减小,颜色变浅。
故答案为:在ⅰ加入溶液后,发生反应:,使减小,平衡向左移动,被消耗,溶液褪色;在ⅱ加入溶液后,增大了,平衡向左移动,减小,颜色变浅。
【小问4详解】
①在原电池中,电流计的指针偏向正极,当K闭合时,指针向右偏转,说明右边电极b为正极;
②在左边加入溶液后,发生反应:黄色,如果要证明猜想,则氧化还原反应要向左进行,即电池反应反向进行,左边为正极,电流计的指针要向左偏转;
故答案为:正;产生黄色沉淀,同时指针向左偏转。
【小问5详解】
①ii主要是验证对反应的影响,用该装置模仿ii的实验,证明在反应过程中,随反应进行,逐渐增大,还原性逐渐增强,最终还原性强于,使平衡向左进行;②如果与(4)实验直接对比,可以向U形管右边加入溶液使浓度直接增大发生反向反应。
故答案为:随反应进行,逐渐增大,还原性逐渐增强,最终还原性强于;向U形管右边加入溶液。
【小问6详解】
在探究实验Ⅰ中,得到还原性的结论;而在探究实验Ⅱ中,得到还原性的结论,结合(3)和(4)、(5)的对比实验,可以得出:反应是一个可逆的氧化还原反应,可以通过改变浓度的方式来影响物质的氧化性、还原性实现平衡的左右移动。
故答案为:反应是一个可逆的氧化还原反应,可以通过改变浓度的方式来影响物质的氧化性、还原性实现平衡的左右移动
【小问7详解】
在有银镜的试管中加入的溶液,会发生反应:,可以与和生成沉淀和沉淀使减小,平衡右移,导致银镜不段溶解最终被除去而洗涤干净,因为AgCl溶解度比Ag2SO4小,所以加入FeCl3溶液更有利降低溶液中银离子的浓度,使上述平衡正向移动,故溶液除银效果更好的是FeCl3溶液;
故答案为:因为AgCl溶解度比Ag2SO4小,所以加入FeCl3溶液更有利降低溶液中银离子的浓度,使平衡正向移动,故溶液除银效果更好的是FeCl3溶液。
A.锌锰电池
B.氢燃料电池
C.铅蓄电池
D.镍镉电池
实验
反应温度/℃
溶液
稀
V/mL
c/(ml/L)
V/mL
c/(ml/L)
V/mL
①
25
5
0.1
10
0.1
x
②
25
5
0.2
5
0.2
10
③
35
5
0.2
5
0.2
10
步骤
现象
Fe表面产生大量无色气泡,液面上方变为红棕色
Fe表面产生少量红棕色气泡后,迅速停止
Fe、Cu接触后,其表面均产生红棕色气泡
化学式
HCOOH
HCN
电离平衡常数
物质
c/()
0.05
2.0
2.0
北京市北京师范大学附属中学2024-2025学年高二上学期期中考试 化学试题: 这是一份北京市北京师范大学附属中学2024-2025学年高二上学期期中考试 化学试题,共16页。
北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题(原卷版): 这是一份北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题(原卷版),共8页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题(原卷版+解析版): 这是一份北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题(原卷版+解析版),文件包含北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题原卷版docx、北京市北京师范大学第二附属中学2024-2025学年高三上学期开学检测化学试题解析版docx等2份试卷配套教学资源,其中试卷共29页, 欢迎下载使用。












