





所属成套资源:2023-2024学年高一下学期化学人教版(2019)必修第二册
化学必修 第二册第二节 化学反应的速率与限度图文ppt课件
展开
这是一份化学必修 第二册第二节 化学反应的速率与限度图文ppt课件,共54页。PPT课件主要包含了思考与交流,炼铁高炉尾气之谜,可逆反应,化学平衡状态,等动定变,“变量不变”,PVnRT,总结归纳等内容,欢迎下载使用。
写出SO2 转化为SO3、工业合成氨、形成氯水的三个化学方程式。
我们知道在化学反应中,反应物之间是按照化学方程式中的系数比进行反应的,那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
观察上述方程式,有何共同的特点?
Cl2、H2O、HClO、H+、Cl-、ClO-、OH-
氯气的转化率有没有可能达到100%?
可逆反应中,反应物与生成物共存,任何反应物的转化率都不可能达到100%
请大家回忆新制氯水中含有哪些微粒。
一个化学反应在实际进行时,反应物能否完全转变为生成物?阅读:P48 科学史话,从这一材料中,你得到什么启示?
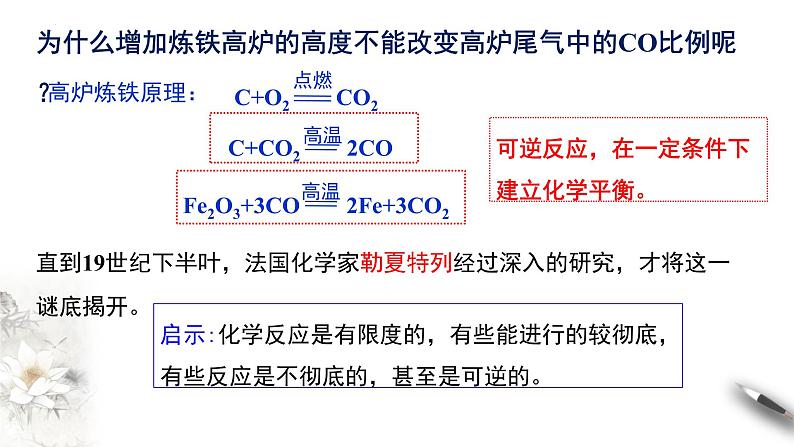
开始,炼铁工程师们认为是CO与铁矿石接触不充分之故,于是设法增加高炉的高度,然而高炉增高后,高炉尾气中的CO比例竟没有改变,这是什么原因呢?
炼制1吨生铁所需焦炭的实际用量远高于按照化学方程式计算所需的量,且从高炉中出来的气体中含有没利用的CO气体。
为什么增加炼铁高炉的高度不能改变高炉尾气中的CO比例呢?
可逆反应,在一定条件下建立化学平衡。
直到19世纪下半叶,法国化学家勒夏特列经过深入的研究,才将这一谜底揭开。
启示:化学反应是有限度的,有些能进行的较彻底,有些反应是不彻底的,甚至是可逆的。
在相同条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
书写可逆反应的化学方程式时不用“ = ”而用“ ”。
注意:①可逆反应总是不能进行到底,
②反应物不能完全转化为生成物,得到的总是反应物与生成物的混合物,
③反应会达到一定的限度。
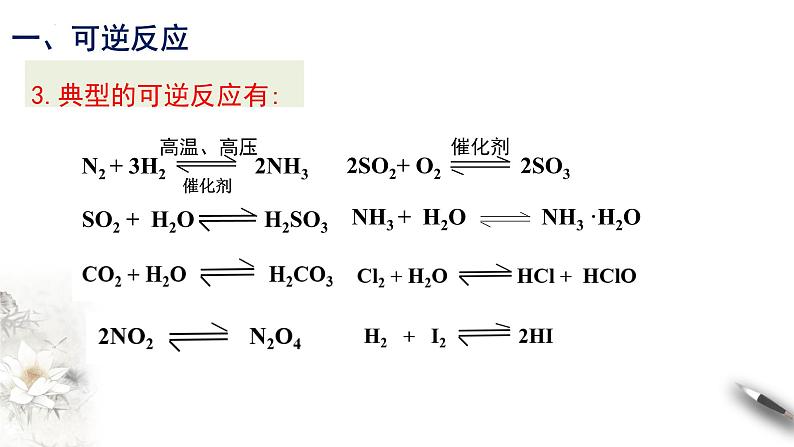
3.典型的可逆反应有:
例1、对于可逆反应 2SO2+O2 2SO3,在混合气体中充入一定量的 18O2 足够长时间后,18O原子( )A、只存在于O2中B、只存在于O2和SO3中C、只存在于SO2和O2中D、存在于SO2、O2 和 SO3
在容积为 2L 的密闭容器里,加1ml N2 和 3ml H2 (合适催化剂),分析:下表是 反应中起始和反应不同时间时各物质的浓度变化。
开始时c(N2) 、c(H2)大, c(NH3) = 0
N2 + H2 NH3
只有正反应,v(逆) = 0
①当反应刚开始时,反应物和生成物的浓度哪个大?
②当反应刚开始后,正反应和逆反应哪个反应速率大?
开始后c(N2) 、c(H2 )变小 , c(NH3) ≠ 0
N2 + H2 NH3
正逆反应都进行,v (逆) ≠ 0,v (正) > v (逆)
v (正) = v (逆) ≠ 0
③ 随着反应的进行,反应物和生成物浓度如何变化?
c(N2) 、c(H2)逐渐变小,c(NH3)逐渐增大,三种物质的浓度达到一个特定值。
④ 随着反应的进行,v(正)、 v(逆)怎样变化?
⑤根据上述分析画出 N2和 H2反应过程中,v正、v逆 随时间变化的关系图。
当一个可逆反应达到平衡时,各物质的浓度保持不变,这时反应停止了吗?
由于v(正) = v(逆) ≠ 0,虽然正、逆反应都在进行,但各种物质的百分含量、浓度都不会发生变化。
从外表上看,反应好像“停止”。
二、化学平衡状态的建立过程
在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物浓度不再减少,生成物浓度不再增加,反应混合物中各组分的含量保持不变的状态。
前提(适用范围):可逆反应
内在本质:v(正) = v(逆) ≠ 0
外在标志:反应混合物中各组分的浓度保持不变
可逆反应在一定条件下所能达到的或完成的最大程度,即反应限度
(1)逆:化学平衡状态的研究对象是可逆反应
(2)等: v(正) = v(逆) ≠ 0
(3)动:动态平衡(正逆反应仍在进行)
(4)定:反应混合物中各组分的浓度保持不变,各组分的含量一定
(5)变:外界条件改变时,原平衡状态会被破坏,在新的条件下建立新的平衡
如何判断可逆反应已达到平衡状态了呢?
微观上判断: 平衡时,v(正)= v(逆),
v(正)= v(逆)是指指定某物质(反应物或生成物)的消耗速率与生成速率相等。
宏观上判断:各物质的浓度保持不变,各物质的百分含量不变。
四、可逆反应达到化学平衡状态的标志
—— v正(A) = v逆(A)
—— v正(A) : v逆(B) = a : b
该物质的生成速率与消耗速率相等。
即单位时间内生成与消耗某反应物(生成物)的量相等。
①表示两个不同的方向。
②速率之比等于化学方程式中相应的化学计量数之比。
例2、对于反应 达到化学平衡状态时,试推断 1.单位时间内有2 ml SO2消耗,同时有2 ml SO2 ; 2.单位时间内有2 ml SO3生成,同时有 SO3消耗;
例3.下列说法可以证明反应 N2+ 3H2 2NH3 已达平衡状态的是( )
A. 1个 N≡N 键断裂的同时,有 3个 H-H 键形成
B. 1个 N≡N 键断裂的同时,有 3个 H-H 键断裂
C. 1个 N≡N 键断裂的同时,有 6个 N-H 键断裂
D. 1个 N≡N 键断裂的同时,有 6个 N-H 键形成
例4、一定条件下,可逆反应
① 单位时间内,有1 ml N2 反应掉,同时有 _______ 生成
② 单位时间内,有2 ml NH3生成,同时有 _________ 消耗
③ 单位时间内,有1 ml H2生成,同时有__________消耗
① 单位时间内,有1 ml N2反应掉,同时有__________生成, ___________反应掉。
对于不同类型的可逆反应,某一物理量不变是否可作为平衡已到达的标志,取决于该物理量在平衡到达前后(反应过程中)是否发生变化,若是,则可以作为依据;否则,不行。
(注意:不是相等,也不是成一定的比值)
特例:反应物无气体,只有生成物有气体时, 体积分数始终不变,故此时体积分数不是变量
例5.在一定温度下,向 a L密闭容器中加入1 ml X 气体和 2 ml Y 气体,发生如下反应:X(g)+ 2Y(g) 2 Z(g),不能作为反应达到化学平衡状态标志的是( ) A.单位时间内生成和消耗的X的物质的量相等 B.容器内各物质的浓度不随时间变化 C.容器内X、Y、Z的浓度之比为1∶2∶2 D.单位时间消耗0.1 ml X的同时消耗0.2 ml Z
注意:反应物和生成物的浓度都不再改变(而不是相等,也不是成一定的比值)
ρ不变时,不一定为平衡状态
ρ不变时,一定为平衡状态
因为恒容、恒温条件下,n(g) 越大则压强
当 Δn(g) = 0,
当 Δn(g) ≠ 0,
则无论各组分是否均为气体,只需考虑 反应前后气体的物质的量之差 Δn(g) 。
不一定是化学平衡状态。
例6 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( ) A. 反应容器内压强不随时间变化 B. P 和 S 的生成速率相等 C. 反应容器内 P、Q、R、S 四者共存 D. 反应容器内总物质的量不随时间而变化
恒容、恒温条件下 , C(s)+O2(g) CO2(g) 当体系总压强不变时,_______是化学平衡状态 CO2(g)+C(s) 2CO(g) 当体系总压强不变时,_______是化学平衡状态 2SO2(g)+O2(g) 2SO3(g) 当体系总压强不变时,_______是化学平衡状态 H2(g)+I2(g) 2HI(g) 当体系总压强不变时,_______是化学平衡状态
例7.在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+ 3B(气) 2C(气) + D(气) 已达平衡状态的是 ( ) A. 混合气体的压强 B. 混合气体的密度 C. B 的物质的量浓度 D. 气体的总物质的量
例9 在固定体积的的密闭容器中发生反应: 2NO2 2NO + O2该反应达到平衡的标志是:
①混合气体的颜色不再改变
②混合气体的平均相对分子质量不变
⑤单位时间内消耗 2nml NO2 的同时生成 2nml O2
⑥O2气体的物质的量浓度不变
1.判断可逆反应已达到平衡状态的依据有哪些?
提示 直接判据:①.正、逆反应速率相等;②.各物质浓度不变。间接判据:百分含量、物质的量、压强、平均相对分子质量、密度、颜色不随时间改变。
2.如何理解正、逆反应速率相等 ?
提示 同一物质的生成速率和消耗速率相等。
化学平衡计算的一般步骤: “三段式”
①写出有关平衡的化学方程式
②找出各物质的 起始量 转化量 平衡量
③根据已知条件列式:如下
m A(g) n B(g) + p C(g)起始(ml)转化(ml)平衡(ml)
平衡转化率(α) 及产率
转化率:用平衡时已被转化的某反应物的物质的量与其初始时的物质的量之比来表示
对于反应:mA + nB pC + qD
参加反应的A的物质的量
生成物( C 或 D)的产率:
现在,假设你是一名工程师,你要提高你工厂煤的燃烧效率,你认为应该从哪些方面进行分析?
煤的状态与燃烧的速率有何关系?与煤的充分燃烧有何关系?空气的用量对煤的充分燃烧有什么影响?原因是什么?应选用什么样的炉膛材料?如何充分利用煤燃烧后的废气中的热量?
五、化学反应条件的控制
1、控制化学反应条件的意义
2. 考虑因素:化工生产中调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
3.合成氨工业反应条件的控制
4、煤燃烧反应条件的控制
(2)影响煤燃烧效率的条件
粉末状(接触面积足够大)
足够的空气(适当的量)
保温隔热材料(防止热量散失)
(1) 燃料燃烧的条件
①燃料与空气或氧气接触;
②温度达到燃料的着火点。
①尽可能使燃料 ,提高能量的转化率。关键是燃料与空气或氧气尽可能 ,且气空要 。②尽可能充分利用燃料燃烧所释放出的热能,提高热能的利用率。
注意: 空气的通入量要适当,否则过量的空气会带走部分热量,同样会造成浪费。
(3)提高燃料燃烧效率的措施
1.对化学反应限度的叙述,错误的是( )A.任何可逆反应在给定条件下的进程都有一定的限度B.化学反应达到限度时,正、逆反应速率相等C.化学反应的限度与时间的长短无关D.化学反应的限度是不可改变的
2.下列措施,能使煤炭燃烧更充分,提高热能利用率的是( )A.多加煤以使炉火更旺B.在煤炭中加入生石灰C.做蜂窝煤时常在煤中掺和一些黄泥D.把煤粉碎,在煤粉燃烧器中燃烧
3.一定温度下,0.1 ml N2(g)与0.3 ml H2(g)在密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),已知该条件下,1 ml N2(g)与3 ml H2(g)完全反应时放出热量a kJ。下列说法正确的是( )A.达到化学平衡状态时,反应放出0.1a kJ热量B.达到化学平衡状态时,v(NH3)∶v(N2)=2∶1C.使用催化剂能够提高原料平衡转化率D.升高温度,正反应速率减小,逆反应速率增大
例8.在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ① C的生成 速率与 C的分解速率相等 ②单位时间内生成 a ml A,同时生成 3a ml B ③A、B、C的浓度不再变化 ④A、B、C的分压强不再变化 ⑤混合气体的总压强不再变化 ⑥混合气体的物质的量不再变化 ⑦单位时间内消耗 a ml A,同时生成 3a ml B ⑧A、B、C、D 的分子数之比为 1:3:2:2
定义:可逆反应中,旧化学平衡的破坏,新化学平衡建立过程叫做化学平衡的移动。
平衡1 不平衡 平衡2
V正 > V逆 平衡向正反应方向移动
V正 = V逆 平衡不移动
V正 < V逆 平衡向逆反应方向移动
1、浓度对化学平衡的影响
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;
在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。
2、温度对化学平衡的影响
结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。
相关课件
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度说课ppt课件,共21页。PPT课件主要包含了思考与交流,炼铁高炉尾气之谜,可逆反应,典型的可逆反应有,可逆反应的特点,交流与讨论,教师小结,反应开始时,反应进行中,反应到一定时间等内容,欢迎下载使用。
这是一份化学必修 第二册第二节 化学反应的速率与限度课文ppt课件,共27页。PPT课件主要包含了“等”,“定”,--标志等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度示范课课件ppt,共26页。PPT课件主要包含了考纲要求,炼铁高炉尾气之谜,可逆反应,SO3,在一定条件下反应,S18O2,S16O18O,O16O,反应物生成物共存,一可逆反应等内容,欢迎下载使用。









