

河北省衡水中学2024-2025学年高二上学期期中综合素质评价化学试题 (无答案)
展开主命题人:苏玉钗
可能用到的相对原子质量:H 1 O 16 S 32 Cl 35.5 Cu 64 Zn 65
第I卷(选择题)(共54分)
一.单选题(1-18题,每题一个正确答案,每题3分,共54分)
1.化学与社会、科学、技术、环境密切相关,下列说法错误的是( )
A.“烈火焚烧若等闲”中碳酸钙分解是断键能量大于成键能量
B.“木与木相摩则然(燃)”中的“然”是化学能转变为热能
C.工业合成氨温度为400~500°C是因为升高温度有利于提高反应物的平衡转化率
D.“燕山雪花大如席,片片吹落轩辕台”水汽变成雪的过程中,
2.室温下,下列实验探究是弱电解质的方案中不能达到目的的是( )
A.AB.BC.CD.D
3.设为阿伏伽德罗常数的值,下列说法正确的是( )
A.用电解法精炼铜时,若阳极质量减轻64g,则电路中转移电子数目为
B.溶液中含有的阴离子数目小于
C.将通入水中,溶液中、、粒子数之和小于
D.的溶液中含有个
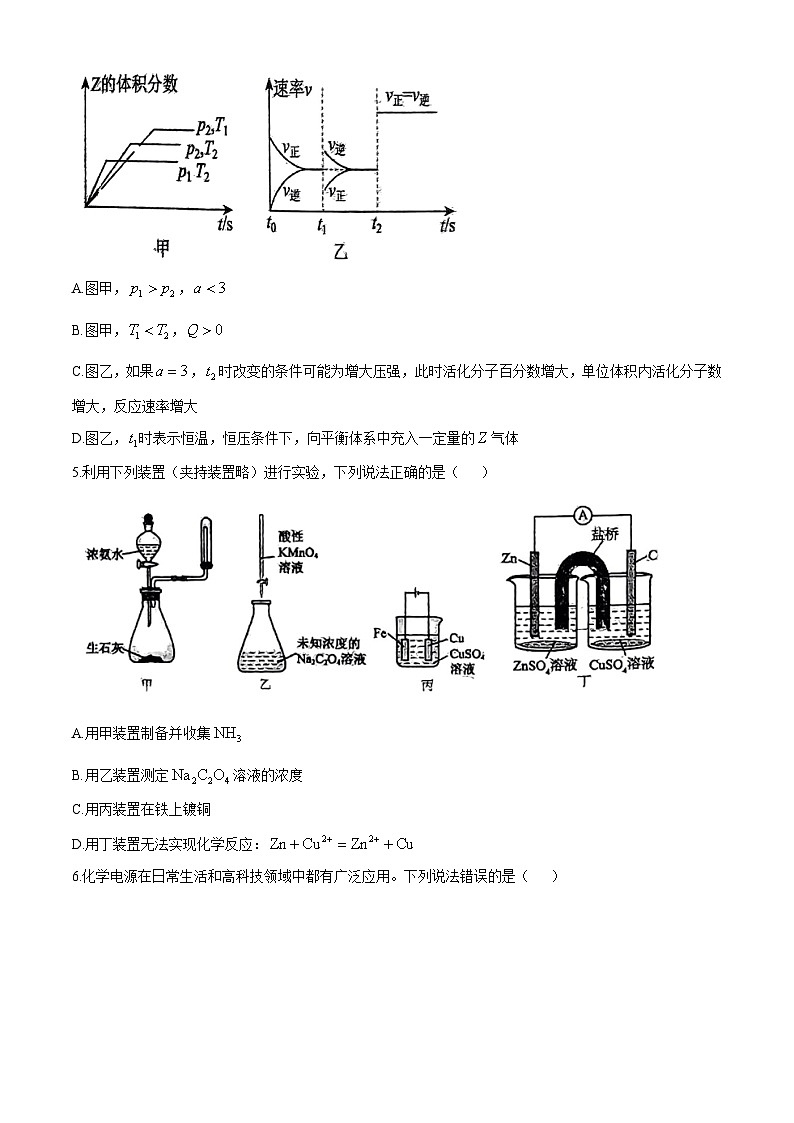
4.在一密闭容器中发生反应:,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是( )
A.图甲,,
B.图甲,,
C.图乙,如果,时改变的条件可能为增大压强,此时活化分子百分数增大,单位体积内活化分子数增大,反应速率增大
D.图乙,时表示恒温,恒压条件下,向平衡体系中充入一定量的气体
5.利用下列装置(夹持装置略)进行实验,下列说法正确的是( )
A.用甲装置制备并收集
B.用乙装置测定溶液的浓度
C.用丙装置在铁上镀铜
D.用丁装置无法实现化学反应:
6.化学电源在日常生活和高科技领域中都有广泛应用。下列说法错误的是( )
A.图甲:锌铜水果电池工作时,电子由锌经导线流向铜
B.图乙:正极的电极反应式为
C.图丙:锌筒作负极,发生氧化反应,锌筒会变薄,且外电路每转移电子消耗锌32.5g
D.图丁:铅蓄电池为二次电池,电池放电过程中,电路中转移电子时电解质溶液中消耗硫酸9.8g
7.水的电离平衡曲线如图所示,下列说法正确的是(已知:℃)( )
A.图中A、B、D三点处的大小关系:
B.25℃时,向的稀硫酸中逐滴加入稀氨水,溶液中逐渐减小
C.A点所对应的溶液中,可同时大量存在、、、
D.25℃时,保持温度不变,在水中加入适量固体,体系可以从A点变化到C点
8.、均可自耦电离:、。下列反应与原理不同的是( )
A.B.
C.D.
9.已知碳酸氢钠在水溶液中加热时也可分解,为探究化学平衡移动的影响因素,采用下列方案设计进行实验,由现象得出的结论正确的是( )
10.下列图示与对应的分析相符的是( )
A.图甲曲线表示反应的
B.由图乙可知反应在处达到平衡,且该反应的
C.图丙可表示向氨水中滴加稀盐酸,溶液中由水电离的随加入盐酸体积的变化
D.由图丁可知,用的硝酸银溶液,滴定等体积等浓度的、及的混合溶液,先沉淀(表示、或)
11.环境监察局常用“定电位”传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示,下列说法不正确的是( )
A.对电极是负极
B.工作电极上发生的电极反应为
C.对电极的材料可能为锌
D.传感器工作时由工作电极移向对电极
12.用盐酸滴定溶液时,其滴定曲线如图所示。则下列说法错误的是( )
A.原溶液浓度为
B.a、b、c三点对应溶液中最大的是a点溶液
C.点溶液:
D.实验滴定到b点附近可选用酚酞作指示剂
13.在容积为2L的恒容密闭容器中通入,发生反应,一定温度下,测得的转化率随时间的变化如图所示,在时反应达到平衡状态。下列说法错误的是( )
A.a点处的逆反应速率小于b点处的正反应速率
B.内,的平均反应速率
C.其他条件不变,改为恒压条件下发生反应,平衡时的转化率小于50%
D.后,保持恒温恒容,再通入,平衡正向移动,再次达到平衡后,的体积分数比第一次平衡时大
14.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.溶液与溶液等体积混合;
B.溶液与氨水等体积混合:
C.溶液与溶液等体积混合:
D.溶液与溶液等体积混合(为二元弱酸);
15.已知及表中有关信息:
下列判断正确的是( )
A.向溶液中滴入酚酞,溶液变红,主要原因是
B.常温时,与混合溶液的,则
C.溶液中:
D.的溶液与溶液等体积混合出现沉淀,则溶液的浓度一定是
16.一种可植入体内的微型电池工作原理如图所示,通过催化消耗血糖发电,从而控制血糖浓度。当传感器检测到血糖浓度高于标准,电池启动。血糖浓度下降至标准,电池停止工作。(血糖浓度以葡萄糖浓度计)葡萄糖电池工作时,下列叙述错误的是( )
A.电池总反应为
B.b电极上通过和相互转变起催化作用
C.消耗葡萄糖,理论上a电极有电子流入
D.两电极间血液中的在电场驱动下的迁移方向为
17.已知:。实验测得速率方程为,(、为速率常数,只与温度、催化剂有关,与浓度无关)。向恒容密闭容器中充入和发生上述反应,测得的体积分数与温度和时间的关系如图所示。下列说法正确的是( )
A.此反应
B.正、逆反应活化能的大小关系为
C.温度下的温度下的
D.化学反应速率:c点的点的点的
18.298K时,用溶液分别滴定等物质的量浓度的、、三种溶液。[p表示负对数,M表示、、]随溶液变化的关系如图所示。已知:。下列推断正确的是( )
A.②代表滴定溶液的变化关系
B.一般情况下,适量的固体能完全溶于溶液
C.固体能完全溶于溶液
D.滴定HR溶液至时,溶液中:
主观题(共4题,共46分)
19.(12分)(1)一种将催化转化为的电化学装置如图所示。
铂电极发生的反应为_____,工作过程中玻碳电极区溶液的_____(填“增大”或“减小”)。
(2)是电池(如图1)的正极活性物质,电池的负极是金属,电解液是含锂盐的有机溶液。电池放电反应:。该反应可认为分两步进行:
第1步:,则第2步反应为:_____。
(3)如图2为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池的反应式:,正极的电极反应式:_____。M(由和制得)的两个作用:一是将钠和硫隔开,二是_____。
(4)浓差电池中的电动势是由于电池中存在浓度差而产生的。某浓差电池的原理如图3所示,该电池从浓缩海水中提取的同时又获得了电能。
①X为_____极,Y极反应式;_____。
②Y极生成时,移向_____(填“X”或“Y”)极。
20.(12分)钴在新能源、新材料领域具有重要用途。某炼锌废渣含有锌、铅、铜、铁、钴、锰的+2价氧化物及锌和铜的单质。从该废渣中提取钴的一种流程如下。
注:加沉淀剂使一种金属离子浓度小于等于,其他金属离子不沉淀,即认为完全分离。
已知:①,,。
②以氢氧化物形式沉淀时,和溶液的关系如图所示。
回答下列问题:
(1)“酸浸”前,需将废渣磨碎,其目的是_____。
(2)“酸浸”步骤中,发生反应的化学方程式是_____。
(3)假设“沉铜”后得到的滤液中和均为,向其中加入至沉淀完全,此时溶液中_____,据此判断能否实现和的完全分离______(填“能”或“不能”)。
(4)“沉锰”步骤中,生成,产生的物质的量为_____。
(5)“沉淀”步骤中,用调,分离出的滤渣是_____。
(6)“沉钴”步骤中,控制溶液,加入适量的氧化,其反应的离子方程式为_____。
21.25℃时,部分物质的电离平衡常数如表所示;
请回答下列问题:
(1)向溶液中加入足量,反应的离子方程式为_____。
(2)一种—催化电极(表面锂掺杂了锡纳米粒子)催化制甲酸盐的电化学装置如图所示。放电时,正极电极反应式为:_____。
(3)为了测定一元酸溶液的浓度,现取溶液,用的标准溶液滴定:
①用固体配制,的溶液,需要用到的仪器除天平,药匙,烧杯,玻璃棒,胶头滴管,还需要_____。实验过程中,将放入锥形瓶,滴入酚酞2-3滴;用标准溶液进行滴定,滴定过程中,眼睛应注视_____。
②连续滴定3次,若其中一次滴定结束时,滴定管中的液面如图所示,则终点读数为_____mL。
③某学生根据4次实验分别记录有关数据如下表:
依据上表数据计算该溶液的物质的量浓度为_____(结果保留四位有效数字)。
④下列操作中可能使所测溶液的浓度数值偏低的是_____(填字母)。
A.滴定前,用待测液润洗锥形瓶
B.一滴标准溶液附在锥形瓶壁上未洗下
C.选用甲基橙作指示剂
D.配置、溶液时,称量固体速度过慢
E.读取溶液体积时,开始仰视读数,滴定结束时俯视读数
(4)滴定法是一种常见的定量实验分析法,常见的有酸碱中和滴定、氧化还原滴定、沉淀滴定等。①如据反应,可以用碘水滴定溶液,可以选_____作指示剂;②用标准溶液滴定溶液中的时,采用为指示剂,利用与反应生成砖红色沉淀指示滴定终点,当溶液中的恰好沉淀完全(浓度为)时,溶液中的_____。(保留三位有效数字,已知25℃时,和的分别为和。)
22.(9分)常温下,实验测得下列物质的溶液如表所示:
(1)溶液显碱性的主要原因为_____(用离子方程式表示)。
(2)上述溶液中_______溶液中(填“大于”“小于”或“等于”)。
(3)有同学认为根据前几组实验结果,无需再实验就可以预测a的值,则_____。
(4)向少量悬浊液中加入适量的饱和溶液,结果固体完全溶解,固体溶解的原因可能是:
猜想甲:①
②
③
结论:由于③反应的发生,使反应①平衡正向移动,溶解。
猜想乙:①
②_________________
结论:由于②反应的发生,使反应①平衡正向移动,溶解。
(5)下列说法正确的是_____
①上述表格中溶液的大于溶液的可能原因:电离出的会中和水解产生的部分
②已知25℃时,溶液的第一步水解常数,则当溶液时
③向盛有碳酸钠溶液的试管中滴入几滴酚酞溶液,振荡,溶液变红,向溶液中再加入过量的固体,产生白色沉淀,且红色褪去证明纯碱溶液中存在水解平衡。
选项
探究方案
A
测定的溶液pH
B
将的溶液稀释10倍,测pH
C
向溶液中加入少量固体,测定pH是否变化
D
测量酷酸、盐酸的导电性强弱
选项
影响因素
方案设计
现象
结论
A
催化剂
向溶液中加入5滴溶液
溶液中产生气泡
使用合适的催化剂可使平衡正向移动
B
压强
向针筒中充入,分解达到平衡后再压缩针筒内气体
气体颜色变深
增大压强,平衡正向移动
C
温度
加热溶液(含有酚酞)的试管
红色变深
升高温度,水解平衡向吸热方向移动
D
浓度
向溶液中滴加数滴溶液
黄色溶液变橙色
增大反应物浓度。平衡向正方向移动
弱酸
电离平衡常数(常温)
化学式
HCOOH
电离平衡常数
实验序号
待测溶液体积/mL
的体积/mL
滴定前刻度
滴定前刻度
滴定前刻度
1
25.00
0.00
12.49
V1
2
25.00
0.56
14.56
V2
3
25.00
0.22
12.73
V3
4
25.00
0.21
12.71
V4
物质
溶液pH
11
8.9
8.3
7.0
a
河北省衡水中学2024-2025学年高二上学期期中综合素质评价化学试题+: 这是一份河北省衡水中学2024-2025学年高二上学期期中综合素质评价化学试题+,共8页。
河北省衡水中学2024-2025学年高三上学期期中综合素质评价化学试题: 这是一份河北省衡水中学2024-2025学年高三上学期期中综合素质评价化学试题,共6页。
河北省保定市河北定州中学2024-2025学年高二上学期11月期中考试 化学试题(无答案): 这是一份河北省保定市河北定州中学2024-2025学年高二上学期11月期中考试 化学试题(无答案),共9页。试卷主要包含了1ml金属镁和卤素单质反应的,下列说法正确的是,分解速率受多种因素影响,下列叙述正确的是等内容,欢迎下载使用。












