



2024届河南省信阳市商城县高三下学期二模考试 化学试卷
展开
这是一份2024届河南省信阳市商城县高三下学期二模考试 化学试卷,文件包含2024届河南省信阳市商城县高三二模考试化学试卷docx、2024届河南省信阳市商城县高三二模考试化学试卷pdf等2份试卷配套教学资源,其中试卷共16页, 欢迎下载使用。
考试时间:75分钟
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23
一、选择题:本题共16小题,共40分。第1~10小题为单选题,每小题2分;第11~15小题为多选题,每小题4分。
1. 化学与人类生产、生活密切相关,下列有关说法不正确的是
2. 一种新型的葡萄糖辅助Cu(Ⅰ)/Cu(Ⅱ)氧化还原耦合制氢系统工作原理如图所示。下列说法错误的是
3. 全固态锂金属电池具有更高比能和更高安全性。我国科研团队设计了基于LLZ-TO@Ag复合层负极改性的硫化物全固态锂电池,结构如图,放电时电池反应:。下列说法不正确的是
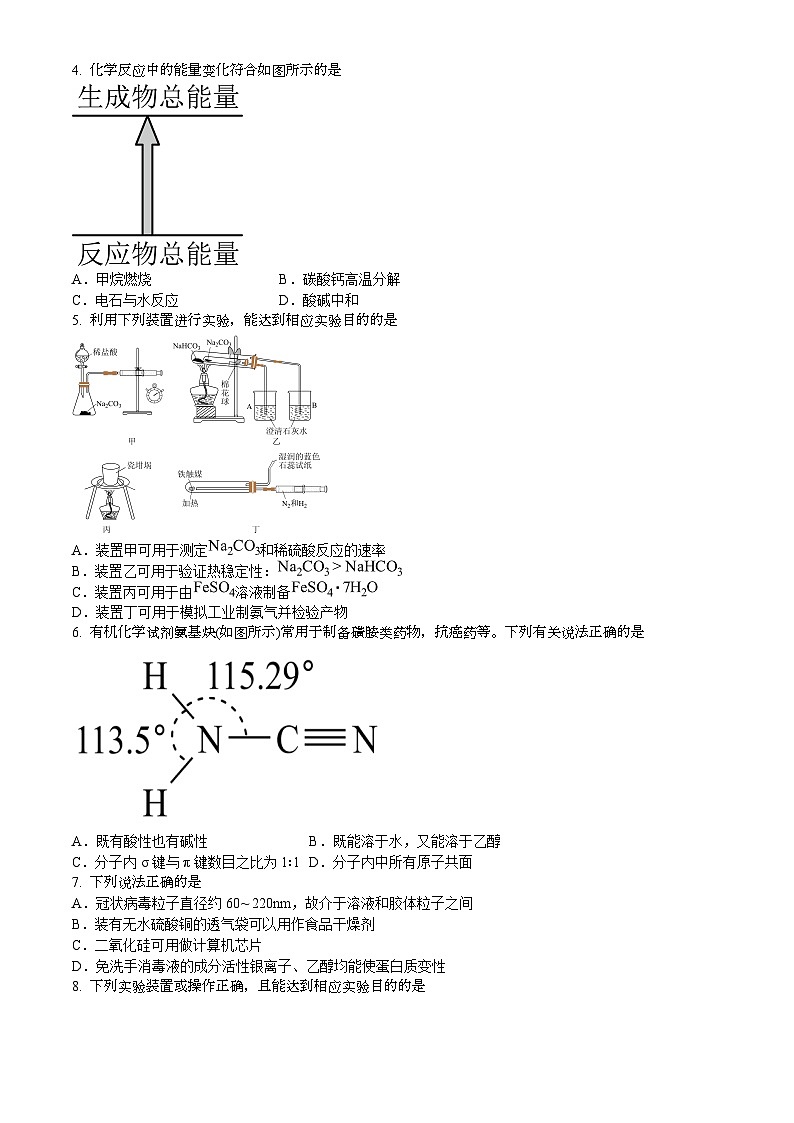
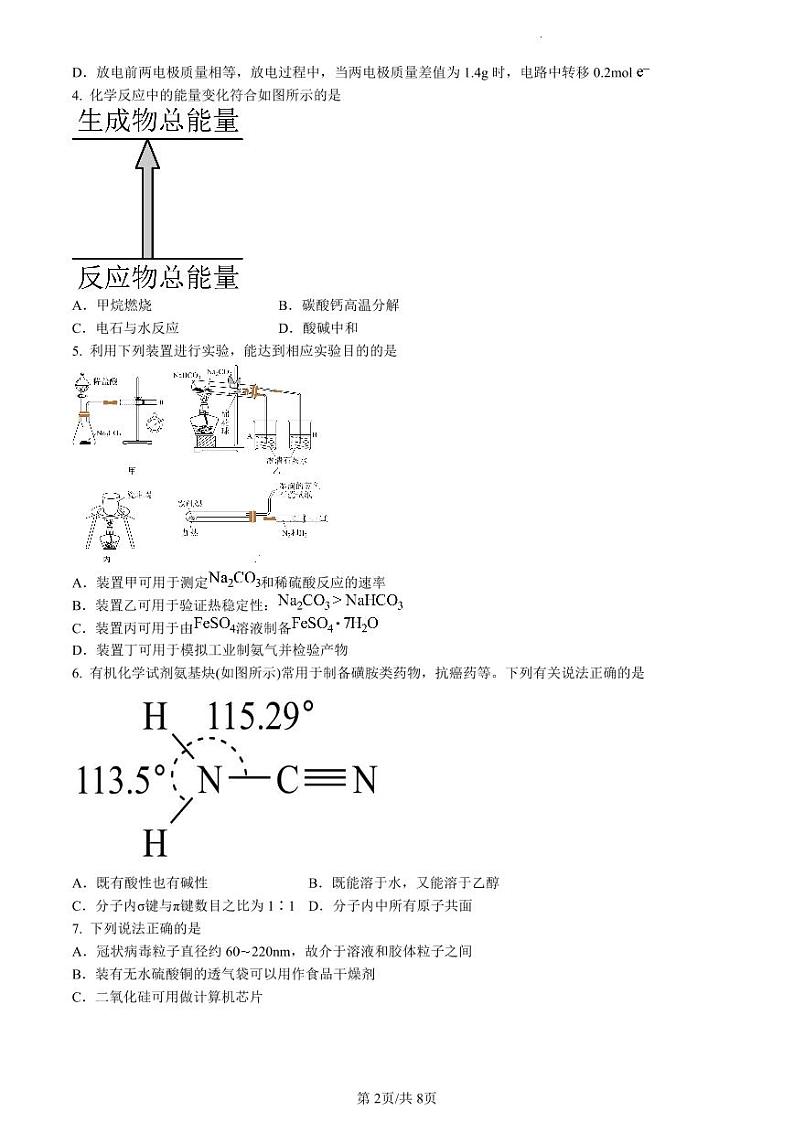
4. 化学反应中的能量变化符合如图所示的是
5. 利用下列装置进行实验,能达到相应实验目的的是
6. 有机化学试剂氨基炔(如图所示)常用于制备磺胺类药物,抗癌药等。下列有关说法正确的是
7. 下列说法正确的是
8. 下列实验装置或操作正确,且能达到相应实验目的的是
9. 下图为氢氧燃烧电池原理示意图,按照此图的提示,下列叙述正确的是
10. 已知图一表示的是可逆反应A(g)+B(g)⇌C(s)+D(g) △H>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)⇌N2O4(g) △H<0的浓度(c)随时间t的变化情况。下列说法中正确的是( )
11. 向含有x ml HNO3和y ml H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是
12. 2021年诺贝尔化学奖授予本亚明,利斯特和戴维,麦克米伦,以表彰他们对“不对称有机催化的发展”做出的贡献。氨基酸衍生物作为催化剂用于丙酮与4-硝基苯甲醛的不对称反应如下:
下列说法正确的是
13. 有机物的重排反应如图所示,机理中与羟基处于反位的基团迁移到氮原子上(、代表烷基)。下列说法正确的是
14. 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,a是一种有机物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图。下列说法错误的是
15. 用双硫腺(H2Dz,二元弱酸)~CCl4络合萃取法可从工业废水中提取金属离子,从而达到污水处理的目的。如在分离污水中的Cu2+时,先发生络合反应:Cu2++2H2DzCu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。如图是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率),下列说法错误的是
二、非选择题:共5题,共60分。
16. 金属钼具有高强度、高熔点、耐腐蚀、耐研磨等优点,主要作为钢的添加剂。工业上常用钼精矿(主要成分是,含有钙、硅等元素)制备金属钼,其中用氧化焙烧法提取钼的工艺流程如图:
已知:①焙烧后得到、、的混合物。
②溶于氨水,钼酸钙()不溶于氨水。
回答下列问题:
(1)“焙烧”产物中M元素的化合价为___________。尾气的主要成分为___________。
(2)“氨浸”过程中相关反应的离子方程式为___________。
(3)“氨浸”操作中,温度不宜过高,原因在于___________。其他条件一定时,钼的浸出率与氨浸温度、时间的关系如下图所示。“氨浸”条件宜采用___________。
(4)“沉淀转溶”过程所得滤渣②的成分为___________。
(5)“沉钼”过程中发生反应的离子方程式为___________。
(6)电氧化法是一种极具发展前景的钼精矿冶金工艺,其工作原理如下图。电解过程中阳极上发生的电极反应式为___________。
17. 乙酸是一种合成纤维、医药、农药、染料和粘合剂的重要的化工原料,也是优良的有机溶剂。
(1)已知CO的燃烧热为283kJ/ml;CH3OH的燃烧热为725kJ/ml;CH3COOH的燃烧热为870kJ/ml。试写出由CO与CH3OH制取CH3COOH的热化学方程式:_______。
(2)工业上制取一氧化碳常用焦炭与氧气和二氧化碳反应。
已知:C(s)+O2(g)⇌CO(g) △H1=-110.5kJ/ml ①
C(s)+CO2(g)⇌2CO(g) △H2=+552.5kJ/ml ②
工业上将一定比例的氧气和二氧化碳投入焦炭炉中反应,不同温度下,达到平衡时氧气和二氧化碳体积分数如图:
试解释随温度的升高氧气与二氧化碳的变化趋势的原因:_______;在850℃时反应炉中达到热平衡,则通入的n(O2):n(CO2)=_______(填,最简单整数比);此时反应器中压强为p0,则反应②的Kp=_______。
(3)650℃向某1L容器中投入1ml甲醇和不同物质的量的一氧化碳,测得平衡时反应物或生成物的体积分数如图:
则曲线c表示的物质是_______;e点CO的转化率为_______;(用分数表达或保留三位有效数字)在M点平衡状态下进行压缩,则重新达到平衡,M点可能移到:_______。(填“不变”“O”“N”或“P”)。
18. 2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCO2、LiFePO4、LiMnO2、Cu与磷的化合物等都是研究电池的常用材料。请回答下列问题。
(1)C4+中存在__种不同能量的电子。
(2)你预测第一电离能:Cu__Zn(填“>”或“<”)。请说出你的理由:__。
(3)已知下列化合物的熔点:
表格中卤化物的熔点产生差异的原因是:___。
(4)直链多磷酸盐的阴离子有复杂的结构,焦磷酸根离子、三磷酸根离子结构如图:
这类磷酸根离子的化学式可用通式表示为___(用n代表P原子数)。
(5)钴蓝晶胞结构如图1所示,该立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成如图2,则钴蓝晶体的化学式为___。在晶体中,某些原子位于其它原子围成的空隙中,如图3中●原子就位于最近的4个原子围成的正四面体空隙中。在钴蓝晶体中,Al3+位于O2-形成的___空隙中。若阿伏加 德罗常数用NA表示,则钴蓝晶体的密度为___g·cm-3(列计算式即可,不必化简)。
19. 某实验小组同学采用下列装置模拟硫酸工业的接触室,制备SO3并测定实验条件下SO2的转化率。
(1)实验过程中,当V2O5表面红热后,应将酒精灯移开一段时间后再继续加热,其原因是_______________________________________。
(2)装置B中U形管内收集到的物质呈________色________态。D处可能观察到的现象是____________________________________________。
(3)结束实验时应先停止______________,并继续_______________。
(4)为了除去SO2气体中混有的少量SO3,还可以让混合气体通过________溶液(除了图示方法)。为了检验SO2气体中是否混有少量SO3,可以让混合气体通过__________溶液;若有__________________________现象出现,说明SO2气体中混有SO3。
(5)为了测定该条件下SO2的转化率,若B中U形管内收集到的物质的质量为m g,还需要测定的实验数据是_______________________________________。
(6)实际测得SO2的转化率比理论值小,其主要原因有________________。
A.装置C中亚硫酸盐被氧化B.SO2通入速度太快,未被充分吸收
C.有SO2残留在A、B装置中D.SO3挥发,被装置C吸收
20. 化合物F是合成药物盐酸环丙沙星的重要中间体,其合成路线如下:
已知:表示。
(1)A分子中处于同一平面上的原子最多有___________个。
(2)为提高B的产率,试剂X可选用___________(填序号)。
A. B. C.
(3)C→D发生反应:,Y的结构简式为___________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:_________。卤素原子均直接连在苯环上。在酸性条件下水解,得到2种产物,2种产物分子中均含有2种不同化学环境的氢原子,其中一种水解产物能与溶液发生显色反应,另一水解产物能与溶液反应生成。
(5)已知:。写出以苯和乙烯为原料制备的合成路线流程图___________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
A.粗硅制备单晶硅涉及氧化还原反应
B.“光化学烟雾”的形成与氮氧化合物有关
C.用活性炭为糖浆脱色和用漂白纸浆的原理相同
D.用烧碱处理含高浓度的废水并回收利用氨
A.M极为电源负极
B.P极的电极反应式为
C.电解过程中Q极发生氧化反应
D.理论上消耗18g葡萄糖,可制得0.2ml
A.充电时,电流流向为电源→b极→固态电解质→a极
B.放电时,流向为a极→复合层→固态电解质→b极
C.充电时,b极的电极反应为
D.放电前两电极质量相等,放电过程中,当两电极质量差值为1.4g时,电路中转移0.2ml
A.甲烷燃烧
B.碳酸钙高温分解
C.电石与水反应
D.酸碱中和
A.装置甲可用于测定和稀硫酸反应的速率
B.装置乙可用于验证热稳定性:
C.装置丙可用于由溶液制备
D.装置丁可用于模拟工业制氨气并检验产物
A.既有酸性也有碱性
B.既能溶于水,又能溶于乙醇
C.分子内σ键与π键数目之比为1∶1
D.分子内中所有原子共面
A.冠状病毒粒子直径约60220nm,故介于溶液和胶体粒子之间
B.装有无水硫酸铜的透气袋可以用作食品干燥剂
C.二氧化硅可用做计算机芯片
D.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
A.从碘水中萃取碘
B.制备胶体
C.制取并收集干燥的氨气
D.测定氯水的pH
A.A
B.B
C.C
D.D
A.a电极是正极
B.b电极的电极反应为:4OH-- 4e-=2H2O + O2↑
C.电子从a电极经由电解液传递到b电极
D.氢氧燃烧电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
A.若图一t2时改变的条件是增大压强,则反应的△H增大
B.图一t2时改变的条件可能是升高了温度或增大了压强
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
A.a表示Fe3+的关系曲线,且满足n1:n3=2:1
B.当x=y时,n1=0.75
C.y≤1.5x
D.向P点溶液中加入铜粉,最多可溶解铜粉19.2x g
A.该反应类型为取代反应
B.①②③④四种物质可用钠和新制氢氧化铜进行鉴别
C.①②③④四种物质具有相同的含氧官能团
D.④的同分异构体中满足与溶液反应有气泡产生,且苯环上含硝基等两个取代基的有15种
A.中碳原子、氮原子均为杂化
B.由质谱可以确证和存在不同的官能团
C.能与溶液反应
D.发生上述反应的产物是
A.简单离子半径:ZX
C.a一定由W、X两种元素组成
D.d中只含有离子键,不含有共价键
A.当分离过程中,Bi3+发生的络合反应为Bi3++3H2DzBi(HDz)3+3H+
B.加NaOH溶液调节pH=11,一定存在关系:c(Na+)>c(D)=c[Zn(OH)]>c(OH—)>c(H+)
C.NaHDz溶液存在关系:c(D)+c(OH—)=c(H2Dz)+c(H+)
D.若pH=2.5且—lgc(H2Dz)=pH时,络合反应达到平衡,则H2Dz与Bi3+络合反应平衡常数约为5
化合物
AlF3
GaF3
AlCl3
熔点/℃
1040
1000
194
相关试卷
这是一份河南省信阳市商城县上石桥高中联考2023-2024学年高二下学期7月期末考试化学试题,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份河南省信阳市商城县上石桥高中联考2023-2024学年高一下学期7月期末考试化学试题,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份河南省信阳市2024届高三上学期第二次教学质量检测(二模)化学,共8页。








