

备战2025年高考二轮复习化学(广东版)大题突破练1 化学工艺流程题(Word版附解析)
展开温馨提示:大题突破练不做题卡合一。
1.(2024·广东梅州二模)金属铼广泛用于航空航天等领域。以钼精矿(主要成分为钼的硫化物和少量铼的硫化物)制取高铼酸铵晶体的流程如图所示。回答下列问题:
(1)金属铼具有良好的导电、导热性和延展性,可用于解释这一现象的理论是 。
(2)①“焙烧”时常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),其目的是 。
②“焙烧”过程中ReS2转化为Ca(ReO4)2,反应的方程式:4ReS2+10CaO+19O22Ca(ReO4)2+ 。
(3)“萃取”机理为:R3N+H++ReO4-R3N·HReO4,则“反萃取”对应的离子方程式为 ;
常温下,“反萃取”得到高铼酸铵溶液的pH=9.0,则溶液中c(NH4+) (填“>”“<”或“=”)c(NH3·H2O)。[已知:常温下lgKb(NH3·H2O)=-4.7]
(4)如图是NH4ReO4的X射线衍射图谱,则NH4ReO4属于 (填“晶体”或“非晶体”)。
高铼酸铵XRD谱
(5)工业上制备的铼粉中含有少量炭粉和铁粉(其熔、沸点见下表),在3 500 ℃时,利用氢气提纯可得到纯度达99.995%的铼粉(如图为碳在高温氢气环境中气-固占比计算结果),请分析原因: 。
(6)三氧化铼的晶胞是简单立方晶胞,晶胞结构如图所示,摩尔质量为M g·ml-1,晶体密度为ρ g·cm-3。铼原子填在氧原子围成的 (填“四面体”“立方体”或“八面体”)空隙中,该晶胞中两个相距最近的O原子间的距离为 cm。(列出计算式)
答案:(1)电子气理论
(2)①增大接触面积,提高反应速率,使焙烧充分,提高原料的利用率 ②8CaSO4
(3)R3N·HReO4+NH3NH4++ReO4-+R3N或R3N·HReO4+NH3·H2ONH4++ReO4-+R3N+H2O >
(4)晶体
(5)3 500 ℃时,Fe已气化去除,固态碳与H2完全反应形成了气态物质
(6)八面体 223MNA·ρ
解析:(1)金属铼属于金属晶体,在金属晶体中,金属原子的价电子从金属原子上“脱落”下来形成“电子气”,在外力作用下金属原子发生相对滑动,电子在其中起到“润滑”的作用,因此金属具有延展性;电子气在外电场作用下定向移动,因此金属有良好的导电性;金属受热,加速自由电子与金属离子之间的能量交换,将热能从一端传递到另一端而使金属有良好的导热性,因此可以用电子气理论解释金属Re具有良好的导电、导热性和延展性。
(2)①“焙烧”时常采用高压空气、逆流操作可增大接触面积,提高反应速率,使焙烧充分,提高原料的利用率。②ReS2在反应中转化成Ca(ReO4)2和CaSO4,ReS2作还原剂,氧气作氧化剂,反应的方程式为4ReS2+10CaO+19O22Ca(ReO4)2+8CaSO4。
(3)反萃取时R3N·HReO4与氨气反应生成NH4ReO4、R3N,反应的离子方程式为R3N·HReO4+NH3NH4++ReO4-+R3N或R3N·HReO4+NH3·H2ONH4++ReO4-+R3N+H2O;lgKb(NH3·H2O)=-4.7,Kb(NH3·H2O)=c(NH4+)c(OH-)c(NH3·H2O)=10-4.7,“反萃取”得到高铼酸铵溶液的pH=9.0,则溶液中c(OH-)=10-5 ml·L-1,则c(NH4+)c(NH3·H2O)=100.3>1,c(NH4+)>c(NH3·H2O)。
(4)由NH4ReO4的X射线衍射图谱可知,NH4ReO4具有衍射峰,说明NH4ReO4属于晶体。
(5)根据表中数据可知,在3 500 ℃时,铁转化成铁蒸气,根据图像可知,在3 500 ℃时,C和氢气生成气态物质,得到高纯度的Re。
(6)由图可知,顶角的Re原子周围有6个距离相等且最近的O原子,这6个O原子构成正八面体,因此Re原子填在O原子围成的八面体空隙中;根据均摊法可计算出一个晶胞中Re和O的个数分别为1和3,也就是1个晶胞含有1个ReO3,设晶胞的棱长为a cm,则a3=V=N·MNA·ρ=MNA·ρ,a=3MNA·ρ,晶胞的棱中心是O原子,距离最近的O原子是两条相交棱上的O原子,两者的距离为22a cm=223MNA·ρ cm。
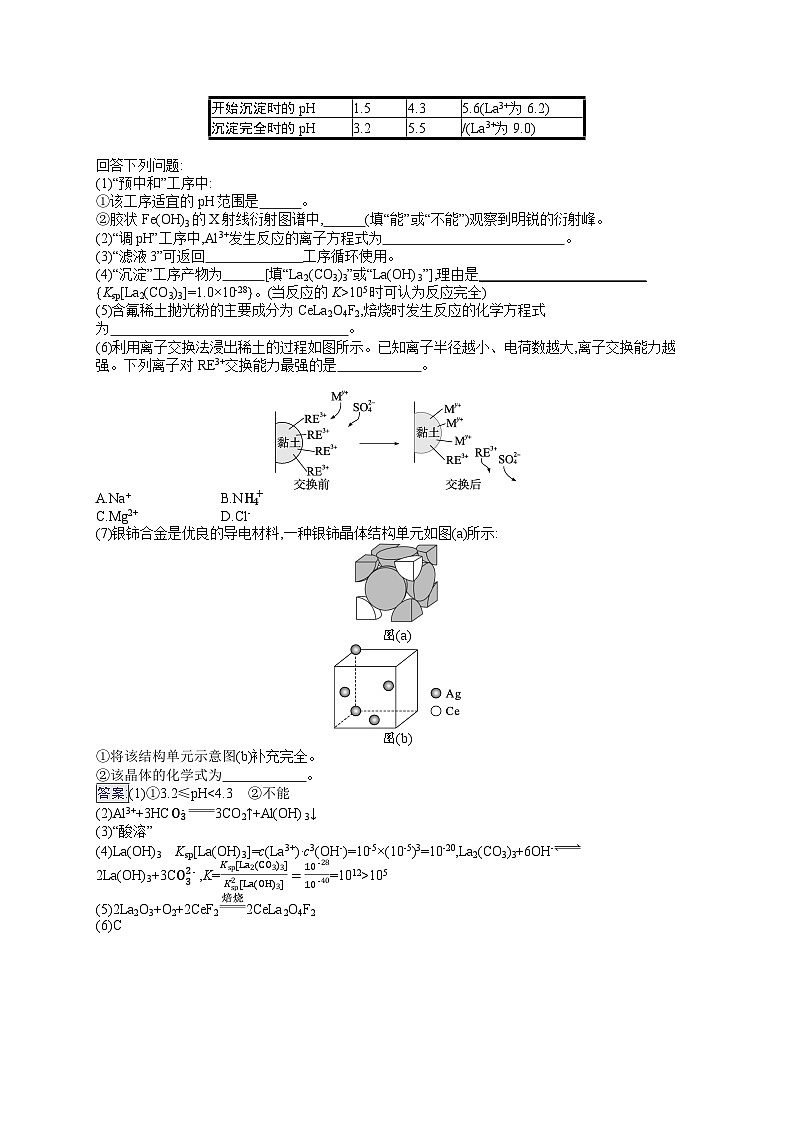
2.(2024·广东佛山质检一)稀土(RE)包括镧(La)、铈(Ce)等元素,是重要的战略资源,从离子型稀土矿(含Fe、Al等元素)中提取稀土元素并获得高附加值产品的一种工艺流程如图所示:
已知:该工艺下,除铈(Ce)外,稀土离子保持+3价不变;金属离子形成氢氧化物沉淀的相关pH见下表。
回答下列问题:
(1)“预中和”工序中:
①该工序适宜的pH范围是 。
②胶状Fe(OH)3的X射线衍射图谱中, (填“能”或“不能”)观察到明锐的衍射峰。
(2)“调pH”工序中,Al3+发生反应的离子方程式为 。
(3)“滤液3”可返回 工序循环使用。
(4)“沉淀”工序产物为 [填“La2(CO3)3”或“La(OH)3”],理由是________________________
{Ksp[La2(CO3)3]=1.0×10-28}。(当反应的K>105时可认为反应完全)
(5)含氟稀土抛光粉的主要成分为CeLa2O4F2,焙烧时发生反应的化学方程式为 。
(6)利用离子交换法浸出稀土的过程如图所示。已知离子半径越小、电荷数越大,离子交换能力越强。下列离子对RE3+交换能力最强的是 。
A.Na+B.NH4+
C.Mg2+D.Cl-
(7)银铈合金是优良的导电材料,一种银铈晶体结构单元如图(a)所示:
图(a)
图(b)
①将该结构单元示意图(b)补充完全。
②该晶体的化学式为 。
答案:(1)①3.2≤pH<4.3 ②不能
(2)Al3++3HCO3-3CO2↑+Al(OH)3↓
(3)“酸溶”
(4)La(OH)3 Ksp[La(OH)3]=c(La3+)·c3(OH-)=10-5×(10-5)3=10-20,La2(CO3)3+6OH-2La(OH)3+3CO32-,K=Ksp[La2(CO3)3]Ksp2[La(OH)3]=10-2810-40=1012>105
(5)2La2O3+O2+2CeF22CeLa2O4F2
(6)C
(7)① ②Ag15Ce
解析:稀土矿物与盐溶液发生离子交换除去矿渣,“预中和”工序中加入碳酸氢铵将铁离子转化为氢氧化铁沉淀,再加入碳酸氢铵调pH沉淀铝元素与稀土元素,在沉淀中加入氢氧化钠将氢氧化铝沉淀溶解,然后水解转化为Al(OH)3·nH2O,给稀土元素的沉淀加HCl溶解,一部分加碳酸钠沉淀之后转化为La2O3,加入CeF2焙烧转化为含氟稀土抛光粉,另一部分加草酸酸化得到La2O3和含稀土合金。
(1)①“预中和”工序中使铁离子沉淀,其他金属阳离子不沉淀,pH的范围:3.2≤pH<4.3;②只有晶体在X射线衍射图谱中才能观察到明锐的衍射峰,而胶体不是晶体。
(2)“调pH”工序中,Al3+与碳酸氢根离子强烈相互促进水解,发生反应的离子方程式为Al3++3HCO3-3CO2↑+Al(OH)3↓。
(3)滤液3中含有HCl,可以回到“酸溶”工序中循环利用。
(4)根据表中数据可得Ksp[La(OH)3]=c(La3+)·c3(OH-)=10-5×(10-5)3=10-20,La2(CO3)3+6OH-2La(OH)3+3CO32-,K=Ksp[La2(CO3)3]Ksp2[La(OH)3]=10-2810-40=1012>105。
(5)含氟稀土抛光粉的主要成分为CeLa2O4F2,焙烧时发生反应的化学方程式为2La2O3+O2+2CeF22CeLa2O4F2。
(6)根据离子半径越小、电荷数越大,离子交换能力越强,对RE3+交换能力最强的是Mg2+,故选C。
(7)①根据图(a)可以看出,Ce在前面的两个顶角,且位于面对角线的位置,Ag在剩下的6个顶角和6个面心。
②2个Ce在顶角,给晶胞的贡献为2×18=14,Ag在剩下的6个顶角和6个面心,给晶胞的贡献为6×18+6×12=154,所以化学式为Ag15Ce。
3.(2024·河北卷)V2O5是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。
已知:ⅰ.石煤是一种含V2O3的矿物,杂质为大量Al2O3和少量CaO等;苛化泥的主要成分为CaCO3、NaOH、Na2CO3等。
ⅱ.高温下,苛化泥的主要成分可与Al2O3反应生成偏铝酸盐;室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。
回答下列问题:
(1)钒原子的价层电子排布式为 ;焙烧生成的偏钒酸盐中钒的化合价为 ,产生的气体①为 (填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为 (填化学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙,发生反应的离子方程式为 ;CO2加压导入盐浸工序可提高浸出率的原因为 ;浸取后低浓度的滤液①进入 (填工序名称),可实现钒元素的充分利用。
(4)洗脱工序中洗脱液的主要成分为 (填化学式)。
(5)下列不利于沉钒过程的两种操作为 (填字母)。
a.延长沉钒时间
b.将溶液调至碱性
c.搅拌
d.降低NH4Cl溶液的浓度
答案:(1)3d34s2 +5价 CO2 (2)NaAlO2
(3)HCO3-+OH-+Ca(VO3)2CaCO3+H2O+2VO3- 提高溶液中HCO3-浓度,促使偏钒酸钙转化为碳酸钙,释放VO3- 离子交换
(4)NaCl (5)bd
解析:“焙烧”过程中,通入空气,石煤和苛化泥在高温条件下反应生成NaVO3、Ca(VO3)2、NaAlO2、Ca(AlO2)2、CaO和CO2等。“水浸”过程中,分离“焙烧”后的可溶性物质(如NaVO3)和不溶性物质[Ca(VO3)2、Ca(AlO2)2等]。“离子交换”“洗脱”过程中,富集和提纯VO3-。“沉钒”过程中,生成NH4VO3。“盐浸”过程中,滤渣①中含有钒元素,通过“盐浸”,使滤渣①中的钒元素进入滤液①中,再将滤液①回流到“离子交换”工序,进行VO3-的富集。
(1)钒是23号元素,其价层电子排布式为3d34s2;焙烧过程中,氧气被还原,V2O3被氧化生成VO3-,偏钒酸盐中钒的化合价为+5价;CaCO3在800 ℃以上开始分解,生成的气体①为CO2。
(2)由已知信息可知,高温下,苛化泥的主要成分NaOH与Al2O3反应生成偏铝酸钠,所以滤液中杂质的主要成分是NaAlO2。
(3)在弱碱性环境下,Ca(VO3)2与HCO3-和OH-反应生成CaCO3、VO3-和H2O,离子方程式为HCO3-+OH-+Ca(VO3)2CaCO3+H2O+2VO3-。滤液①中含有VO3-、NH4+等,且浓度较低,若要利用其中的钒元素,滤液①应进入“离子交换”工序。
(4)由离子交换工序中树脂的组成可知,洗脱液中应含有Cl-,考虑到水浸所得溶液中含有Na+,为避免引入其他杂质离子,且NaCl廉价易得,故洗脱液的主要成分应为NaCl。
(5)沉钒过程是生成NH4VO3。NH4Cl呈弱酸性,如果将溶液调至碱性,OH-与NH4+反应,不利于生成NH4VO3,b符合题意;降低NH4Cl溶液的浓度,也不利于生成NH4VO3,d符合题意。
4.(2024·湖北卷)铍用于航天器件的构筑。一种从其铝硅酸盐[Be3Al2(SiO3)6]中提取铍的路径如图所示。
已知:Be2++4HABeA2(HA)2+2H+
回答下列问题。
(1)基态Be2+的轨道表示式为 。
(2)为了从“热熔冷却”步骤得到玻璃态,冷却过程的特点是 。
(3)“萃取分液”的目的是分离Be2+和Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是 。
(4)写出反萃取生成Na2[Be(OH)4]的化学方程式: 。“滤液2”可以进入 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是 。
(6)Be(OH)2与醋酸反应得到某含4个Be的配合物,4个Be位于以1个O原子为中心的四面体的4个顶角,且每个Be的配位环境相同,Be与Be间通过CH3COO-相连,其化学式为 。
答案:(1)
(2)快速冷却
(3)先出现白色浑浊,后白色浑浊迅速消失
(4)BeA2(HA)2+6NaOHNa2[Be(OH)4]+4NaA+2H2O 反萃取分液
(5)增强熔融氯化铍的导电性
(6)Be4O(CH3COO)6
解析:将Be3Al2(SiO3)6加热熔融,然后快速冷却到其玻璃态,再加入稀硫酸“酸浸过滤”,“滤渣”的成分为H2SiO3,“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,“水相1”中含有Al3+,“有机相”为BeA2(HA)2,加入过量氢氧化钠反萃取Be2+使其转化为Na2[Be(OH)4]进入“水相2”中,分离出含NaA的煤油,最后对“水相2”加热,并过滤分离出Be(OH)2,通过系列操作得到金属铍,据此回答。
(1)基态Be2+的电子排布式为1s2,其轨道表示式为。
(2)熔融态物质冷却凝固时,缓慢冷却会形成晶体,快速冷却会形成非晶态,即玻璃态,所以从“热熔冷却”中得到玻璃态,其冷却过程的特点为快速冷却。
(3)“滤液1”中有Be2+和Al3+,加入含HA的煤油将Be2+萃取到有机相中,则“水相1”中含有Al3+,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,发生反应:Al3++3OH-Al(OH)3↓、Al(OH)3+OH-[Al(OH)4]-,可观察到的现象为先出现白色浑浊,后白色浑浊迅速消失。
(4)反萃取生成Na2[Be(OH)4]的化学方程式为BeA2(HA)2+6NaOHNa2[Be(OH)4]+4NaA+2H2O;“滤液2”的主要成分为NaOH,可进入“反萃取分液”步骤再利用。
(5)氯化铍熔融态导电性弱,电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用为增强熔融氯化铍的导电性。
(6)由题意可知,该配合物中有4个Be位于四面体的4个顶角,四面体中心只有1个O,Be与Be之间总共有6个CH3COO-,则该配合物的化学式为Be4O(CH3COO)6。
5.(2024·安徽黄山二模)氧缺位体(CuFe2O4-δ)是热化学循环分解水制氢的催化剂。一种以黄铜矿(主要成分是CuFeS2,含Al2O3、SiO2等杂质)为原料制备CuFe2O4-δ的流程如图所示:
已知:①酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+
②25 ℃时已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)CuFeS2“焙烧”时生成三种氧化物,其中金属氧化物的化学式为 。
(2)“焙烧”产物中的SO2在有氧条件下利用石灰浆液吸收可制得一种副产品 (填化学式)。
(3)流程中,若无“还原”工序,造成的后果是 。
(4)已知Cu(NH3)2Cl2有两种同分异构体,则“沉铁”过程中生成的[Cu(NH3)4]2+的空间结构是 。
(5)“灼烧”工序的化学方程式是 , “煅烧”时通入N2的作用是 。
(6)“煅烧”CuFe2O4得到氧缺位体(CuFe2O4-δ)时,不同温度范围内,发生变价的金属元素不同,某温度下制得的氧缺位体质量为原质量的99%,则δ= 。
(7)氧缺位体催化分解水制氢可分为两步:
第一步:
(完成方程式);
第二步:2CuFe2O42CuFe2O4-δ+δO2↑。
答案:(1)CuO、Fe3O4
(2)CaSO4
(3)还原工序是将Fe3+还原为Fe2+,若没有还原工序,Fe3+会形成Fe(OH)3进入滤渣2中
(4)平面正方形
(5)CuO+2Fe(OH)3CuFe2O4+3H2O 作保护气 (6)0.15
(7)CuFe2O4-δ+δH2OCuFe2O4+δH2↑
解析:氧气具有氧化性,已知酸浸后溶液中的金属离子有Cu2+、Fe2+、Al3+和Fe3+,CuFeS2“焙烧”生成三种氧化物,可知三种氧化物为SO2、CuO、Fe3O4;加入硫酸,金属氧化物转化为相应的硫酸盐,“滤渣1”为SiO2,加入Cu还原Fe3+为Fe2+,加入CuO调节pH使Al3+沉淀,而Cu2+和Fe2+不沉淀,“滤渣2”中有Al(OH)3、CuO、Cu,加H2O2将Fe2+氧化为Fe3+,加入过量的氨水反应生成Cu(NH3)4SO4,Fe3+生成Fe(OH)3沉淀,Cu(NH3)4SO4经过系列操作生成CuO,灼烧CuO和Fe(OH)3生成CuFe2O4,在N2作保护气下“煅烧”生成CuFe2O4-δ。
(1)由分析知金属氧化物的化学式为CuO、Fe3O4。
(2)“焙烧”产物中的SO2在有氧条件下利用石灰浆液Ca(OH)2吸收可制得的一种副产品是CaSO4。
(4)已知Cu(NH3)2Cl2有两种同分异构体,可知其结构不是四面体结构,而是平面四边形结构,故[Cu(NH3)4]2+的空间结构为平面正方形。
(5)灼烧CuO和Fe(OH)3生成CuFe2O4,N2作保护气,防止生成物被氧化。
(6)“煅烧”CuFe2O4得到氧缺位体(CuFe2O4-δ),质量减少的是氧气质量,16δ64+2×56+4×16×100%=1-99%,δ=0.15。
(7)制取氢气的总反应为2H2O2H2↑+O2↑,结合第二步反应2CuFe2O42CuFe2O4-δ+δO2↑,可知第一步反应为CuFe2O4-δ+δH2OCuFe2O4+δH2↑。
6.镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等]中回收制备NiSO4·nH2O和其他金属及其化合物的工艺流程如图所示。
已知:“萃取”可将金属离子进行富集与分离,原理如下:
X2+(水相)+2RH(有机相)XR2(有机相)+2H+(水相)
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有 (填元素符号)。原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用“+12”表示,与之相反的用“-12”表示,“±12”即称为电子的自旋磁量子数。对于基态Ni原子,其价层电子自旋磁量子数的代数和为 。
(2)已知NiO与MgO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66 pm和69 pm。则熔点:NiO (填“>”“<”或“=”)MgO,理由是 。
(3)“滤渣Ⅰ”的主要成分为 (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是 。
(5)“反萃取”时加入的试剂A为 。
(6)“反萃取”得到的NiSO4溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由NiSO4溶液获得NiSO4·7H2O晶体的操作依次是蒸发浓缩、 、 过滤、洗涤、干燥。
答案:(1)K、Cu -1(或+1)
(2)< Mg2+的半径比Ni2+的小,MgO的离子键比NiO的强
(3)SiO2
(4)使铁离子形成Fe(OH)3沉淀,除去铁元素
(5)H2SO4(或硫酸)
(6)2Ni2++ClO-+4OH-2NiOOH↓+Cl-+H2O
(7)冷却至30.8 ℃以下结晶
解析:(1)铬元素的基态原子中最外层电子排布为4s1,与铬同周期最外层电子排布为4s1的元素还有K、Cu。基态Ni原子的价层电子轨道表示式为,则其价层电子自旋磁量子数的代数和为-1(或+1)。
(2)NiO与MgO都是离子晶体,Mg2+的半径比Ni2+的小,MgO的离子键比NiO的强,则熔点:NiO
(4)根据流程中信息,电解得到金属铜,加入Na3PO4除去铬元素,经过“萃取”与“反萃取”富集镍元素,因此加入Na2CO3是为了除去铁元素。
(5)根据X2+(水相)+2RH(有机相)XR2(有机相)+2H+(水相),“反萃取”要增大氢离子浓度,且不能引入杂质,所以A为硫酸。
(6)根据得失电子守恒、原子守恒可得:2Ni2++ClO-+4OH-2NiOOH↓+Cl-+H2O。
(7)根据信息可知,低于30.8 ℃时,晶体形态为NiSO4·7H2O,所以由NiSO4溶液获得NiSO4·7H2O晶体的操作依次是蒸发浓缩、冷却至30.8 ℃以下结晶、过滤、洗涤、干燥。
物质
熔点/℃
沸点/℃
Re
3 180
5 900
C
3 652
4 827
Fe
1 535
2 750
离子
Fe3+
Al3+
RE3+
开始沉淀时的pH
1.5
4.3
5.6(La3+为6.2)
沉淀完全时的pH
3.2
5.5
/(La3+为9.0)
氢氧化物
Fe(OH)3
Al(OH)3
Cu(OH)2
Fe(OH)2
开始沉淀的pH
1.9
3.4
6.4
7.0
完全沉淀的pH
3.2
4.7
7.6
9.0
温度
低于30.8 ℃
30.8~53.8 ℃
53.8~280 ℃
高于280 ℃
晶体形态
NiSO4·7H2O
NiSO4·6H2O
多种结晶水合物
NiSO4
备战2025年高考二轮复习化学(通用版)大题突破练1 化学工艺流程题(Word版附解析): 这是一份备战2025年高考二轮复习化学(通用版)大题突破练1 化学工艺流程题(Word版附解析),共6页。试卷主要包含了6%,62×103g4,铍用于航天器件的构筑等内容,欢迎下载使用。
备战2025年高考二轮复习化学(通用版)大题突破练2 化学实验综合题(Word版附解析): 这是一份备战2025年高考二轮复习化学(通用版)大题突破练2 化学实验综合题(Word版附解析),共6页。试卷主要包含了80%,5 g)使之饱和等内容,欢迎下载使用。
适用于新高考新教材2024版高考化学二轮复习大题突破练一化学工艺流程题(附解析): 这是一份适用于新高考新教材2024版高考化学二轮复习大题突破练一化学工艺流程题(附解析),共8页。












