

上海市洋泾中学2024-2025学年高三上学期期中考试 化学试卷
展开命题:罗芸芸审题:张美晗终审:喻华
本卷卷面总分100分,考试时间为60分钟。
一、微观结构
1.1医学界通过用放射性来标记,发现的一种羧酸衍生物在特定条件下可通过来杀死细胞,从而抑制艾滋病()。下列说法正确的是( )
A.与石墨互为同位素的中子数与质子数相差2
C.常温下,易溶于氯化钠溶液
D.基态碳原子层的轨道表示式为
1.2的分子结构与相似,如图所示。下列有关说法错误的是( )
A.是极性分子
B.分子中所有原子均满足8电子稳定结构
C.分子中既含有极性键又含有非极性键
D.的相对分子质量比大,熔、沸点高
1.3一种超导材料中含、、、等元素。下列说法正确的是( )
A.原子半径:B.第一电离能:
C.酸性强弱:D.基态原子轨道上有9个电子
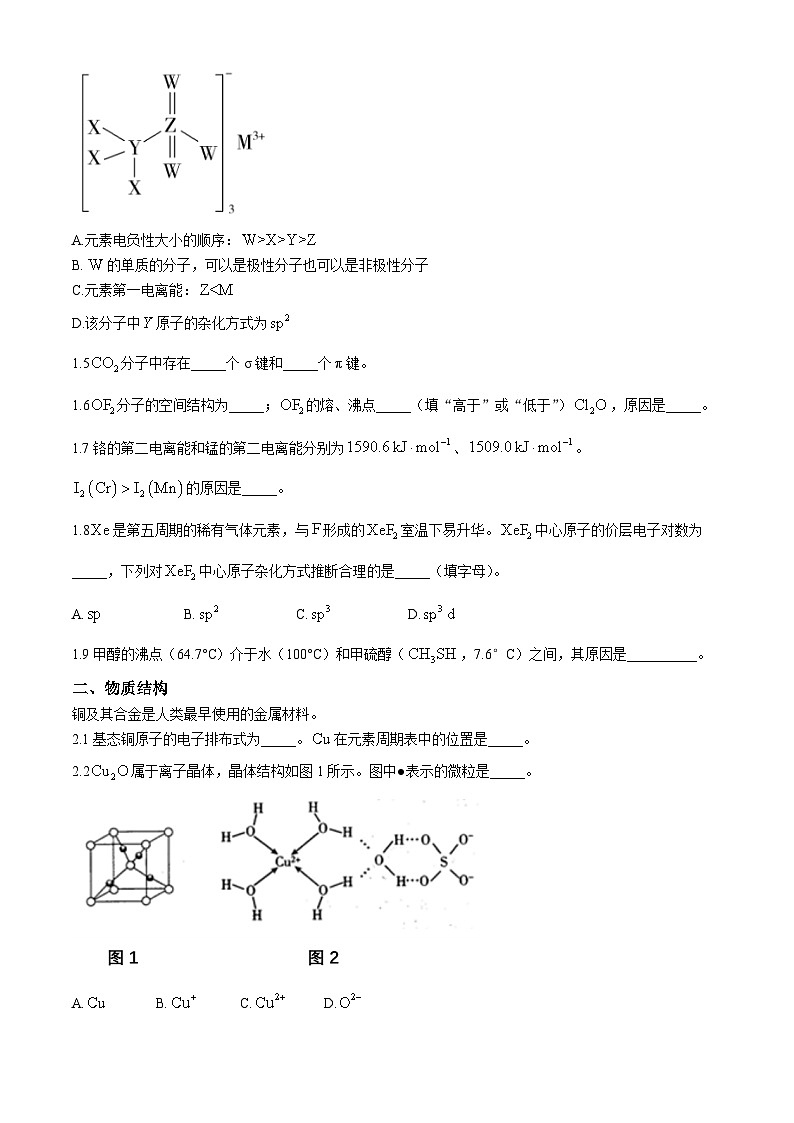
1.4某种化学品的结构如图所示,已知、、、、均为短周期主族元素,其中、、在同一周期,、同处另一周期,的简单阳离子半径是同周期中最小的,则下列说法中正确的是( )
A.元素电负性大小的顺序:
B.的单质的分子,可以是极性分子也可以是非极性分子
C.元素第一电离能:
D.该分子中原子的杂化方式为
1.5分子中存在_____个σ键和_____个π键。
1.6分子的空间结构为_____;的熔、沸点_____(填“高于”或“低于”),原因是_____。
1.7铬的第二电离能和锰的第二电离能分别为、。
的原因是_____。
1.8是第五周期的稀有气体元素,与形成的室温下易升华。中心原子的价层电子对数为_____,下列对中心原子杂化方式推断合理的是_____(填字母)。
A.B.C.D.
1.9甲醇的沸点(64.7°C)介于水(100°C)和甲硫醇(,7.6°C)之间,其原因是__________。
二、物质结构
铜及其合金是人类最早使用的金属材料。
2.1基态铜原子的电子排布式为_____。在元素周期表中的位置是_____。
2.2属于离子晶体,晶体结构如图1所示。图中●表示的微粒是_____。
A.B.C.D.
2.3已知分子中键角为,则中键角_____。
A.大于B.小于C.等于D.等于120°
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可表示如图2。
2.4中S原子的杂化类型为_____。
2.5胆矾的化学式用配合物的形式可表示为_____。胆矾所含键的数目为:_____。
2.6中称为配体,其配位原子是碳原子而不是氧原子,理由是_____。
2.7的一种配合物化学式为,下列说法正确的是_____(不定项选择)。
A.与配位时,提供孤电子对的是原子
B.的配位数为6
B.中原子的杂化类型为、
D.中键与键数目之比为5:2
2.8光谱证实单质铝与强碱性溶液反应有生成,则中存在_____。(不定项选择)
A.共价键B.非极性键C.配位键D.键E.键
2.9可形成两种钴的配合物,已知的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加溶液时,产生白色沉淀,在第二种配合物的溶液中加溶液时,无明显现象。则第一种配合物可表示为_____。若在第二种配合物的溶液中滴加溶液,则产生的现象是_____。
三、工业上的化学基本原理
钒广泛应用于催化及钢铁工业,有“化学面包”“金属维生素”之称。溶解溶液中,可得到钒酸钠,已知空间构型与相同。
3.1中心原子价层孤电子对数目为_____。
A.0B.1C.2D.3
3.2短周期元素形成的各微粒中,与空间构型相同的正离子有_____(任写一种)。与钒同周期的所有元素的基态原子中,未成对电子数最多的是_____(填元素符号)。
常用作转化为的催化剂。一定条件下,在固定容积的密闭容器中充入与空气的混合气体,加入一定量,反应后,容器中和物质的量浓度分别为和。
3.3起始物质的量浓度为_____(用含、的代数式表示)。这段时间内用表示的平均化学反应速率为_____(用含、、的代数式表示)。
3.4在未使用催化剂时,SO氧化反应的能量变化如图所示。加入后,会使图中_____。
A.增大、减小B.减小、增大
C.减小、不变D.减小、增大
尿素是一种重要的氮肥。工业上以和为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:(氨基甲酸铵)
反应Ⅱ:
总反应Ⅲ:
3.5反应Ⅰ的熵变_____0(填“>”“=”或“<”),反应Ⅲ的_____。
溶液吸收时,随着的通入,会得到不同溶质组成的溶液。时,
、、的物质的量分数与的关系如右图所示。
3.6曲线Ⅱ代表的微粒是_____。
3.7等浓度和的混合溶液中,下列关系正确的是( )
A.
B.
C.
D.
我国科学家以材料作光电阴极、饱和的的溶液作电解液,将转化为,原理如图所示。
3.8根据图示,写出光电二氧化碳转化电极反应式_____。
3.9从能源利用和资源综合利用角度分析该方法优点是_____。
四、铁及其化合物
4.1二茂铁分子是一种金属有机配合物,是燃油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是( )
A.二茂铁中与环戊二烯离子之间为离子键
B.环戊二烯()中含有键的数目为表示阿伏加德罗常数的值)
C.分子中存在键
D.的电子排布式为
4.2现代污水处理工艺中常利用聚合铁在水体中形成絮状物,以吸附等重金属离子,聚合铁简称,化学式为。下列说法错误的是( )
A.中铁元素显+3价
B.基态铁原子的价层电子排布式为
C.由溶液制备需经过氧化、水解和聚合等过程
D.由表可知再失去一个电子时,气态比气态难
氮化铁晶体可应用于磁记录材料领域,其晶胞结构如下图所示:
4.3对于a位置的原子,与其最近的且距离相等的N原子有_____个。
A.2B.4C.6D.8
4.4该氮化铁晶体的化学式为_____。
A.B.C.D.
4.5结合图中数据,已知铁、氮的相对原子质量分别为56、14,计算该晶胞的密度_____
(设为阿伏加德罗常数,用含和的代数式表示)
向溶液中持续通入至饱和,有微量黑色的沉淀生成,该溶液中(忽略浓度的变化和溶液体积的变化),已知常温下,的电离常数分别为:、
4.6写出生成黑色沉淀的离子方程式_____。
溶液中_____;溶液中_____。
工业上以铬铁矿(主要成分为、,还含有、等杂质)为主要原料生产红矾钠晶体,其主要工艺流程如图:
已知:在碱性条件下能将氧化为。
4.7固体A为_____。
4.8实验室中操作①②的名称为_____
4.9固体C中含有的物质是和,则的作用是_____。
已知:,当时开始沉淀。室温下,Ⅱ中需调节溶液pH范围为_____(杂质离子浓度小于视为沉淀完全)。
4.10写出III中发生反应的离子方程式_____。
4.11IV中酸化是用硫酸而不用盐酸酸化,理由是_____。
三草酸合铁(Ⅲ)酸钾含量测定
测定三草酸合铁(Ⅲ)酸钾样品纯度的方法如下:
称取样品,放入锥形瓶中,加入水和,用标准溶液滴定至终点,反应原理为:
4.12确认滴定终点的操作是_____。
4.13若最终消耗标准溶液23.19,则样品纯度为(精确到0.1%)_____。
(已知的摩尔质量为)
五、格林尼亚试剂
卤化镁的有机金属化合物称为“格林尼亚试剂”,在有机合成中具有较高的应用价值。从基础化工原料乙烯出发,通过格林尼亚试剂合成二酮Ⅰ的路线如下所示:
已知D-A反应:
5.1工业上大量获取乙烯的方法是_____。
A.石油分馏B.重油裂解C.乙醇脱水D.乙炔氢化
5.2写出的反应式:_____。
5.3已知为D-A反应,H的结构简式为_____。
5.4C的一种同分异构体与C具有相同官能团,核磁共振氢谱有三组峰,峰面积之比为9:2:1,该同分异构体的结构简式为_____。
5.5D的各种同分异构体的质谱图中,分子离子峰的的值均为_____。
已知:。二酮Ⅰ在碱性溶液中易发生分子内缩合成双环结构(),主要产物为J和另一种,一不饱和酮K。
5.6的结构简式为_____。
5.7结合题示信息,设计仅用环己烯()为有机原料合成的路线(其他无机试剂和有机溶剂任选)。
上海市洋泾中学2024学年度第一学期
高三化学等级期中考试参考答案
一、微观结构(本题共20分)
1.B(2分)2.D(2分)3.A(2分)4.B(2分)5.2(1分)2(1分)
6.V形(1分)低于(1分)和都是分子晶体,结构相似,的相对分子质
量大,的熔、沸点高(2分)
7.铬的第二电离能是失去半充满上的电子所需吸收的能量,较高。而锰原子失去两个电子后,此时变为较稳定的半充满状态,较低(2分)
8.5(1分)D(1分)
9.甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多(2分)
二、物质结构(本题共20分)
1.(1分)第四周期IB族族(1分)
2.B(2分)3.A(2分)4.杂化(1分)
5.(2分)(2分)
6.C的电负性小于,供电子能力强于(2分)
7.BD(2分)8.ACD(2分)9.(2分)生成淡黄色沉淀(1分)
三、工业上的化学基本原理(本题共20分)
1.A(1分)2.(1分)(2分)
3.(2分)(2分)4.C(2分)5.(1分)(1分)
6.(2分)7.B(2分)
8.(2分)
9.利用太阳光能理论上无需额外消耗能量,将捕集的转化为有用的产品,既能有效减少温室气体的排放量,又能充分利用碳资源。(2分)
四、铁及其化合物(本题共24分)
1.C(2分)2.D(2分)3.D(1分)4.C(1分)
5.(2分)
6.
7.;(1分)8.过滤;(1分)
9.氧化,使铁元素完全转化成沉淀而除去(1分);;(2分)
10.;(2分)
11.酸性条件下能氧化(方程式也可);(2分)
12.加入最后半滴高锰酸钾标准溶液,锥形瓶中溶液变为浅紫色,且30s内不褪色(2分)
13.78.6%(2分)
五、格林尼亚试剂(本题共16分)
1.B(2分)
2.(2分)
3.(2分)4.(2分)
5.70(2分)6.(2分)
7.(4分)
元素
电离能()
717
1509
1509
1561
3248
2957
上海市洋泾中学2024-2025学年高三上学期9月质量检测+化学试卷+: 这是一份上海市洋泾中学2024-2025学年高三上学期9月质量检测+化学试卷+,共11页。
上海市洋泾中学2023-2024学年高三上学期9月月考化学试卷: 这是一份上海市洋泾中学2023-2024学年高三上学期9月月考化学试卷,共8页。试卷主要包含了3%,ρ=1等内容,欢迎下载使用。
上海市洋泾中学2012学年第二学期高二化学期末考试试卷: 这是一份上海市洋泾中学2012学年第二学期高二化学期末考试试卷,共6页。试卷主要包含了选择题等内容,欢迎下载使用。












