

广东省深圳市高级中学2024-2025学年高二上学期期中考试化学试题
展开
这是一份广东省深圳市高级中学2024-2025学年高二上学期期中考试化学试题,共11页。试卷主要包含了考试结束,监考人员将答题卡收回,某实验小组以分解为例,研究浓度等内容,欢迎下载使用。
命题人:蔡立媚 审题人:冷亚梅
本试卷由二部分组成。
第一部分:客观题44分,第二部分:主观题56分。
全卷共计100分,考试时间为75分钟。
注意事项:
1、答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目用铅笔涂写在答题卡上。
2、每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动用橡皮擦干净后再涂其它答案,不能答在试卷上。
3、考试结束,监考人员将答题卡收回。
可能用到的原子量:H-1 C-12 O-16 Fe-56 Cu-64
第Ⅰ卷(本卷共计44分)
一、单选题(每小题只有一个选项符合题意,共10题,每题2分,共20分)
1.中华民族的发明创造为人类文明进步做出了巨大贡献,下列没有涉及化学反应的是
2.化学与生产、生活及很多研究领域存在着广泛的联系。下列说法正确的是
A.使用植物秸秆转化的乙醇为燃料,可以减少污染,实现碳的零排放
B.“暖贴”主要成分为铁粉、活性炭、无机盐等合成的聚合物,利用原电池原理加快了反应速率
C.2023年诺贝尔化学奖授予量子点研究,其组成为2~20nm的纳米粒子,则直径为10nm的硅量子点属于胶体
D.使用防腐剂可以减缓食物变质速度,为保持食品营养价值,防腐剂用量越多越好
3.下列化学用语正确的是
A.的电子式:B.HClO的结构式:H-O-Cl
C.质子数为53、中子数为78的碘原子:D.的结构示意图:
4.设为阿伏加德罗常数的值。下列有关描述正确的是
A.标准状况下,的氧原子数为
B.和在一定条件下充分反应后,混合物的分子数大于
C.分别由和制备等量的氧气转移的电子数目相等
D.、下,5.6L氧气中质子的数目为
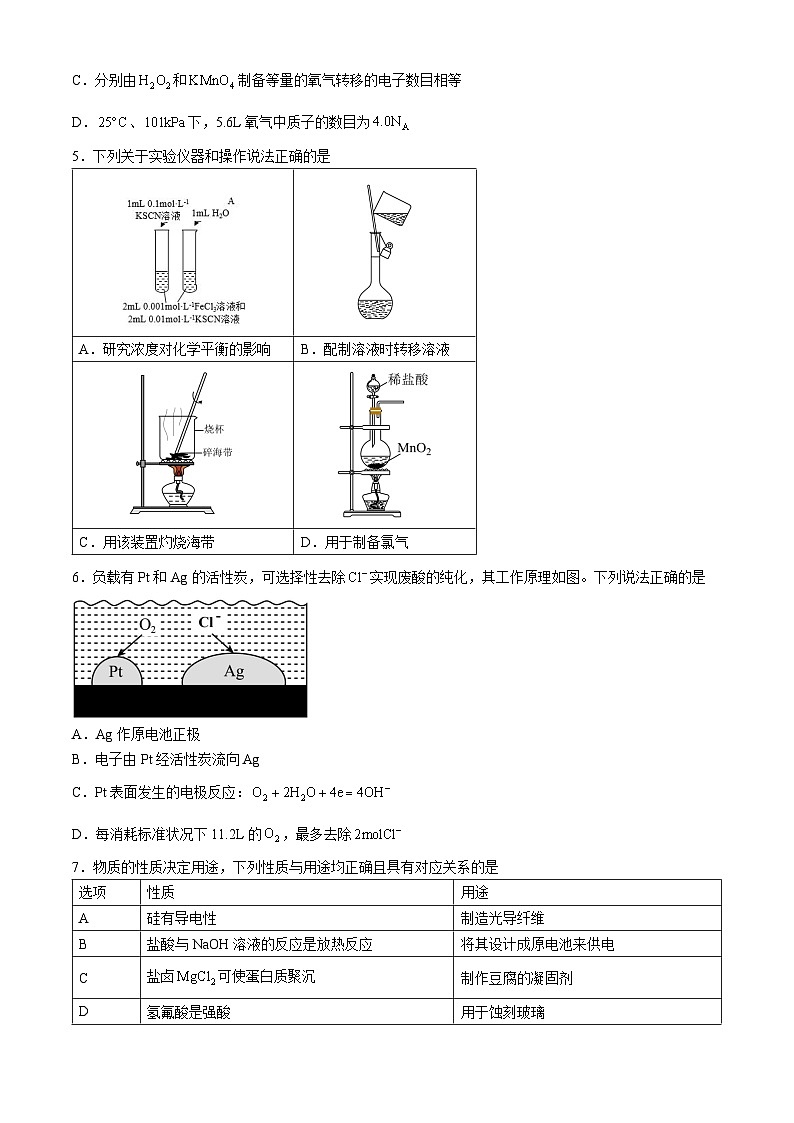
5.下列关于实验仪器和操作说法正确的是
6.负载有Pt和Ag的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是
A.Ag作原电池正极
B.电子由Pt经活性炭流向Ag
C.Pt表面发生的电极反应:
D.每消耗标准状况下11.2L的,最多去除
7.物质的性质决定用途,下列性质与用途均正确且具有对应关系的是
8.下列化学方程式或叙述正确的是
A.已知甲烷的燃烧热为,则甲烷燃烧的热化学方程式可表示为:
B.向硫代硫酸钠溶液中滴加稀硫酸:
C.已知 ,则在一定条件下向密闭容器中充入和充分反应放出46.2 kJ的热量
D.模拟侯氏制碱法制备晶体:
9.为研究金属的电化学腐蚀机理,某小组同学采用传感器设计如图所示装置。下列说法不正确的是
A.碳粉作正极
B.负极电极反应式:
C.若压强传感器显示压强升高,则以吸氧腐蚀为主
D.若将碳粉换成锌粉,则Fe可被保护
10.工业上可通过甲醇羰基化法制取甲酸甲酯在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化如下图所示。下列说法不正确的是
A.增大压强甲醇转化率增大B.b点反应速率
C.平衡常数D.生产时反应温度控制在80~85℃为宜
二、单选题(每小题只有一个选项符合题意,共6题,每题4分,共24分)
11.对溶液与KI溶液的反应进行探究。关于实验的分析和结论不正确的是
A.与KI发生了氧化还原反应,有生成
B.试管1中溶液显红色证明与KI的反应具有可逆性
C.试管2中上层溶液为的溶液
D.试管3中红色比试管1中浅是平衡移动的结果
12.在含、和的溶液中,发生反应:,其反应进程中的能量变化如下,下列有关该反应的说法正确的是
A.步骤①的热化学方程为:
B.决速步骤为第②步
C.该总反应为放热反应
D.可以使反应物分子中活化分子百分数增大
13.利用电渗析法淡化海水的原理如图所示。下列说法正确的是
A.该装置将化学能转化成电能
B.阴极发生的电极反应为
C.若将、膜的位置互换,则不能获得淡水
D.Ⅱ室中流出淡水,Ⅰ、Ⅲ室流出液中NaCl浓度变大
14.BASF高压法采用和CO制备醋酸的循环过程如图所示,下列说法错误的是
A.HI在流程中起催化作用
B.循环过程需不断补充CO和甲醇
C.循环总过程不涉及氧化还原反应
D.反应总方程式:
15.化学是以实验为基础的科学,下述实验操作能达到预期目的的是
16.某同学在室温下进行下图所示实验。(已知:为二元弱酸)
试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是
A.反应的离子方程式为
B.试管c反应至300s时,溶液中剩余的
C.对比试管a、b,得到的结论是水溶液浓度增大,反应速率加快
D.对比试管c、d,可验证浓度对反应速率的影响
第Ⅱ卷(本卷共计56分)
三、主观题(共4题,共计56分)
17、(14分)能源是现代社会物质文明的原动力,研究化学反应能量变化意义重大。回答下列问题:
Ⅰ.(1)工业生产中可利用还原制备清洁能源甲醇。
①由如下图的能量转化关系可知生成需要________(填“吸收”或“放出”)________kJ能量。
(2)和1mlCO反应生成和NO过程中的能量变化示意图如图所示,已知,,和CO反应的热化学方程式为________________。
Ⅱ.某化学小组用盐酸、溶液和如下图装置进行中和反应反应热的测定实验。
(3)从图中实验装置看,缺少的一种玻璃仪器是________;
(4)某次实验测得中和热的数值小于(理论值),产生偏差的原因可能是________(填标号)。
A.实验装置保温、隔热效果差
B.用量筒量取盐酸的体积时仰视读数
C.盐酸与NaOH溶液混合后立即记录温度
D.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
(5)实验中若改用溶液和溶液进行反应,与上述实验相比,通过计算可得生成时所放出的热量________(填“相等”或“不相等”)。若用醋酸代替溶液进行上述实验,测得反应前后温度的变化值会________(填“偏大”“偏小”或“无影响”)。
18、(14分)某实验小组以分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
(1)实验①和②的目的是探究________对反应速率的影响。实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下稳定,不易分解。为了达到实验目的,你对原实验方案的改进是________________________________________________________。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图。
分析下图能够得出的实验结论:
(1)________环境能增大分解的速率;
(2)________环境能减小分解的速率。
③基于以上结论该小组提出可以用固体与溶液反应制,反应的化学方程式为________。小组同学设计实验进一步探究和对分解的催化效果,分别设计了如下图甲、乙两种实验装置。
(3)有同学提出将,改为更为合理,其理由是_____________________。
(4)若利用乙实验可进行定量比较分析,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中还需要用到的实验仪器为________________。
(5)使用催化剂催化分解的反应中,催化剂改变了________(填字母序号)
A.活化分子百分数B.反应限度C.反应焓变
D.反应路径E.反应活化能
19、(14分)Ⅰ、某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过________ml电子。
(2)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成型,乙装置中石墨(1)为________极(填“正”、“负”、“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为________。
Ⅱ、小组同学设计一个燃料电池并探究氯碱工业原理和电解溶液原理,其中乙装置中X为阳离子交换膜。请完成以下问题:
(3)甲池中负极电极反应式为:____________________________________________________。
(4)实验开始时,向乙池左右两边同时各滴入几滴酚酞试液:
①在Fe极附近观察到的现象是__________________________________________________;
②电解一段时间后,该池总反应离子方程式为_____________________________________;
(5)丙池中两电极都为惰性电极,阳极电极反应式为:________________________________。
20、(14分)Ⅰ.和重整制取合成气CO和,在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:
反应a:
反应b:
(1)重整时往反应体系中通入一定量的水蒸气,可在消除积碳的同时得到合成气,已知反应c:
则 ________。
(2)在恒温恒容下,同时放入、、、四种物质,下列事实能够说明反应已达到平衡的是________。
A.反应体系中,混合气体的密度不再改变
B.反应体系中,各组分的物质的量相等
C.反应体系中,当有键断裂的同时有键断裂
D.混合气体的平均相对分子质量保持不变
(3)利用和重整技术获得合成气不同配比随温度变化对出口合成气中的影响如下图所示:
对于反应a,试比较M点和N点的转化率:M________N(填“>”“ =
(4)体系中的反应以反应b为主,反应物氢气的浓度减小、生成物一氧化碳的浓度增大,导致减小
(5) 1
A
B
C
D
神十一载人飞船发射
陶器烧制
湿法炼铜
打磨磁石制司南
A.研究浓度对化学平衡的影响
B.配制溶液时转移溶液
C.用该装置灼烧海带
D.用于制备氯气
选项
性质
用途
A
硅有导电性
制造光导纤维
B
盐酸与NaOH溶液的反应是放热反应
将其设计成原电池来供电
C
盐卤可使蛋白质聚沉
制作豆腐的凝固剂
D
氢氟酸是强酸
用于蚀刻玻璃
实验操作
实验现象
1
取溶液于试管中,滴加溶液3滴,振荡,充分反应
溶液呈深棕黄色
2
将溶液均分后置于试管1和试管2中
向试管1中滴加2滴溶液
溶液显红色
向试管2中加入,充分振荡、静置
溶液分层,上层为浅棕黄色,下层为紫色
③
取试管2的上层液体置于试管3中,滴加2滴溶液
溶液微弱变红
选项
实验操作
实验目的
A
向40mL沸水中逐滴加入5~6滴饱和溶液,继续煮沸至液体呈红褐色,停止加热
制备胶体
B
在溶液中通入气体
证明酸性:
C
向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
检验该溶液是否含
D
分别向2支试管中加入和的溶液,再向其中1支加入少量粉末
研究催化剂对分解速率的影响
分组实验
催化剂
①
溶液
无
②
溶液
无
③
溶液
溶液
④
溶液+少量稀盐酸
溶液
⑤
溶液+少量NaOH溶液
溶液
相关试卷
这是一份广东省深圳市盐田高级中学2024-2025学年高一上学期11月期中考试 化学试题,共8页。
这是一份【名校】广东省深圳市盐田高级中学2024-2025学年高二上学期11月期中考试化学试题,文件包含高二化学试卷pdf、高二化学答案pdf、高二化学期中答题卡pdf等3份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。
这是一份广东省深圳市盐田高级中学2024-2025学年高二上学期11月期中考试 化学试题,文件包含高二化学试卷pdf、高二化学答案pdf、高二化学期中答题卡pdf等3份试卷配套教学资源,其中试卷共13页, 欢迎下载使用。








