
晶胞和物质结构与性质综合 练习—高考化学二轮复习
展开
这是一份晶胞和物质结构与性质综合 练习—高考化学二轮复习,共9页。试卷主要包含了硅材料在生活中占有重要地位,铜锡硫等为原料制备等内容,欢迎下载使用。
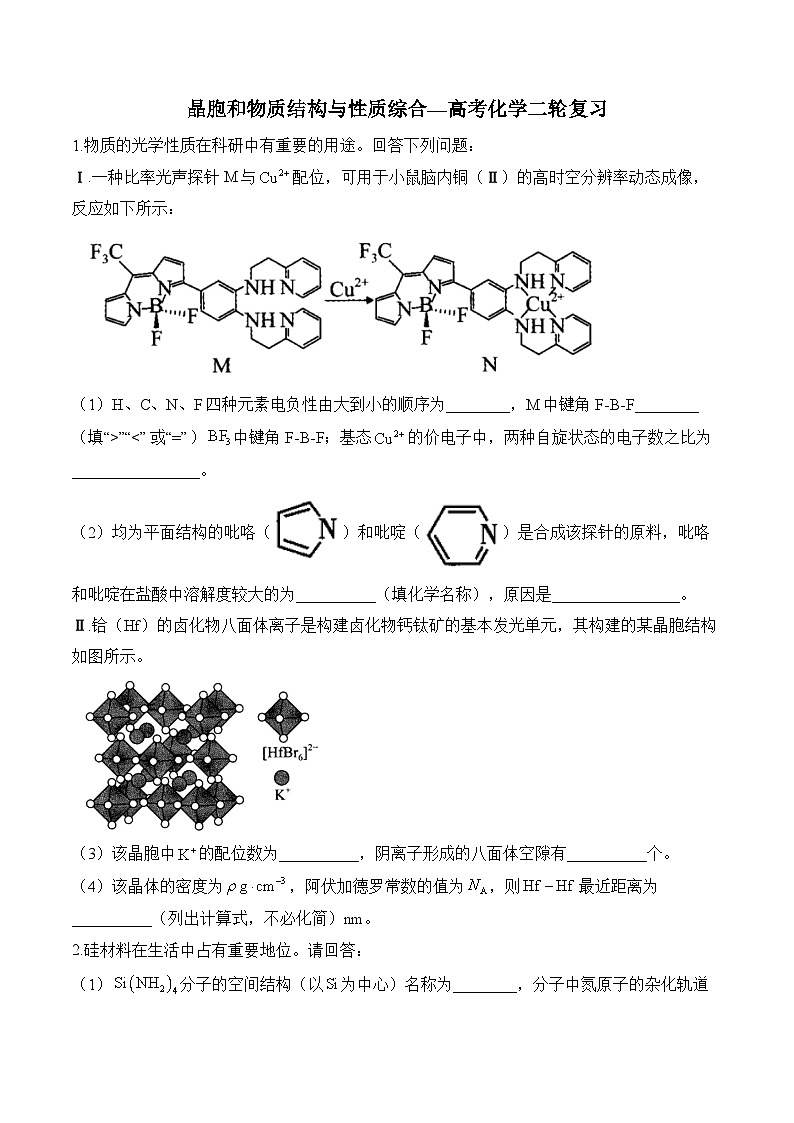
Ⅰ.一种比率光声探针M与配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
(1)H、C、N、F四种元素电负性由大到小的顺序为________,M中键角F-B-F________(填“>”“①>②
B.电子排布属于基态原子(或离子)的是:①②
C.电离一个电子所需最低能量:①>②>③
D.得电子能力:①>②
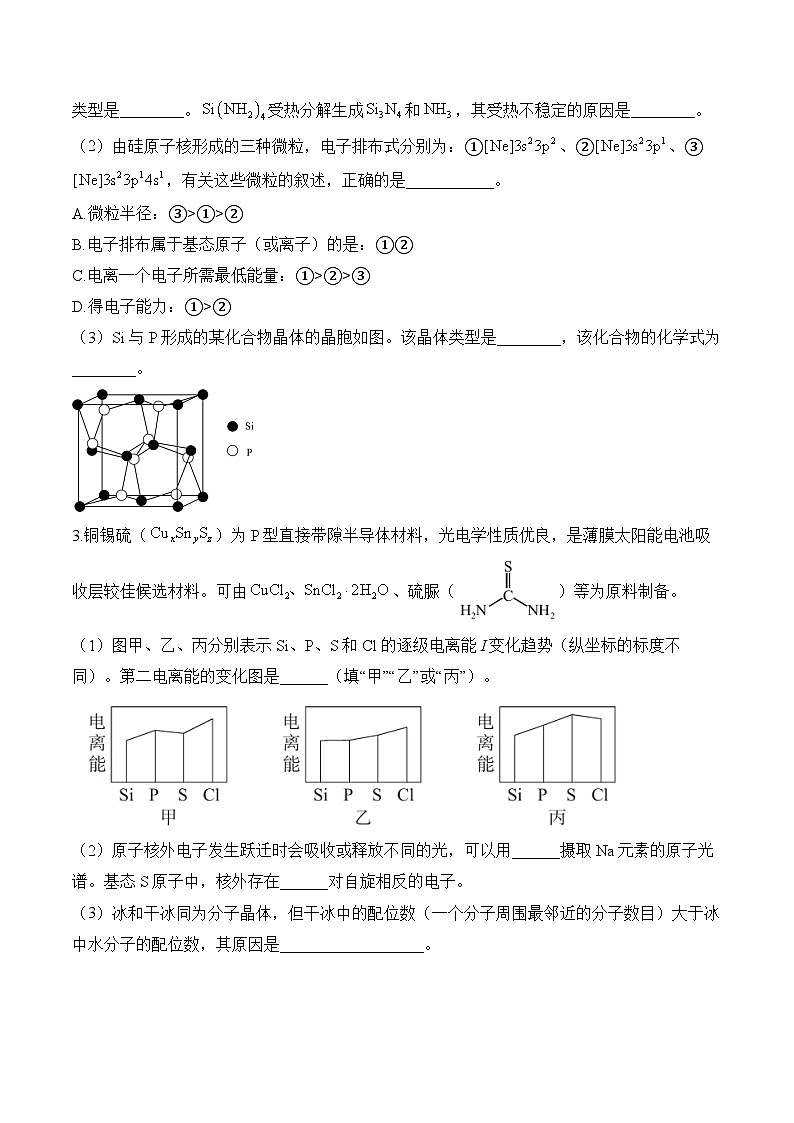
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是________,该化合物的化学式为________。
3.铜锡硫()为P型直接带隙半导体材料,光电学性质优良,是薄膜太阳能电池吸收层较佳候选材料。可由、硫脲()等为原料制备。
(1)图甲、乙、丙分别表示Si、P、S和Cl的逐级电离能I变化趋势(纵坐标的标度不同)。第二电离能的变化图是______(填“甲”“乙”或“丙”)。
(2)原子核外电子发生跃迁时会吸收或释放不同的光,可以用______摄取Na元素的原子光谱。基态S原子中,核外存在______对自旋相反的电子。
(3)冰和干冰同为分子晶体,但干冰中的配位数(一个分子周围最邻近的分子数目)大于冰中水分子的配位数,其原因是__________________。
(4)硫脲()是一种有机化合物,分子中N的一个______杂化轨道与H的1s轨道形成N-H______键。硫氰酸()的沸点比异硫氰酸()低,原因是__________________。
(5)是p型半导体材料,属于立方晶体,如图所示,其晶胞参数为543 pm,为阿伏加德罗常数的值,x:y:z=_____(最简整数比),该晶体的密度为___________(列出计第式)。若图中原于1的坐标为(0,0,0)。2的坐标为,则原子3的坐标为__________________。
4.基于生物质资源开发常见的化工原料是绿色化学的重要研究方向。常采用醋酸、醋酸钴和Rn-Sn-B等为催化剂,以木质纤维素为起始原料合成聚碳酸对二甲苯酯()。
(1)基态钴原子的价电子排布式为__________________。
(2)聚碳酸对二甲苯酯中,各元素电负性由小到大的顺序为__________________。
(3)醋酸分子中碳原子的轨道杂化类型有_______,醋酸和的相对分子质量接近,而醋酸的熔点却比的熔点高许多,原因是__________________。
(4)钴元素可以形成多种配合物,将溶于浓氨水和的混合液并暴露于空气中发生反应,可生成配合物,写出该反应的化学方程式:__________________,1 ml 中含有________ml σ键。
(5)Sn可与Nb形成金属互化物,晶胞结构如图所示。该晶胞在面对角线方向的投影为_______(填标号);若晶胞密度为,代表阿伏加德罗常数的值,则该金属互化物的摩尔质量为_________(列出计算式)。
5.高纯电子级氢氟酸主要用于高端晶圆刻蚀,是半导体生产的关键材料之一。由萤石生产的氢氟酸需经除砷、脱水、蒸馏等多步净化提纯技术。请回答:
(1)基态F原子的价层电子排布图(轨道表达式)为__________。
(2)是氢氟酸中的主要杂质之一,可用等氧化脱除。分子的空间结构为__________;分子中键角比分子中的大,其原因是__________。
(3)氢氟酸分子间以氢键缔合,画出的氢键图示结构__________。
(4)的晶胞结构如图所示,晶胞参数。与间的最近距离为________pm(列出计算式即可,下同),设为阿伏加德罗常数的值,的密度为_________。
答案以及解析
1.答案:(1)F>N>C>H①>②,选项A正确;
B.根据上述分析可知,电子排布属于基态原子(或离子)的是:①②,选项B正确;
C.激发态Si原子不稳定,容易失去电子;基态Si原子失去一个电子是硅的第一电离能,离子失去一个电子是硅的第二电离能,由于,可以得出电离一个电子所需最低能量:②>①>③,选项C错误;
D.由C可知②比①更难失电子,则②比①更容易得电子,即得电子能力:②>①,选项D错误;
答案选AB;
(3)Si与P形成的某化合物晶体的晶胞如图可知,原子间通过共价键形成的空间网状结构,形成共价晶体;根据均摊法可知,一个晶胞中含有个Si,8个P,故该化合物的化学式为。
3.答案:(1)丙
(2)光谱仪;7
(3)冰晶体中存在氢键,氢键具有方向性,氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键,其配位数为4。而在干冰晶体中分子间只存在范德华力,其分子是密堆积的,配位数为12
(4);σ;异硫氰酸分子间可形成氢键
(5)2:1:3;;
解析:(1)失去1个电子之后各元素原子的价电子排布式如下:Si为、P为、S为、Cl为,再失去第2个电子时,S需要破坏半充满的3p轨道结构,第二电离能最大,故第二电离能的变化图为丙。
(2)不同元素原子的电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱。基态S原子的核外电子排布式为,根据洪特规则,3p能级有1对自旋相反的电子,故基态S原子中,核外存在7对自旋相反的电子。
(3)冰晶体中存在氢键,氢键具有方向性,这迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子形成氢键,其配位数为4.而在干冰晶体中,之间没有氢键,只有范德华力,其分子是密堆的,配位数为12。
(4)分子中N原子采取杂化,因此N原子一个杂化轨道与H的1s轨道形成1个N-Hσ键。异硫氰酸分子中N原子上连接有H原子,分子间可形成氢键,硫氰酸分子间不能形成氢键。
(5)1个晶胞中含有的Cu原子为,Sn原子为,原子为,故。,每个晶胞中有个该晶体的密度为:。结合图中原子1的坐标为(0,0,0)及2的坐标为,原子3的坐标为。
4.答案:(1)
(2)H
相关试卷
这是一份主题2 物质结构与性质 第5练 物质结构与性质综合练习(含解析)—2024高考化学考前天天练,共6页。试卷主要包含了是一种常见的离子液体,熔点为6等内容,欢迎下载使用。
这是一份(4)物质结构与性质综合——2024届高考化学二轮复习突破典型题型之综合题,共25页。试卷主要包含了电子排布式,共价键类型,晶体结构分析及简单计算等内容,欢迎下载使用。
这是一份新高考化学二轮复习精选练习专题16 物质结构与性质综合题(含解析),共30页。试卷主要包含了钠的一种氧化物的晶胞如图等内容,欢迎下载使用。









