

湖北省黄冈市2024-2025学年高二上学期11月阶段性联考化学试题(含答案)
展开
这是一份湖北省黄冈市2024-2025学年高二上学期11月阶段性联考化学试题(含答案),共11页。试卷主要包含了选择题的作答,非选择题的作答,考试结束后,请将答题卡上交,下列叙述错误的是,1ml和反应生成2mlHCl等内容,欢迎下载使用。
本试卷共8页,19题。全卷满分100分。考试用时75分钟。
☆祝考试顺利☆
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将答题卡上交。
相对原子质量:H—1 C—12 N—14 O—16
一、选择题。本题共15小题,每小题3分,共45分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学的发展与社会的生产生活息息相关,下列说法中错误的是( )
A.氨的合成实现工业化过程中,综合考虑了原料、催化剂、设备等多方面因素
B.火箭发射时用肼作燃料,二氧化氮作还原剂,二者反应生成了氮气和水蒸气
C.脂肪作为人体重要的储能物质,还具有促进脂溶性维生素的吸收和维持体温恒定等作用
D.飞秒化学的研究对了解化学反应机理、控制反应进程、充分利用物质和能源有重要意义
2.下列实验装置(部分夹持装置已略去)可以达到实验目的的是( )
3.如图所示曲线a表示放热反应进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
A.使用催化剂B.加大Y的投入量C.升高温度D.及时分离出M
4.在反应中,表示该反应速率最快的是( )
A.B.
C.D.
5.下列描述的化学反应状态,不一定是平衡状态的是( )
A.绝热、恒容下,反应体系中气体的压强保持不变
B.恒温、恒容下,反应体系中气体的颜色保持不变
C.,恒温,恒容下,反应体系中气体的平均摩尔质量保持不变
D.,恒温、恒容下,反应体系中气体的密度保持不变
6.下列叙述错误的是( )
A.自发进行的化学反应的方向,应由焓判据和熵判据的复合判据来判断
B.一定温度下,反应的
C.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的方向
D.水结冰的过程不能自发进行的原因是熵减的过程,但改变条件可以自发进行
7.1ml和反应生成2mlHCl(g)的能量变化如图所示。下列说法错误的是( )
A.断裂中的化学键需要吸收243kJ的能量
B.相同条件下,氢气比氯气更稳定
C.光照或点燃条件下,和反应生成HCl(g)的反应热不同
D.该反应的热化学方程式为
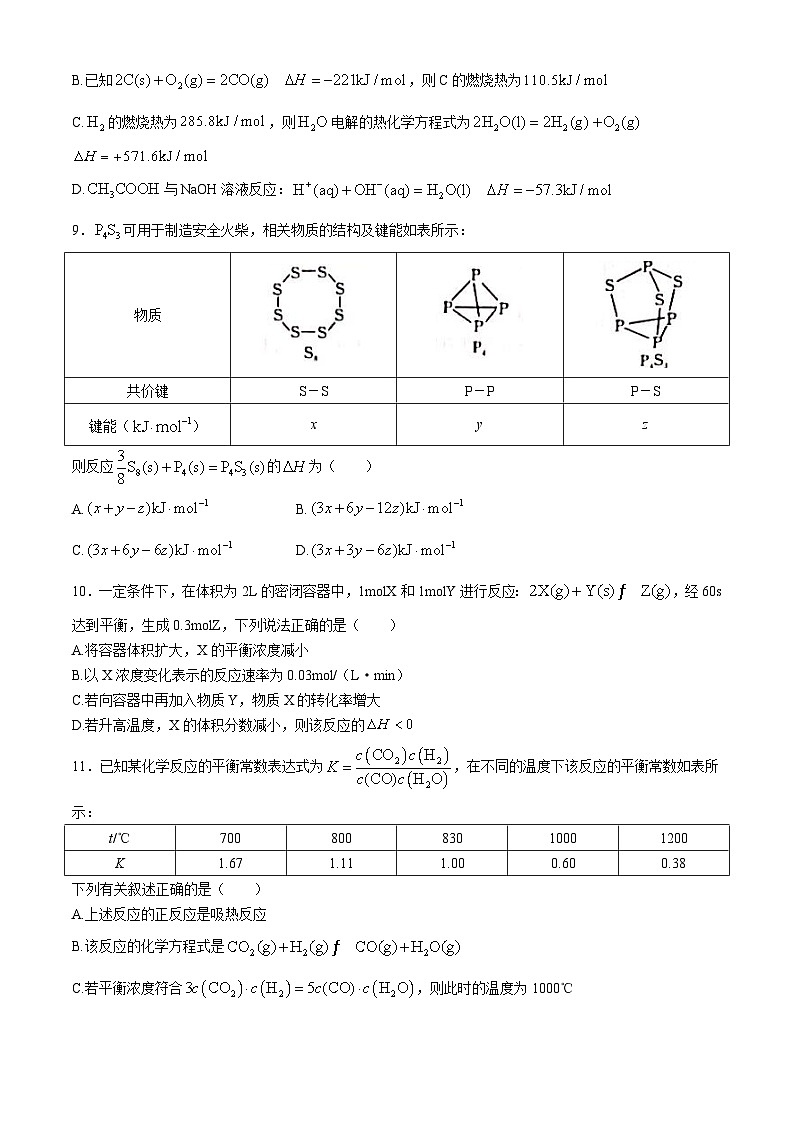
8.下列有关热化学方程式及其叙述正确的是( )
A.的燃烧热为890kJ/ml,其热化学方程式为
B.已知,则C的燃烧热为
C.的燃烧热为,则电解的热化学方程式为
D.与NaOH溶液反应:
9.可用于制造安全火柴,相关物质的结构及键能如表所示:
则反应的为( )
A.B.
C.D.
10.一定条件下,在体积为2L的密闭容器中,1mlX和1mlY进行反应:,经60s达到平衡,生成0.3mlZ,下列说法正确的是( )
A.将容器体积扩大,X的平衡浓度减小
B.以X浓度变化表示的反应速率为0.03ml/(L·min)
C.若向容器中再加入物质Y,物质X的转化率增大
D.若升高温度,X的体积分数减小,则该反应的
11.已知某化学反应的平衡常数表达式为,在不同的温度下该反应的平衡常数如表所示:
下列有关叙述正确的是( )
A.上述反应的正反应是吸热反应
B.该反应的化学方程式是
C.若平衡浓度符合,则此时的温度为1000℃
D.若在1L的密闭容器中通入CO和各1ml,5min后温度升高到830℃,此时测得CO为0.5ml,则该反应达到平衡状态
12.大气中的臭氧层能有效阻挡紫外线,已知反应:,在有Cl·存在时(Cl·对反应有催化作用)的反应机理为:基元反应①:,基元反应②:,反应过程的能量变化如图所示。下列说法错误的是( )
A.b表示存在Cl·时反应过程的能量变化
B.Cl·是反应的催化剂,改变了反应历程,不改变反应过程的大小
C.决定反应速率的是基元反应①
D.增大压强和加入催化剂都能增大活化分子百分数
13.利用、与合成的反应主要历程如图所示。下列说法错误的是( )
A.HI、CO是合成乙醇的中间产物
B.合成过程涉及C—C键和H—O键的形成
C.若用替代,则可生成
D.第2步的反应式为:
14.在两个容积均为4L的恒容密闭容器中,起始时均充入0.4ml乙苯,以温度、催化剂为实验条件变量,发生反应:。测得的结果如图所示。曲线Ⅱ、Ⅲ表示经过相同时间ts且未达到化学平衡时乙苯的转化率,下列说法错误的是( )
A.900℃时,无催化剂的容器中,ts内的平均反应速率为
B.1100℃时,曲线Ⅱ、Ⅲ几乎重合,可能是因为催化剂失活
C.1000℃时,有催化剂的容器中,延长反应时间乙苯的转化率无法到达A点
D.其他条件不变时,降低温度或增大压强均能使平衡向左移动,均能使平衡常数K减小
15.在℃下,向2L恒容密闭容器中充入气体,发生反应:。速率方程,(、为速率常数,只与温度、活化能有关)。达到平衡时的转化率为50%。若升高温度,达到新平衡时的转化率增大。下列说法正确的是( )
A.升高温度,增大,减小,
B.℃下,反应达到平衡时
C.当混合气体的密度不变时反应达到平衡状态
D.℃下,平衡时再充入,的平衡转化率增大
二、非选择题:本题共4小题,共55分。
16.(14分)根据所学知识,回答下列问题:
(1)下列反应中,属于吸热反应的是______。
A.常温下,钠在空气中被氧化B.常温下,与固体混合
C.高温下,铝和氧化铁反应D.加热条件下,溶液变黄色
(2)还原法可将还原为脱除,已知60gNO被还原生成气态水,释放的能量为690kJ,请写出该反应的热化学方程式______。
(3)卤化镁高温分解的相对能量变化如图所示。
①比较热稳定性:______(填“>”或“<”)。
②反应______。
(4)以和为原料合成尿素。
①有利于提高平衡转化率的措施是______。
A.高温低压B.高温高压C.低温低压D.低温高压
②研究发现,合成尿素反应分两步完成,其能量变化如下图所示。
第一步:
第二步:
图中______。
反应速率较快的是______反应(填“第一步”或“第二步”)。
17.(13分)(Ⅰ)某探究小组用与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用浓度为1.00ml/L,2.00ml/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃,35℃,每次实验的用量为25.00mL,大理石用量为10.00g。
(1)请完成实验设计表,并填空:a______,c______,e______。
(2)实验①中质量随时间变化的关系如图,计算实验①中70s~90s范围内用表示的平均反应速率______(忽略溶液体积变化)。
在0~70s.70~90s、90~200s各时间段里,反应速率最小的时间段是______。
(Ⅱ)化学兴趣小组进行测定中和热的实验,步骤如下。
a.用量筒量取盐酸倒入小烧杯中,测出盐酸温度。
b.用另一量筒量取溶液,并用另一温度计测出其温度。
c.将NaOH溶液倒入小烧杯中,使之混合均匀,测得混合液最高温度。
(1)实验中,倒入NaOH溶液的正确操作是______
A.分3次倒入B.一次性快速倒入C.边搅拌边慢慢倒入
(2)若将一定量的氢氧化钾固体,稀氢氧化钙溶液、稀氨水分别和1L1ml/L的稀盐酸恰好完全反应,其反应热分别为、、,则、、的大小关系为______。
(3)若通过测定计算出产生的热量为1.41kJ,请写出该反应的热化学方程式:______。
18.(14分)回答下列问题。
(1)工业上利用CO和在催化剂作用下合成甲醇:。已知反应中有关物质的化学键键能数据如下表所示:
则______。
(2)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:,其化学平衡常数K与温度t的关系如表:
完成下列填空:
400℃时,反应的化学平衡常数的值为______。当测得和、的物质的量浓度分别为2ml/L和4.5ml/L、1ml/L时,则该反应______(填写“>”“=”或“<”)。
(3)甲烷是重要的气体燃料和化工原料,由制取合成气(CO、)的反应原理为。回答下列问题:
①当体系温度等于TK时,温度大于T时______(填“>”“<”或“=”)0。
②在一定温度下,恒容密闭容器中发生上述反应,下列状态表示反应一定达到平衡状态的有______。
A.
B.气体密度不再变化
C.单位时间每生成1ml,同时产生3ml
D.与CO的物质的量之比为1:3
(4)一定温度下,在体积为1L的恒容密闭容器中通入和,在不同条件下发生反应,平衡时体系的压强为10MPa,的体积分数与温度的关系如图所示。
若q点对应的纵坐标为30,此时甲烷的转化率为______,该条件下平衡常数______(用平衡分压代替平衡浓度可以得到平衡常数,气体分压=气体总压×气体的物质的量分数)。
19.(14分)合成氨技术的创立开辟了人工固氮的重要途径。铁触媒催化合成氨经历下图所示①~⑥步过程(从状态Ⅰ至状态Ⅶ):
注解:上图中“ad”表示吸附在催化剂表面的物质。
请根据信息回答下列问题:
(1)催化反应往往经过物质在催化剂表面的“吸附”过程和脱离催化剂表面的“脱附”过程。上图历程中包含______个基元反应,“吸附”过程是______(填“吸热”或“放热”)过程。
(2)根据上图计算合成氨反应的焓变______。
(3)已知:反应的,则合成氨反应能自发进行的温度是______。
A.325℃B.225℃C.125℃D.25℃
(4)关于合成氨工艺流程,下列理解正确的是______。
A.控制温度(773K)远高于室温,是为了保证尽可能大的平衡转化率和快的反应速率
B.基于有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行
C.当温度、压强一定时,在原料气(和比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得,通过天然气和水蒸气转化可得,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(5)工业尾气中的可通过催化氧化为除去,已知与作用分别生成、、的反应均为放热反应。将一定比例的、和的混合气体以一定流速经过装有催化剂的反应管,的转化率、的选择性与温度的关系如下图。
其他条件不变,在200~300℃范围内升高温度,出口处氮氧化物的量______(填“增大”或“减小”),原因是______。
2024秋季高二年级化学参考答案及评分标准
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
二、非选择题:本题包括4小题,共55分。
16.(14分)
(1)BD(2分)
(2)(2分,漏写物质状态、单位不得分)
(3)①>(2分) ②-117(2分,没有负号不得分)
(4)①D(2分)②72.5(2分) 第一步(2分)
17.(13分)(Ⅰ)(1)1.00(1分,写1也得分) 25(1分) 温度(1分)
(2)0.01(2分)90~200s(2分)
(Ⅱ)(1)B(2分) (2)(2分,从大到小书写也正确)
(3)或(2分,系数不唯一,数值正确都算对,漏写物质状态不得分)
18.(14分)
(1)-98(2分)
(2)2(2分)>(2分)
(3)①<(2分) ②AC(2分)
(4)25%(2分) 3(2分)
19.(14分)
(1)6(2分) 放热(2分)
(2)(2分、漏写单位、负号不得分)
(3)CD(2分)
(4)BD(2分)
(5)①增大(2分)
②在200~300℃范围,温度升高,速率加快,的转化率增大,但的选择性下降(2分,从平衡移动角度分析不得分)实验装置
实验目的
中和反应反应热的测定
证明与的反应是有限度的
石油分馏
测定锌与稀硫酸的反应速率
选项
A
B
C
D
物质
共价键
S-S
P-P
P-S
键能()
x
y
z
t/℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
实验编号
温度(℃)
大理石规格
浓度(ml/L)
实验目的
①
25
粗颗粒
2.00
(Ⅰ)实验①和②探究浓度对反应速率的影响;
(Ⅱ)实验①和③探究e对反应速率的影响;
(Ⅲ)实验①和④探究大理石粒大小对反应速率的影响
②
25
粗颗粒
a
③
b
粗颗粒
2.00
④
c
细颗粒
d
化学键
H-H
C-O
H—O
C-H
E/(kJ/ml)
436
342
1076
465
413
t/℃
200
300
400
K
0.5
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
B
D
A
B
C
C
C
C
D
A
D
D
C
D
B
相关试卷
这是一份湖北省黄冈市十五校2024-2025学年高一上学期期中联考 化学试题,文件包含高一化学pdf、化学参考答案docx等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份湖北省黄冈市2024-2025学年高二上学期11月阶段性联考化学试题,文件包含湖北黄冈11月高二化学考试pdf、湖北黄冈11月高二化学参考答案及评分标准pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份湖北省黄冈市2024-2025学年高二上学期11月阶段性联考化学试题,文件包含湖北黄冈11月高二化学考试pdf、湖北黄冈11月高二化学参考答案及评分标准pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。









