

四川省自贡市蜀光中学2024-2025学年高二上学期期中考试 化学试题(无答案)
展开
这是一份四川省自贡市蜀光中学2024-2025学年高二上学期期中考试 化学试题(无答案),共7页。
(满分100分,考试时间75分钟)
【注意事项】
1.答卷前,考生务必将自己的姓名、班级、准考证号填写在答题卷上。考试结束后,只将答题卷交回。
2.试卷中的选择题部分,请在选出答案后,用铅笔把答题卷上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试题卷上。
3.试卷中的非选择题部分,请用0.5mm黑色签字笔在答题卷上各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效。
可能用到的相对原子质量:H-1 C-12 O-16 S-32
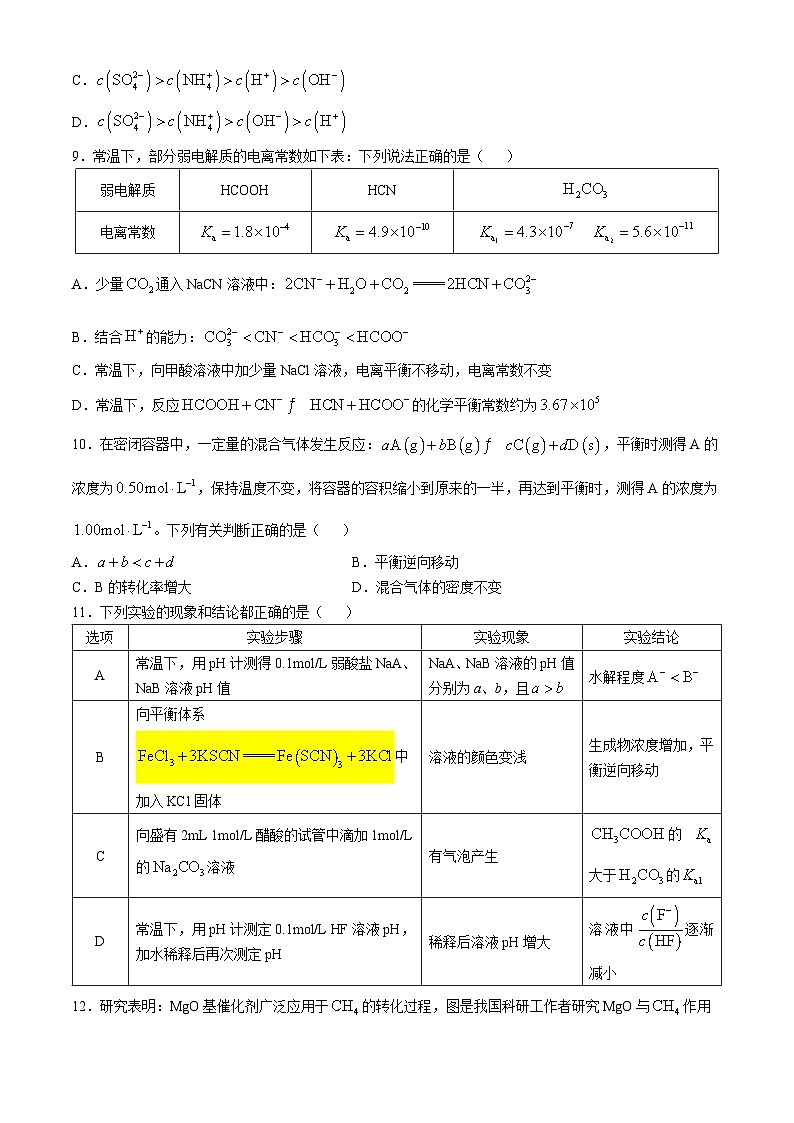
第Ⅰ卷(选择题,共42分)
第Ⅰ卷14题,每题3分。在每题给出的四个选项中,只有一项是符合题目要求的。
一、单选题
1.下列反应属于氧化还原反应,且的是( )
A.与反应B.灼热的炭与反应
C.铝片与稀反应D.甲烷在中的燃烧反应
2.将100mL 2ml/L的硫酸溶液跟过量锌粒反应,在一定条件下,为了减缓反应进行的速率,又不影响生成氢气的总量,可以向反应物溶液中采取的措施有( )
A.滴加几滴浓硫酸后加热B.滴加几滴硫酸铜溶液
C.加入硫酸钠溶液D.将锌粒改为锌粉
3.下列说法中,正确的是( )
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.物质M的比N小,则M的溶解度一定比N小
C.的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
4.关于热化学方程式,下列说法正确的是( )
A.标准状况下,完全燃烧生成液态水,放出285.8kJ热量,则燃烧热的热化学方程式为:
B. ,则金刚石比石墨稳定
C.已知稀HCl与稀NaOH溶液反应的中和热为57.3kJ/ml,则与1L 0.1ml/L的NaOH溶液反应会放出5.73kJ的热量
D.500℃、30MPa下,和充分反应生成并放热38.6kJ,则热化学方程式为:
5.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在水电离出的溶液:、、、
B.能使甲基橙变红的溶液中:、、、
C.加入酚酞后,溶液颜色不改变的溶液:、、、
D.的溶液:、、、
6.下列实验操作正确的是( )
A.图1:向待测液中逐滴加入标准液,测定溶液的浓度
B.如图2所示,记录滴定终点读数为19.90mL
C.图3操作为赶出碱式滴定管内的气泡
D.如图4,滴定时一手控制滴定管玻璃活塞,一手摇动锥形瓶,眼睛注视滴定管液面
7.下列离子方程式书写正确的是( )
A.溶液与稀混合:
B.高锰酸钾标准溶液测定草酸溶液的浓度:
C.泡沫灭火器灭火的原理:
D.水解的离子方程式:
8.在1ml/L的溶液中,下列有关离子浓度大小比较中,正确的是( )
A.
B.
C.
D.
9.常温下,部分弱电解质的电离常数如下表:下列说法正确的是( )
A.少量通入NaCN溶液中:
B.结合的能力:
C.常温下,向甲酸溶液中加少量NaCl溶液,电离平衡不移动,电离常数不变
D.常温下,反应的化学平衡常数约为
10.在密闭容器中,一定量的混合气体发生反应:,平衡时测得A的浓度为,保持温度不变,将容器的容积缩小到原来的一半,再达到平衡时,测得A的浓度为。下列有关判断正确的是( )
A.B.平衡逆向移动
C.B的转化率增大D.混合气体的密度不变
11.下列实验的现象和结论都正确的是( )
12.研究表明:MgO基催化剂广泛应用于的转化过程,图是我国科研工作者研究MgO与作用最终生成Mg与的物质相对能量-反应进程曲线。下列说法不正确的是( )
A.反应中甲烷被氧化
B.中间体比更稳定
C.该反应的速率控制步骤对应的活化能是29.5kJ/ml
D.转化为的焓变为-145.1kJ/ml
13.在不同温度下的水溶液中,离子浓度曲线如图所示。下列说法一定正确的是( )
A.
B.a点和c点均为纯水
C.在c点溶液中通入适量HCl气体,可实现c点向d点移动
D.T℃时,将的稀硫酸与的KOH溶液等体积混合,所得溶液为碱性
14.25℃时,用的NaOH溶液滴定的一元强酸甲和一元弱酸乙,滴定曲线如图pH所示。下列有关判断正确的是( )
A.水的电离程度:B.曲线Ⅱ为NaOH溶液滴定一元弱酸乙
C.图像中的D.电离常数
第Ⅱ卷(非选择题,共58分)
15.(16分)Ⅰ.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于0.035g/mL。选择酚酞作指示剂,用标准NaOH溶液可以测定食醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:
(1)量取稀释后的25.00mL白醋溶液应选用______(填“A”或“B”)。
(2)写出白醋溶液中醋酸与NaOH溶液反应的离子方程式:____________。
(3)滴定管在使用前需要检验其是否漏水、水洗、______装液、排气泡、调零、读数。
(4)下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是______(填编号)。
A.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
B.滴定过程中振荡时锥形瓶内有液滴溅出
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取NaOH溶液体积时,开始时仰视读数,滴定结束时俯视读数
(5)若通过实验测得稀释后白醋的浓度为0.070ml/L,则该白醋中醋酸含量为______g/mL(保留两位有效数字),该白醋______(填“符合”或“不符合”)国家标准。
Ⅱ.某小组设计实验测定胆矾()纯度(杂质不参与反应):称取a g胆矾样品溶于蒸馏水,加入足量KI溶液,充分反应后,过滤。把滤液配制成250mL溶液,准确量取配制溶液25.00mL于锥形瓶中,滴加2滴淀粉溶液,用标准溶液滴定至终点,消耗溶液。
涉及的有关反应如下:;
(6)滴定终点的现象:____________。
(7)胆矾的纯度(质量分数)为______%。(用含a、b、V的最简式子表示)
16.(14分)弱电解质的电离平衡、盐类的水解平衡和难溶电解质的沉淀溶解平衡都与日常生活、工农业生产等息息相关。根据所学知识,回答下列问题:
Ⅰ.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过。处理含镉废水可采用化学沉淀法。已知一些化合物在常温时的如表:
(1)写出的溶度积常数表达式:______。
(2)25℃时,向饱和溶液中加入少量碳酸钠固体,沉淀溶解平衡______(填“正移”、“逆移”或“不移动”),溶液中的浓度______(填“变大”、“变小”或“不变”),溶度积常数______(填“变大”、“变小”或“不变”)。
Ⅱ.可用作白色颜料和阻燃剂等。在实验室中可利用的水解反应制取。(的水解分三步进行,中间产物有SbOCl等)。
(3)为配制溶液,取固体少许溶于2~3mL水中,有白色沉淀产生,此溶液的pH______7(填“小于”“大于”或“等于”),配制溶液的正确方法是:将少量的溶于______中,再加水稀释到所需浓度。
(4)为了得到较多的,操作时要将缓慢加入大量水中,反应后期还要加入少量氨水。试利用平衡移动原理说明这两项操作的作用:____________。
17.(14分)氢气既是重要的化工原料,又属于洁净能源,是未来人类重点开发的能源之一。
(1)氢气可以与煤在催化剂作用下制备乙炔,其总反应式为: 。已知部分反应如下:Ⅰ. ;
Ⅱ. ;
Ⅲ. ;
①______(用、、表示,不计算出具体数值);反应Ⅱ在______(选填“高温”、“低温”、或“任何温度”)下可自发进行。
②一定条件下,向2L的恒容密闭容器中加入足量碳粉和,发生上述反应Ⅰ、Ⅱ、Ⅲ,5min后容器内总压强不再变化,容器中为0.1ml,为0.1ml,为0.3ml,5min内的平均反应速率______。
(2)氢气可以用于合成甲醇的反应为 ,在恒压条件下测得的平衡转化率与温度和投料比关系如图所示:
①已知,则______(填“>”“<”或“=”)0。
②由图可知,同温同压下越大,的平衡转化率越大,原因为____________。
③下列叙述能说明上述反应达到了化学平衡状态的是______(填标号)。
a.b.的体积分数不再改变
c.混合气体的平均摩尔质量不再改变d.同一时间内,消耗,同时生成0.02ml CO
④保证该压强不变,向温度下,的平衡体系中再加入2ml CO、、,则化学平衡______(填“正向”“逆向”或“不”)移动。
18.(14分)已知的电离平衡常数如下表:
(1)明矾可用于净水,原因是(用离子方程式表示)____________。
(2)若次氯酸、氢氟酸溶液相同,则酸的物质的量浓度大小关系为:______(填“>”、“<”或“=”)。
(3)常温下,下列事实能说明HF是弱电解质的是( )
A.HF易挥发B.HF溶液中存在微粒有:、、HF
C.NaF溶液呈碱性D.等浓度等体积的HF和盐酸消耗氢氧化钠的量相同
(4)向氨水中加入稀硫酸至溶液的,此时溶液中,则______,人体血液中存在平衡,维持pH稳定。
(5)已知正常人体血液在正常体温时,的一级电离常数,,正常情况下人体血液的______(已知)。
(6)人在剧烈运动后或紧张时,易因过度换气呼出大量二氧化碳,而出现呼吸性碱中毒。此时血液缓冲体系中的值将______(填“变大”、“变小”或“不变”)。试用平衡移动原理解释呼吸性碱中毒的现象:____________。弱电解质
HCOOH
HCN
电离常数
选项
实验步骤
实验现象
实验结论
A
常温下,用pH计测得0.1ml/L弱酸盐NaA、NaB溶液pH值
NaA、NaB溶液的pH值分别为a、b,且
水解程度
B
向平衡体系
中加入KCl固体
溶液的颜色变浅
生成物浓度增加,平衡逆向移动
C
向盛有2mL 1ml/L醋酸的试管中滴加1ml/L的溶液
有气泡产生
的大于的
D
常温下,用pH计测定0.1ml/L HF溶液pH,加水稀释后再次测定pH
稀释后溶液pH增大
溶液中逐渐减小
化合物
CdS
物质
HClO
HF
电离平衡常数
-
-
相关试卷
这是一份四川省自贡市蜀光中学2024-2025学年高二上学期10月月考 化学试题(无答案),共9页。
这是一份四川省自贡市蜀光中学2023-2024学年高一下学期期中考试化学试题,共6页。
这是一份四川省自贡市蜀光中学2023-2024学年高一下学期期中考试化学试题,共6页。









