

湖北省武汉市第十二中学2023-2024学年高三下学期期中考试 化学试卷
展开
这是一份湖北省武汉市第十二中学2023-2024学年高三下学期期中考试 化学试卷,共16页。试卷主要包含了请将答案正确填写在答题卡上,NA代表阿伏加德罗常数的值,下列说法正确的是等内容,欢迎下载使用。
1.答题前填写好自己的姓名、班级、考号等信息
2.请将答案正确填写在答题卡上
第I卷(选择题)
1.下列常见物质及用途错误的是
2.下列实验操作、现象、结论或解释中有错误的是
3.下列有关安全问题的叙述不正确的是
A.工业制取硝酸时尾气用氢氧化钠溶液吸收
B.氯气泄露时,应用蘸有肥皂水的湿毛巾捂住口鼻到安全区域
C.家中做卫生保洁时,严禁漂白粉与浓盐酸混合使用,否则会产生有毒气体
D.家中发生天然气泄露时,应立即使用室内电话报警
4.对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
5.NA代表阿伏加德罗常数的值。下列说法正确的是
A.0.1 ml 27Al3+中含有的电子数为1.3NA
B.3.9 g Na2O2中含有的共价键的数目为0.1NA
C.0.1 ml肼(H2N—NH2)含有的孤电子对数为0.2NA
D.CH2CH2+H2CH3CH3,生成1 ml乙烷时断裂的共价键总数为NA
6.下列有关物质的熔沸点高低顺序正确的是
7.乳酸薄荷酯有轻微的薄荷香气,有持久、令人愉快的清凉效果,主要应用于日化产品、药物制备、口腔产品和糖果等产品中,其结构简式如图,下列有关乳酸薄荷酯的说法正确的是
8.下列说法正确的是
A.福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同
B.离子化合物中只含离子键,而共价化合物中可能只含共价键,也可能含离子键
C.CO2、H2O、N2分子中所有原子的最外层电子数都为8
D.原子结构模型的演变经历了:
9.金属钠晶体为体心立方晶胞(如图所示),实验测得钠的密度为ρ(g·cm-3)。已知钠的相对原子质量为a,阿伏加德罗常数的值为NA(ml-1),假定金属钠原子为等径的刚性小球且处于体对角线上的三个球相切。则钠原子的半径r(cm)为( )
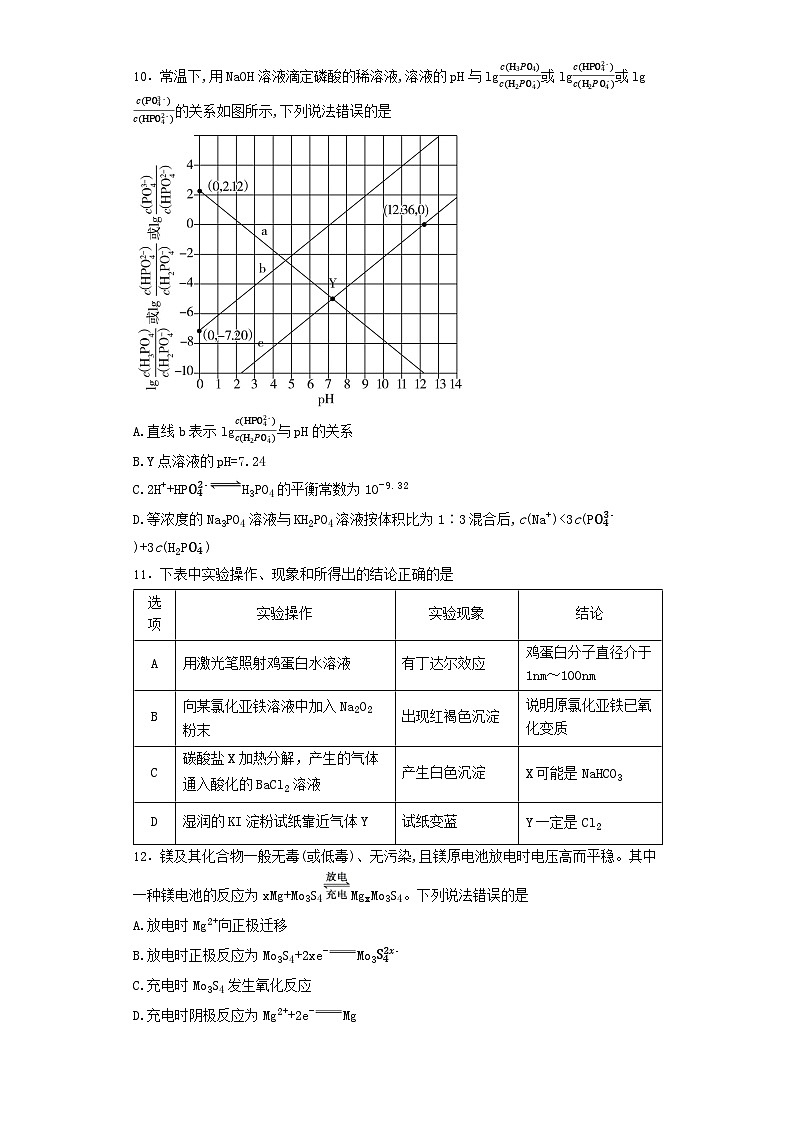
10.常温下,用NaOH溶液滴定磷酸的稀溶液,溶液的pH与lgc(H3PO4)c(H2PO4-)或lgc(HPO42-)c(H2PO4-)或lgc(PO43-)c(HPO42-)的关系如图所示,下列说法错误的是
A.直线b表示lgc(HPO42-)c(H2PO4-)与pH的关系
B.Y点溶液的pH=7.24
C.2H++HPO42-H3PO4的平衡常数为10-9.32
D.等浓度的Na3PO4溶液与KH2PO4溶液按体积比为1∶3混合后,c(Na+)c(OH-)=c(H+)
D.据图4,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量CuO至pH在5.5左右
第II卷(非选择题)
16.三氯化六氨合钴(Ⅲ){[C(NH3)6]Cl3}是重要的化工原料。制备反应式为:2(CCl2·6H2O)+10NH3+2NH4Cl+H2O22[C(NH3)6]Cl3+14H2O,反应放出大量热。
已知:①C2+不易被氧化,C3+具有强氧化性;[C(NH3)6]2+具有较强还原性,[C(NH3)6]3+性质稳定。
②[C(NH3)6]Cl3在水中的溶解度曲线如图1所示,加入少量浓盐酸有利于其析出。制备[C(NH3)6]Cl3的实验步骤:
Ⅰ.取研细的CCl2·6H2O和NH4Cl,溶解后转入三颈烧瓶,控制温度在10 ℃以下,加入浓氨水和活性炭粉末。再逐滴加入30%的H2O2溶液,则溶液逐渐变混浊。实验装置如图2所示。
Ⅱ.将所得浊液加热,趁热过滤,向滤液中逐滴加入少量浓盐酸后静置。
Ⅲ.在静置的同时,需对静置液进行“操作A”后过滤;用无水乙醇洗涤晶体2~3次。
(1)图中仪器a的名称为 。
(2)将C2+转化为[C(NH3)6]3+过程中,先加浓氨水的目的是 。
(3)步骤Ⅱ向滤液中加入浓盐酸的原因是 。
(4)步骤Ⅲ中的“操作A”是 。
(5)用图3所示装置测定产品中NH3的含量(部分装置已省略):
①蒸氨:取m g样品加入过量试剂后,加热三颈烧瓶,蒸出的NH3通入盛有V1 mL c1 ml·L-1H2SO4标准溶液的锥形瓶中。
液封装置1的作用是 。
液封装置2的作用是 。
②滴定:将液封装置2中的水倒入锥形瓶后滴定剩余的H2SO4,消耗c2 ml·L-1的NaOH标准溶液V2 mL。若未将液封装置2中的水倒入锥形瓶,测得NH3的质量分数将 (填“偏高”或“偏低”或“不变”)。
17.海洋中溴的浓度虽然很低,但它的储量却占地球上溴的总储量的99%以上,因此溴常被人们称为“海洋元素”。回答下列问题:
(1)工业上常用如下方案获取红棕色的液溴(Br2):
①上述方案设计中,前三步的目的是 。
②方案中向第二个反应釜中加入H2SO4,写出该步骤发生反应的离子方程式 。
③已知Br2、CCl4的沸点分别为58.76 ℃、76.8 ℃,进入蒸馏塔的水溶液并未用CCl4继续萃取浓缩而是直接蒸馏,主要原因是 。
(2)某化学学习小组使用下列装置模拟上述部分过程。
①实验前如何检查装置的气密性? 。
②反应过程中,为使A中产生的Br2尽可能完全被吸收,可采取的合理措施是 、 ;判断Br2被完全吸收的标志是 。
③C中可能发生的离子反应有 。
18.含结晶水的无机物可应用在吸波材料、电极材料和相变储能材料等领域。胆矾(CuSO4·5H2O)是一种重要的结晶水合物。
(1)硫酸铜参比电极具有电位稳定的优点,可用于土壤环境中钢质管道的电位监测。测量的电化学原理如图所示。回答下列问题:
①负极的电极反应式为 。
②测量后参比电极中CuSO4溶液的浓度 (填“变大”“变小”或“不变”)。
(2)把胆矾放到密闭容器内,缓缓抽去其中的水汽,胆矾分三次依次脱水,各步脱水过程为一系列的动态平衡,反应式如下(脱水过程为吸热反应)。
反应Ⅰ:
CuSO4·5H2O(s)CuSO4·3H2O(s)+2H2O(g)
反应Ⅱ:
CuSO4·3H2O(s)CuSO4·H2O(s)+2H2O(g)
反应Ⅲ:
CuSO4·H2O(s)CuSO4(s)+H2O(g)
如图为50 ℃时水合物中水的质量分数w与压强p(H2O)的关系图,回答下列问题:
①用无水CuSO4检验乙醇中含有微量水的现象是 。
②反应Ⅰ对应的线段为 (填“ab”“cd”或“ef”)。
③反应Ⅱ的平衡常数Kp= Pa2。
④反应Ⅲ在60 ℃和50 ℃的平衡压强p(H2O)分别为p1和p2,则p1 p2(填“>”“Si
B.
将打磨过的镁条在空气中点燃后迅速插入充满二氧化碳的集气瓶
发出耀眼白光,产生白烟以及少量黑色固体
镁与二氧化碳发生置换反应
C.
将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液呈橙红色
氧化性:Cl2>Br2
D.
向Al2(SO4)3溶液中滴加过量氨水
产生白色胶状物质且不溶解
Al3+与NH3·H2O不能大量共存
选项
粒子组
判断和分析
A.
Ba2+、Al3+、NO3-、CO32-
不能大量共存,主要原因是Al3+与CO32-反应产生Al2(CO3)3沉淀
B.
H+、K+、S2O32-、Cl-
不能大量共存,因发生反应:2H++S2O32-S↓+SO42-+H2O
C.
Na+、Cu2+、H2O2、SO42-
不能大量共存,Cu2+会催化H2O2分解
D.
H+、K+、C2H5OH、MnO4-
能大量共存
A.金刚石>晶体硅>碳化硅
B.CI4>CBr4>CCl4>CF4
C.NH3>H2O>N2>CO
D.生铁>钠>纯铁
A.分子中含有三种官能团
B.分子式为C13H22O3
C.能发生酯化反应、取代反应和氧化反应
D.分子中所有的碳原子可能共平面
A.32aNAρ
B.332aNAρ
C.3432aNAρ
D.1232aNAρ
选项
实验操作
实验现象
结论
A
用激光笔照射鸡蛋白水溶液
有丁达尔效应
鸡蛋白分子直径介于1nm~100nm
B
向某氯化亚铁溶液中加入Na2O2粉末
出现红褐色沉淀
说明原氯化亚铁已氧化变质
C
碳酸盐X加热分解,产生的气体通入酸化的BaCl2溶液
产生白色沉淀
X可能是NaHCO3
D
湿润的KI淀粉试纸靠近气体Y
试纸变蓝
Y一定是Cl2
评卷人
得分
二、综合题(共4题,共55分)
参考答案
1.D
【解析】胃酸中含有HCl,氢氧化铝碱性较弱,且可以与HCl反应,故能用于治疗胃酸过多,A正确;SiO2具有良好的光学特性,可用于制造光导纤维,B正确;Fe2O3是一种红色粉末,俗称铁红,常用作红色染料,C正确;钠能与水反应生成易燃性气体氢气,故钠起火不能使用水基灭火器扑灭,D错误。
【备注】无
2.A
【解析】产生白色胶状物质,说明生成硅酸,根据“强酸制弱酸”的原理可知酸性:盐酸>硅酸,但不能说明非金属性:Cl>Si,A项错误;镁条在CO2中剧烈燃烧,发出白光,放出大量热,有大量白烟以及少量黑色固体生成,即Mg和CO2反应生成MgO和C,该反应属于置换反应,B项正确;由实验操作和现象可知氯水中的Cl2置换出溴,用四氯化碳萃取后有机层在下层,下层溶液呈橙红色,则氧化性:Cl2>Br2,C项正确;硫酸铝与氨水反应生成氢氧化铝和硫酸铵,氢氧化铝不能溶解在氨水中,D项正确。
【备注】无
3.D
【解析】本题考查物质的性质,以及化学与安全问题。A、工业制取硝酸时产生的尾气主要是NO和NO2,NO易被空气中的氧气氧化为NO2,NO2属于酸性气体,可用氢氧化钠溶液吸收,正确;B、因为肥皂水呈碱性可与氯气反应而降低其毒性,所以氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻,正确;C、漂白粉的成分中有次氯酸钙,能与盐酸发生氧化还原反应生成氯气,所以两者不能混合使用,正确;D、天然气泄漏时,应立即关闭天然气开关,然后到距离泄漏处较远的地方报警,而不能用室内电话报警,因为天然气的成分为甲烷,遇火发生爆炸,错误。答案选D。
【备注】无
4.C
【解析】Ba2+与CO32-因生成BaCO3沉淀而不能大量共存,Al3+与CO32-能发生相互促进的水解反应而不能大量共存,A项错误;S2O32-在酸性条件下发生歧化反应2H++S2O32-S↓+SO2↑+H2O,B项错误;酸性条件下MnO4-有强氧化性,能与C2H5OH发生氧化还原反应而不能大量共存,D项错误。
【备注】无
5.C
【解析】1个27Al3+含有10个电子,0.1 ml 27Al3+含有的电子数为NA,A项错误;3.9 g Na2O2的物质的量为0.05 ml,一个Na2O2含有一个O—O共价键,3.9 g Na2O2中含有的共价键数目为0.05NA,B项错误;H2N—NH2中两个N各有1个孤电子对,0.1 ml H2N—NH2含有的孤电子对数为0.2NA,C项正确;CH2CH2和H2反应时,断裂CH2CH2中的一个碳碳键和H2中的氢氢键,故生成1 ml乙烷时断裂的共价键总数为2NA,D项错误。
【备注】无
6.B
【解析】A项,所列物质均为原子晶体,原子晶体中,熔沸点与键长成反比,键长C—C晶体硅,错误。B项,所列物质为组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高,则熔沸点高低顺序为CI4>CBr4>CCl4>CF4,正确。C项,所列物质均为分子晶体,若能形成分子间氢键,熔沸点反常升高;若不能形成分子间氢键,则相对分子质量越大,分子间作用力越强,熔沸点越高;若相对分子质量相同,分子的极性越强,熔沸点越高,氨气和水均能形成分子间氢键,但水形成的分子间氢键比氨气形成的分子间氢键要强,N2和CO的相对分子质量相等,但CO为极性分子,而N2为非极性分子,则熔沸点高低顺序为H2O>NH3>CO>N2,错误。D项,所列物质均为金属晶体,生铁中混入碳而形成合金,合金的熔点小于纯金属的,金属钠的金属键比铁的弱,则熔沸点高低顺序为纯铁>生铁>钠,错误。
【备注】四大晶体中,考生常混淆分子晶体和原子晶体。那么如何判断非金属单质是原子晶体还是分子晶体呢?
(1)依据组成晶体的粒子和粒子间的作用判断:组成原子晶体的粒子是原子,质点间的作用是共价键;组成分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔、沸点判断:原子晶体的熔、沸点较高,常在1 000 ℃以上;分子晶体的熔、沸点较低,常在数百度以下。
(4)依据导电性判断:分子晶体不导电,但部分分子晶体溶于水后能导电;原子晶体多数不导电,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
常见的原子晶体
(1)某些非金属单质,如金刚石(C)、晶体硅(Si)、晶体硼(B)等。
(2)某些非金属化合物,如碳化硅(SiC)晶体、氮化硼(BN)晶体等。
(3)某些氧化物,如二氧化硅(SiO2)晶体等。
7.C
【解析】本题考查有机物的结构和性质,意在考查考生对知识的迁移能力。该有机物分子中含有酯基和羟基两种官能团,A错误;由该有机物的结构简式可知,其分子式为C13H24O3,B错误;羟基能发生酯化反应,酯化反应本身属于取代反应,该有机物的燃烧或被酸性高锰酸钾溶液氧化都属于氧化反应,C正确;该有机物分子中含有多个四面体结构的碳原子,所有的碳原子不可能共平面,D错误。
【备注】无
8.A
【解析】131I与127I质子数相同,中子数不同,互称同位素,同位素的化学性质相似,A项正确;离子化合物中肯定含离子键,可能含共价键,而共价化合物中只含共价键,B项错误;H2O分子中的H原子最外层为2个电子,C项错误;正确的原子结构模型的演变顺序为道尔顿→汤姆生→卢瑟福→玻尔,D项错误。
【备注】无
9.C
【解析】在体心立方晶胞中,位于体心的原子与位于八个顶点的原子相切,而位于八个顶点的原子不接触,故该晶胞边长为4r3 ,该晶胞中实际含有的钠原子数为2,则ρ=2aNA·(4r3)3,进一步化简后可得答案。
【备注】无
10.C
【解析】H3PO4在溶液中存在电离平衡H3PO4H++H2PO4-,Ka1=c(H+)·c(H2PO4-)c(H3PO4)、H2PO4-H++HPO42-,Ka2=c(H+)·c(HPO42-)c(H2PO4-)、HPO42-H++PO43-,Ka3=c(H+)·c(PO43-)c(HPO42-)。当lgc(H3PO4)c(H2PO4-)或lgc(HPO42-)c(H2PO4-)或lgc(PO43-)c(HPO42-)等于0,即c(H3PO4)c(H2PO4-)=1、c(HPO42-)c(H2PO4-)=1、c(PO43-)c(HPO42-)=1时,结合图像可分别求出Ka1=c(H+)=10-2.12,Ka2=c(H+)=10-7.20,Ka3=c(H+)=10-12.36,则图中a、b、c分别表示lgc(H3PO4)c(H2PO4-)、lgc(HPO42-)c(H2PO4-)、lgc(PO43-)c(HPO42-)与pH的关系。
由上述分析知,A项正确;Y点为直线a、c的交点,此时lgc(H3PO4)c(H2PO4-)=lgc(PO43-)c(HPO42-),即c(H3PO4)c(H2PO4-)=c(PO43-)c(HPO42-),c(H3PO4)·c(HPO42-)=c(H2PO4-)·c(PO43-),又Ka1×Ka3=c(H+)·c(H2PO4-)c(H3PO4)×c(H+)·c(PO43-)c(HPO42-)=10-2.12×10-12.36=10-14.48,则c(H+)=10-7.24 ml·L-1,pH=7.24,B项正确;反应2H++HPO42-H3PO4的平衡常数K=c(H3PO4)c2(H+)·c(HPO42-)=c(H3PO4)·c(H2PO4-)c(H+)·c(H+)·c(H2PO4-)·c(HPO42-)=1Ka1×Ka2=109.32,C项错误;等浓度的Na3PO4溶液与KH2PO4溶液按体积比为1∶3混合,得到的混合溶液中有c(Na+)=c(K+)、c(H2PO4-)=c(HPO42-),根据电荷守恒可得c(Na+)+c(K+)+c(H+)=c(OH-)+2c(HPO42-)+c(H2PO4-)+3c(PO43-),即2c(Na+)+c(H+)=3c(PO43-)+3c(H2PO4-)+c(OH-),由图像可以看出当c(H2PO4-)=c(HPO42-)时,pH≈7,即c(H+)≈c(OH-),因此c(Na+)c(OH-)=c(H+),C项正确;根据题图4可知Fe3+完全沉淀的pH约为3.7,加入氧化铜可以调节溶液pH,当pH=5.5时部分铜离子会沉淀,应调节溶液pH在4~5之间,D项错误。
【备注】无
16.(1)分液漏斗 (2)将不易被氧化的C2+转化为具有较强还原性的[C(NH3)6]2+ (3)加入浓盐酸增大了 c(Cl-),使沉淀溶解平衡[C(NH3)6]Cl3(s)[C(NH3)6]3+(aq)+3Cl-(aq)逆向移动,有利于[C(NH3)6]Cl3析出 (4)冰水浴降温至接近0 ℃ (5)①平衡气压,防止氨气逸出 平衡气压,吸收未被H2SO4标准溶液吸收的氨气 ②偏低
【解析】(1)仪器a为分液漏斗。(2)根据已知信息,C2+不易被氧化,[C(NH3)6]2+具有较强还原性,将C2+转化为[C(NH3)6]3+过程中,先加浓氨水,目的是将不易被氧化的C2+转化为具有较强还原性的[C(NH3)6]2+。(3)向滤液中加适量浓盐酸,增大了 c(Cl-),使沉淀溶解平衡[C(NH3)6]Cl3(s)[C(NH3)6]3+(aq)+3Cl-(aq)逆向移动,有利于[C(NH3)6]Cl3析出。(4)根据[C(NH3)6]Cl3的溶解度曲线,[C(NH3)6]Cl3在水中的溶解度随温度升高而增大的幅度较大,过滤后所得滤液采用降温结晶的方法得到晶体,因此“操作A”为冰水浴降温至接近0 ℃。(5)①液封装置1的作用是平衡气压,并防止氨气逸出;液封装置2的作用是平衡气压,并吸收未被H2SO4标准溶液吸收的氨气。②氨气容易挥发,若未将液封装置2中的水倒入锥形瓶,则使得硫酸吸收的氨气偏少,则测得的NH3的质量分数偏低。
【备注】无
17.(1)①富集海水中的溴元素 ②5Br-+BrO3-+6H+3Br2+3H2O ③Br2和水的沸点相差更大,更易通过蒸馏而分离
(2)①关闭K1,打开K2,在烧杯C中加入适量的水,将导管末端浸入水中,缓慢鼓动气唧,观察导管末端有没有气泡产生 ②降低B的温度 通过气唧缓慢鼓入空气 B中溶液变成浅黄色 ③Cl2+2OH- Cl-+ ClO-+H2O、CO2+2OH- CO32-+H2O
【解析】本题以工业上海水制溴为载体,综合考查物质的制备、尾气处理、气密性检查、实验条件的控制等实验热点,意在提升考生的理解和迁移能力、综合实验探究能力。结合工业提溴原理,设计实验方案模拟实验过程,重在发展考生的科学探究与创新意识素养。(1)①海洋中溴的浓度极小,若第一步置换出Br2后即蒸馏则能耗高、产率低,故前三步的目的是富集海水中的溴元素。②结合流程信息,从吸收塔流出的溶液中含有BrO3-和Br-,而酸化之后生成了Br2,显然是BrO3-氧化了Br-,发生了归中反应。③蒸馏分离效果与各组分间沸点相差大小有关,沸点相差越大分离效果越佳。(2)①气密性检查的关键是“形成封闭体系,改变体系压强”。关闭K1、将导管末端浸入水中即可形成封闭体系;打开K2,鼓入空气若能使体系的压强增大,则导管末端必有气泡出现,从而说明装置气密性良好。②Br2易挥发,为使A中产生的Br2尽可能完全被吸收,可采取的合理措施是缓慢通入空气、降低B的温度等。B中Na2CO3溶液和Br2发生反应:3Br2+3Na2CO3NaBrO3+5NaBr+3CO2,当Br2被完全吸收后,过量的Cl2通入到B中,从而使B中溶液呈浅黄色。③这是一个尾气处理问题。尾气中除含有未反应的Cl2,装置B中采用Na2CO3溶液吸收Br2还产生了CO2,所以与NaOH溶液反应的可能会有Cl2、CO2。
【备注】无
18.(1)①Fe-2e-Fe2+ ②不变 (2)①白色粉末变蓝 ②ab
③4 0002 ④> ⑤CuSO4·3H2O、 CuSO4·H2O
38.89 ⑥Na2CO3·H2O中水蒸气的平衡压强(706 Pa)大于反应Ⅲ的平衡压强(107 Pa),使之逆向移动;小于反应Ⅱ的平衡压强(747 Pa),使之正向移动(也可计算Qc与 K2、K3的关系,对比说明)
【解析】(1)①土壤环境中钢质管道发生电化学腐蚀,作负极,电极反应为Fe-2e-Fe2+。②硫酸铜参比电极具有电位稳定的优点,则测量后CuSO4溶液的浓度不变。(2)②CuSO4·5H2O中水的质量分数为18×5160+18×5×100%=36%,CuSO4·3H2O中水的质量分数为18×3160+18×3×100%=25.23%,故反应Ⅰ对应的线段为ab。③反应Ⅱ产物CuSO4·H2O中水的质量分数为18160+18×100%=10.11%,对应的线段为cd,故反应Ⅱ平衡时p(H2O)=4 000 Pa,反应Ⅱ的平衡常数Kp=p2(H2O)=4 0002 Pa2。④反应Ⅲ为吸热反应,升高温度,平衡正向移动,p(H2O)增大,故p1>p2。⑤c点为CuSO4·3H2O,d点为CuSO4·H2O,则M点CuSO4·3H2O部分分解,体系中存在的固体为CuSO4·3H2O、CuSO4·H2O。设c点为1 ml CuSO4·3H2O,转化率为x,则M点CuSO4·3H2O为(1-x) ml,CuSO4·H2O为x ml,水的质量分数为[3(1-x)+x]×18214(1-x)+178x×100%=20%,解得x=38.89%。
【备注】无
19.(1)醚键(或醚基) (2)
(3)取代反应 HBr会与碳碳双键发生加成反应(或HBr会使醚键水解) (4) ++LiBr (5)
【解析】合成全景
(1)由A的结构简式可知,A中的含氧官能团有醛基和醚键。(5)化合物Y是A的同分异构体,Y的核磁共振氢谱有4组峰,峰面积之比为3︰3︰2︰2,说明Y分子结构对称,且含2个甲基;Y在稀硫酸条件下水解,其产物之一(分子式为C7H8O2)遇FeCl3溶液显紫色,说明Y分子中含有酚酯基;结合A的结构简式为可写出Y的结构简式为。
【备注】无
相关试卷
这是一份2023-2024学年湖北省武汉市高三(上)备考化学试卷(三),共25页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题(Word版附答案),文件包含湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题docx、湖北省武汉市第十二中学2023-2024学年高一下学期3月月考化学试题答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
这是一份湖北省武汉市2023-2024学年高三下学期年级二月调研考试化学试卷,文件包含湖北省武汉市2023-2024学年高三下学期二月调研考试化学试卷pdf、湖北省武汉市2023-2024学年高三下学期二月调研考试化学答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。








