

湖南省永州市第四中学2024-2025学年高三上学期期中考试 化学试题
展开
这是一份湖南省永州市第四中学2024-2025学年高三上学期期中考试 化学试题,共17页。试卷主要包含了答卷前,考生务必将自己的姓名等内容,欢迎下载使用。
注意事项:
1、答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2、回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3、考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 K 39 Mn 55 Fe 56
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 《天工开物》记载:软浆车榨蔗汁,一石(dàn)汁下石灰五合,取汁煎糖,冷凝成黑沙,黄泥水淋下成白糖。下列说法错误的是
A. 石灰可中和蔗汁中的酸性物质B. “冷凝成黑沙”是结晶过程
C. “黄泥水淋下”的目的是脱色D. “白糖”的主要成分是葡萄糖
2. 光照时,纳米TiO2能使水产生羟基自由基·OH,可用于处理废水。下列表述正确的是
A. 基态Ti的价电子排布式:3d2B. ·OH的电子式:
C. H2O的VSEPR模型:D. O的一种核素:8O
3. 将NaCl固体与浓硫酸加热生成的HCl气体通至饱和NaCl溶液,可析出用于配制标准溶液的高纯度NaCl,下列相关实验操作规范的是
4. 6-硝基胡椒酸是合成心血管药物奥索利酸的中间体,其合成路线中的某一步如下:
下列有关X和Y的说法正确的是
A. 所含官能团的个数相等B. 都能发生加聚反应
C. 二者中的所有原子共平面D. 均能溶于碱性水溶液
5. 白磷(P4)是不溶于水的固体,在空气中易自燃。下列有关白磷的说法错误的是
A. 分子中每个P原子的孤电子对数均为1
B. 常保存于水中,说明白磷密度大于1 g·cm-3
C. 难溶于水,是因为水是极性分子,P4是非极性分子
D. 熔点低,是因为P4分子内的P-P键弱
6. 化学与生活息息相关。下列离子方程式书写正确的是
A. 用Na2CO3溶液处理水垢中的CaSO4:CaSO4(s)+COeq \\al(2-,3)(aq)CaCO3(s)+SOeq \\al(2-,4)(aq)
B. 明矾用于净水:Al3++3H2OAl(OH)3↓+3H+
C. 抗酸药中的Mg(OH)2可治疗胃酸过多:OH-+H+=H2O
D. 用酸化的KI淀粉溶液检验加碘盐中的IOeq \\al(-,3):IOeq \\al(-,3)+I-+2H+=I2+H2O
7. 如图所示的铼配合物离子能电催化还原WY2。短周期元素W、X、Y、Z的原子序数依次增大。标准状况下,WY和X2是等密度的无色气体,Z2是黄绿色气体。下列说法错误的是
8. 某小组对Fe2(SO4)3和K3[Fe(CN)6]的性质进行探究:
Ⅰ.向少量蒸馏水里滴加2滴Fe2(SO4)3溶液,再滴加2滴KSCN溶液。
Ⅱ.向少量蒸馏水里滴加2滴K3[Fe(CN)6]溶液,再滴加2滴KSCN溶液。
下列说法正确的是
A. 实验Ⅰ中继续加入少量K2SO4固体,溶液颜色变浅
B. 实验Ⅱ中溶液呈红色
C. KSCN能区分Fe2(SO4)3和K3[Fe(CN)6]
D. 焰色试验不能区分Fe2(SO4)3和K3[Fe(CN)6]
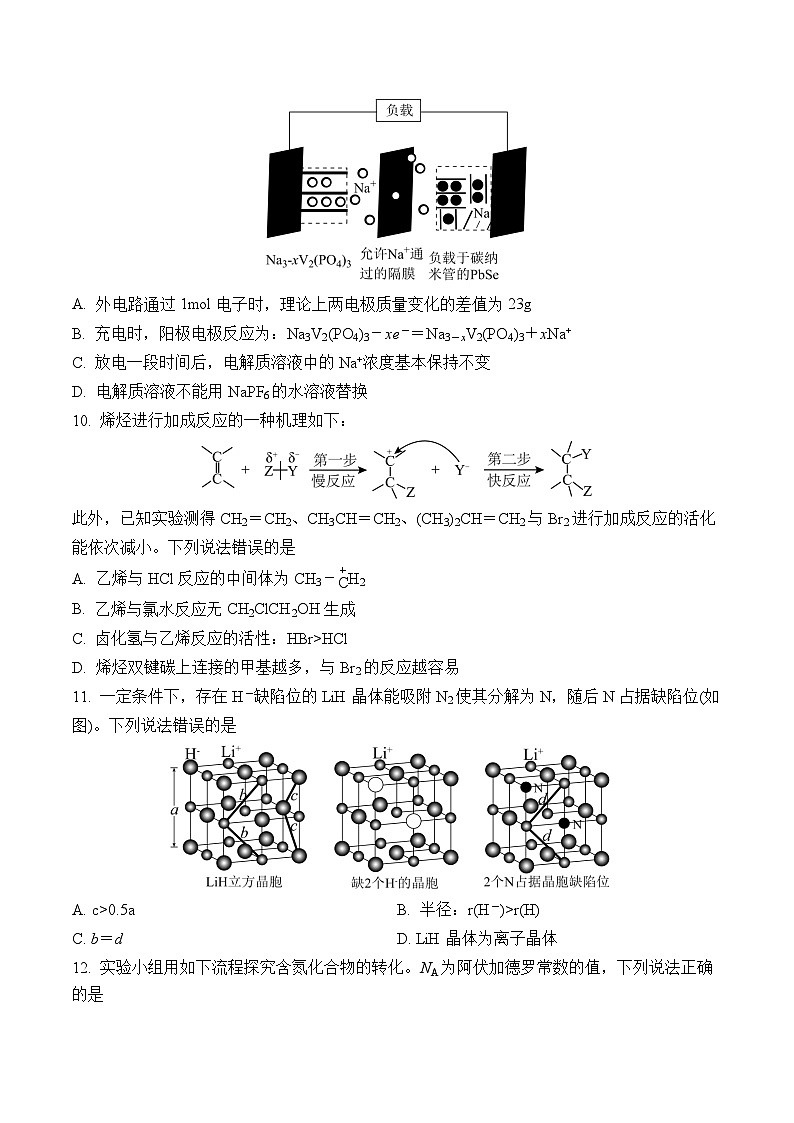
9. 某新型钠离子二次电池(如图)用溶解了NaPF6的二甲氧基乙烷作电解质溶液。放电时嵌入PbSe中的Na变成Na+后脱嵌。下列说法错误的是
A. 外电路通过1ml电子时,理论上两电极质量变化的差值为23g
B. 充电时,阳极电极反应为:Na3V2(PO4)3-xe-=Na3-xV2(PO4)3+xNa+
C. 放电一段时间后,电解质溶液中的Na+浓度基本保持不变
D. 电解质溶液不能用NaPF6的水溶液替换
10. 烯烃进行加成反应的一种机理如下:
此外,已知实验测得CH2=CH2、CH3CH=CH2、(CH3)2CH=CH2与Br2进行加成反应的活化能依次减小。下列说法错误的是
A. 乙烯与HCl反应的中间体为CH3-H2
B. 乙烯与氯水反应无CH2ClCH2OH生成
C. 卤化氢与乙烯反应的活性:HBr>HCl
D. 烯烃双键碳上连接的甲基越多,与Br2的反应越容易
11. 一定条件下,存在H-缺陷位的LiH晶体能吸附N2使其分解为N,随后N占据缺陷位(如图)。下列说法错误的是
A. c>0.5aB. 半径:r(H-)>r(H)
C. b=dD. LiH晶体为离子晶体
12. 实验小组用如下流程探究含氮化合物的转化。NA为阿伏加德罗常数的值,下列说法正确的是
A. “反应1”中,每消耗0.1ml NH4Cl,在25℃、101kPa下得到2.24L NH3
B. “反应2”中,每生成0.1mlNO,转移电子数为0.5 NA
C. 在密闭容器中进行“反应3”,0.1mlNO充分反应后体系中有0.1 NA个NO2
D. “反应4”中,为使0.1mlNO2完全转化成HNO3,至少需要0.02 NA个O2
13. 573K、高压条件下,一定量的苯甲腈在密闭容器中发生连续水解:C6H5CN(苯甲腈)→C6H5CONH2(苯甲酰胺)→C6H5COOH(苯甲酸)。如图为水解过程中上述三者(分别用X、Y、Z表示)的物质的量分数x(A)随时间t的变化曲线,其中x(A)=eq \f(n(A),n(X)+n(Y)+n(Z))。下列说法错误的是
14. 常温下,用0.1000 ml·L-1 NaOH溶液分别滴定下列两种混合溶液:
Ⅰ.20.00mL浓度均为0.1000 ml·L-1 HCl和CH3COOH溶液
Ⅱ.20.00mL浓度均为0.1000 ml·L-1 HCl和NH4Cl溶液
两种混合溶液的滴定曲线如图。已知Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5,下列说法正确的是
二、非选择题:本题共4小题,共58分。
15. (15分)由软锰矿(MnO2,含SiO2、Fe2O3、Al2O3和CuO等杂质)制备光电材料KMnF3的流程如下。回答下列问题:
已知:
(1)“甘蔗渣水解液”中含有还原性糖和H2SO4,其主要作用是 。为提高“浸取”速率,可采取的措施是 (任举一例)。
(2)“滤渣1”的主要成分是 (填化学式)。
(3)常温下,用CaCO3调节溶液pH至5~6时,可完全沉淀的离子有 (填化学式)。
(4)“X”可选用 。
A. H2SB. H2O2C. ZnD. (NH4)2S
(5)若用Na2CO3替代NaHCO3沉锰,得到Mn2(OH)2CO3沉淀。写出生成Mn2(OH)2CO3的离子方程式 。
(6)KMnF3立方晶胞如图,晶胞参数为a pm,该晶体中与一个F-紧邻的K+有 个。已知NA为阿伏加德罗常数的值,晶体密度为 g·cm-3(用含a、NA的代数式表示)。
16. (14分)二氧化硫脲[(NH2)2CSO2](TD)是还原性漂白剂,可溶于水,难溶于乙醇,在受热或碱性条件下易水解:(NH2)2CSO2+H2O=(NH2)2CO+H2SO2。其制备与应用探究如下:
Ⅰ.由硫脲[(NH2)2CS]制备TD
按如图装置,在三颈烧瓶中加入硫脲和水,溶解,冷却至5℃后,滴入H2O2溶液,控制温度低于10℃和pHHCl,C正确; D.已知实验测得CH2=CH2、CH3CH=CH2、(CH3)2CH=CH2与Br2进行加成反应的活化能依次减小;则烯烃双键碳上连接的甲基越多,与Br2的反应越容易,D正确;
11. 【答案】C【解析】A.根据LiH立方晶胞的该部分结构以及晶胞参数为a可得,因此,故A正确;B.H原子和H-的电子层数均为1,但H-比氢原子多一个电子,电子的运动轨道不重合,内核对电子的束缚相对较弱,电子活动的范围更广,因此H-的半径较大,故B正确;C.根据LiH立方晶胞可知,b的长度如图,但当N占据了空缺位后,由于比H-的半径大,因此,故C错误;D.LiH晶体中含有Li+和H-,相互间作用是离子键,因此LiH晶体为离子晶体,故D正确;
12. 【答案】B【解析】反应1为实验室制备氨气的反应,方程式为2NH4Cl+Ca(OH)2eq \(=====,\s\up7(△))2NH3↑+CaCl2+2H2O,反应2是氨气的催化氧化,方程式为:4NH3+5O2eq \(=====,\s\up9(催化剂),\s\dwn9(△))4NO+6H2O,反应3为一氧化氮和氧气反应生成二氧化氮,方程式为:2NO+O2=2NO2 ,反应4为二氧化氮,氧气和水反应生成硝酸,4NO2+2H2O+O2=4HNO3,以此解题。
【详解】A.根据分析可知,每消耗0.1ml NH4Cl,生成0.1ml氨气,但是由于不是标准状况,则气体不是2.24L,A错误;B.根据分析可知,反应2方程式为:4NH3+5O2eq \(=====,\s\up9(催化剂),\s\dwn9(△))4NO+6H2O,该反应转移20e-,则每生成0.1mlNO,转移电子数为0.5 NA,B正确;C.根据反应3,0.1mlNO充分反应后生成0.1 NA个NO2,但是体系中存在2NO2N2O4,则最终二氧化氮数目小于0.1 NA,C错误;D.根据反应4可知,为使0.1mlNO2完全转化成HNO3,至少需要0.025 NA个O2,D错误;
13. 【答案】D【解析】A.苯甲腈在溶液中发生连续水解:C6H5CN+H2OC6H5CONH2,C6H5CONH2+H2OC6H5COOH+NH3,有NH3生成,A正确;B.a点之前x(Y)逐渐增大,v(Y)消耗v(Y)生成,a点是Y物质的最大值,则生成和消耗的速率相等。即v(Y)消耗=v(Y)生成,B正确;C.x(Z)在15min前基本不变,15min后明显增大,在没有另加物质、没有改变反应条件的情况下,可能是水解产物对生成Z的反应有催化作用,C正确;D.根据图像所示,反应的前期应该有v(X)=v(Y)+v(Z),a点之后,由于v(X)明显减小,v(Z)显著增大,三者的速率关系不再满足v(X)=v(Y)+v(Z),D错误;
14.【答案】D【解析】溶液中加入40ml氢氧化钠溶液时,I中的溶质为氯化钠和醋酸钠,Ⅱ中的溶质为氯化钠和一水合氨,根据Ka(CH3COOH)=Kb(NH3·H2O)=1.8×10-5,醋酸根、铵根的水解程度小于醋酸、一水合氨的电离程度,氯化钠显中性,醋酸根和一水合氨在浓度相同时,一水合氨溶液的碱性更强,故I对应的滴定曲线为M,Ⅱ对应的滴定曲线为N;
【详解】A.向溶液中加入40ml氢氧化钠溶液时,I中的溶质为氯化钠和醋酸钠,Ⅱ中的溶质为氯化钠和一水合氨,氯化钠显中性,醋酸根和一水合氨在浓度相同时,一水合氨溶液的碱性更强,故I对应的滴定曲线为M,A错误;B.根据分析可知a点的溶质为氯化钠和醋酸钠,醋酸根发生水解,溶液的pH接近8,由水电离的c(H+)=c(OH-),数量级接近10-6,B错误;
C.当V(NaOH)=30.00mL时,Ⅱ中的溶质为氯化钠、氯化铵、一水合氨,且氯化铵和一水合氨的浓度相同,根据分析可知铵根的水解程度小于一水合氨的电离程度,故c(Cl-)>c(NHeq \\al(+,4))
>c(NH3·H2O),C错误;D. 根据元素守恒,n(CH3COOH)、n(CH3COO-)之和等于n(NH3·H2O)、n(NHeq \\al(+,4))之和,根据图像,pH=7时,Ⅱ所加氢氧化钠溶液较少,溶液体积较小,故Ⅰ中c(CH3COOH)、c(CH3COO-)之和小于Ⅱ中c(NH3·H2O)、c(NHeq \\al(+,4))之和,D正确;
二、非选择题:本题共4小题,共58分。
15. 【答案】(15分)
(1)把二氧化锰还原为硫酸锰(2分) 把软锰矿粉碎、搅拌、加热等(2分)
(2)SiO2(1分) (3)Al3+(2分) (4)D(2分)
(5)2Mn2++3COeq \\al(2-,3)+2H2O=Mn2(OH)2CO3↓+2HCOeq \\al(-,3) (2分)
(6)4(2分) eq \f(151,NAa3×10-30) (2分)
【解析】软锰矿含有MnO2和少量SiO2、Fe2O3、Al2O3、CuO。“甘蔗渣水解液”中含有还原性糖和H2SO4。用甘蔗渣水解液“浸取”软锰矿,二氧化锰被还原为硫酸锰,氧化铁被还原为硫酸亚铁,氧化铝、氧化铜溶于硫酸生成硫酸铝、硫酸铜,二氧化硅不溶于硫酸,滤渣是二氧化硅,滤液中加碳酸钙调节pH生成氢氧化铝沉淀除铝,过滤,滤液加硫化物反应生成FeS、CuS沉淀除铁铜,滤液中加碳酸氢钠反应生成碳酸锰沉淀,最终将碳酸锰转化为KMnF3。
(1)二氧化锰具有氧化性,“甘蔗渣水解液”中含有还原性糖和H2SO4,其主要作用是把二氧化锰还原为硫酸锰。根据影响反应速率的因素,为提高“浸取”速率,可采取的措施是把软锰矿粉碎、搅拌、加热等。
(2)二氧化硅不溶于硫酸,“滤渣1”的主要成分是SiO2。eq \r(eq \f(1.3×10-33,1×10-5))
(3)根据溶度积常数,Fe2+完全沉淀时,c(OH-)=eq \r(eq \f(4.9×10-17,1×10-5))=7×10-6.5,pH约为8.4;Al3+完全沉淀时,c(OH-)=eq \r(3,eq \f(1.3×10-33,1×10-5))≈5.1×10-10,pH约为4.7;Cu2+完全沉淀是c(OH-)=eq \r(eq \f(2.2×10-20,1×10-5))≈4.7×10-8,pH约为6.7;常温下,用CaCO3调节溶液pH至5~6时,可完全沉淀的离子有Al3+。
(4)加X的目的是生成硫化物沉淀除铁和铜,Fe2+和H2S不反应,所以不能选用H2S;铜离子、亚铁离子都能和硫离子反应生成硫化铜沉淀,所以“X”可选用(NH4)2S,选D。
(5)若用Na2CO3替代NaHCO3沉锰,得到Mn2(OH)2CO3沉淀,反应的离子方程式为2Mn2++3COeq \\al(2-,3)+2H2O=Mn2(OH)2CO3↓+2HCOeq \\al(-,3) 。
(6)1个晶胞中含有1个K+,根据化学式KMnF3可知,1个晶胞中含有1个Mn、3个F-,可知晶胞顶点上的原子为Mn、棱上的F-,该晶体中与一个F-紧邻的K+有4个;已知NA为阿伏加德罗常数的值,晶体密度为 eq \f(39+55+19×3,NA×(a×10-10)3)=eq \f(151,NAa3×10-30)=g·cm-3。
16. 【答案】(14分)(1)恒压滴液漏斗 (1分)
(2)防止二氧化硫脲水解、防止过氧化氢分解(2分)
(3)(NH2)2CS+2H2O2eq \(========,\s\up9(pH
相关试卷
这是一份湖南省祁阳市第四中学2024-2025学年高三上学期8月考试 化学试题(无答案),共8页。试卷主要包含了5 C59,下列说法正确的是,下列有关化学用语表示正确的是等内容,欢迎下载使用。
这是一份湖南省永州市广安友谊中学2025届高三上学期第一次模拟考试+化学试题,共8页。
这是一份湖南省永州市第四中学2024-2025学年高一上学期入学测试化学试题(PDF版,无答案),共5页。









