







所属成套资源:【新教材核心素养】人教版化学九年级下册课件+教学设计
初中化学人教版(2024)九年级下册(2024)第九单元 溶液课题3 溶质的质量分数公开课教学ppt课件
展开
这是一份初中化学人教版(2024)九年级下册(2024)第九单元 溶液课题3 溶质的质量分数公开课教学ppt课件,文件包含93溶质的质量分数课件共24张PPTpptx、93溶质的质量分数教案表格式doc等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
1.掌握溶液组成的表示方法──溶质质量分数。2.能进行溶质质量分数的简单计算。
在化学中如何定量地表示溶液的浓稀程度呢?
【实验9-7】比较三种不同浓度的硫酸铜溶液向三个小烧杯中各加入20mL水,然后分别加入 0.1g、 0.5g、 2g无水硫酸铜,搅拌溶解,比较三种溶液的颜色。
三个烧杯中溶液的颜色依次加深,由此可判断三支试管中的溶液浓度依次增大。
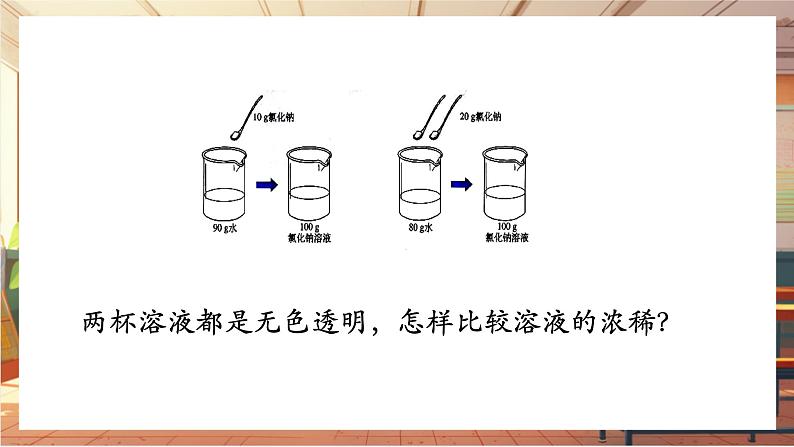
两杯溶液都是无色透明,怎样比较溶液的浓稀?
1、定义:溶质质量与溶液质量之比。
3、对溶液中溶质的质量分数的理解
①溶质的质量指的是形成溶液的那部分溶质的质量,未溶解的不计算在内。
②计算时上下质量单位要统一,不要忘记×100%,最后结果要写成百分数。
③溶液具有稳定性,只要外界条件不变,其溶质的质量分数不变。
溶质质量分数与溶解度的区别和联系
【实验9-8】配制两种不同质量分数的氯化钠溶液
溶液中溶质的质量分数:10%
溶液中溶质的质量分数:20%
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
= 100g + 36g
A.溶液中含有蔗糖10gB.溶液质量为100gC.每100g溶液中含有蔗糖10gD.每100g水中溶解了10g蔗糖
例1 某蔗糖溶液的溶质质量分数为10%,它表示的含义是 ( )
解析:溶质质量分数是溶质质量与溶液质量之比,蔗糖溶液中溶质的质量分数为10%的含义是,每100g溶液中含有蔗糖的质量为10g。
二、有关溶质的质量分数的计算
1.直接套用公式或变形公式
2.饱和溶液的溶质质量分数的计算
饱和溶液的溶质质量分数
例2 在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
答:需要24 kg氯化钠和126 kg水。
例3 向100 g 10%的NaOH溶液中加入12.5g NaOH固体,完全溶解后,所得溶液中溶质质量分数为( )A.12.5%B.20%C.22.5%D.25%
解析:根据溶质质量分数的计算公式,100g10%的溶液中溶质质量为10g,再加入12.5g,则溶质的质量为22.5g,溶液的质量为112.5g,所以溶液中溶质质量分数为22.5g/112.5g×100%=20%。B正确。
3.有关溶液稀释的计算
稀释前溶质质量 = 稀释后溶质质量A×a%=(A+m溶剂)×b%
(A表示浓溶液质量, a%表示浓溶液的溶质质量分数,b%表示稀释后溶液的溶质质量分数, m溶剂表示加入溶剂的质量)
稀释方法2:与同种溶质的低浓度溶液混合。
A×a%+B×b%=(A+B)×c%(A表示稀释前溶液的质量, B表示加入的低浓度溶液的质量, a%表示稀释前溶液的溶质质量分数,b%表示加入的低浓度溶液的溶质质量分数, c%表示混合后所得溶液的溶质质量分数)
计算依据:混合后溶质的质量= 两溶液溶质质量之和
增浓前溶质质量 = 增浓后溶质质量A×a%+B=(A+B)×c%
4.有关溶液增浓的计算
(A表示原溶液的质量,a%表示原溶液的溶质质量分数,B表示加入的溶质质量,c%表示加入溶质后所得溶液的溶质质量分数)
A×a%=(A-B)×c%(A表示原溶液的质量,a%表示原溶液的溶质质量分数,B表示蒸发的溶剂的质量,c%表示蒸发溶剂后所得溶液的溶质质量分数)
增浓方法2:蒸发溶剂(无晶体析出)。
计算依据:增浓前溶质质量 = 增浓后溶质质量
A×a%+B×b% =(A+B)×c% (A表示原溶液的质量,a%表示原溶液中溶质的质量分数,B表示浓溶液的质量,b%表示浓溶液中溶质的质量分数,c%表示混合后所得溶液的溶质质量分数)
增浓方法3:加入浓溶液。
例4 现有200g 30%的硝酸钾溶液,要配制成20%的硝酸钾溶液需要加水多少克?
解:设要加水的质量为x。由溶液稀释前后溶质的质量不变,得200g×30%=(200g+x)×20% x=100g答:需要加水100g。
溶质质量 = 溶液质量×溶质的质量分数
1.对“15%的食盐溶液”的含义解释错误的是( )A.100g水中溶解了15g食盐 B.100g食盐溶液中溶解有15g食盐C.将15g食盐溶解在85g水中所得到的溶液 D.将食盐与水按15:85的质量比配成的溶液
相关课件
这是一份化学九年级下册(2024)实验活动6 一定溶质质量分数的氯化钠溶液的配制教学课件ppt,文件包含实验活动6一定溶质质量分数的氯化钠溶液的配制课件共19张PPT内嵌视频pptx、实验活动6一定溶质质量分数的氯化钠溶液的配制教案表格式doc等2份课件配套教学资源,其中PPT共19页, 欢迎下载使用。
这是一份人教版(2024)九年级下册(2024)课题1 溶液及其应用一等奖教学课件ppt,文件包含91溶液及其应用课件共29张PPTpptx、91溶液及其应用教案表格式doc等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份人教版(2024)九年级下册(2024)课题3 溶质的质量分数教案配套课件ppt,共17页。PPT课件主要包含了装瓶贴签,ABC等内容,欢迎下载使用。










