



人教版(2024)九年级下册(2024)第九单元 溶液课题2 溶解度授课ppt课件
展开Learning Objectives
Intrductin f new lessns
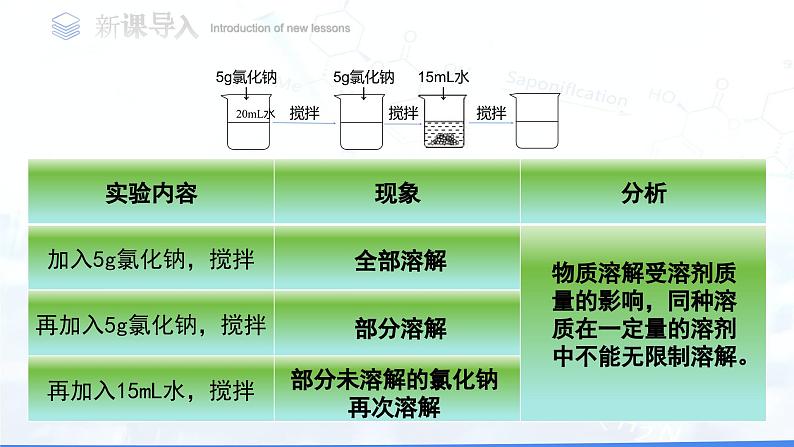
我们已经知道,蔗糖或氯化钠易溶于水。那么,在一定条件下,他们能不能无限度地溶解在一定量地水中呢?
部分未溶解的氯化钠再次溶解
物质溶解受溶剂质量的影响,同种溶质在一定量的溶剂中不能无限制溶解。
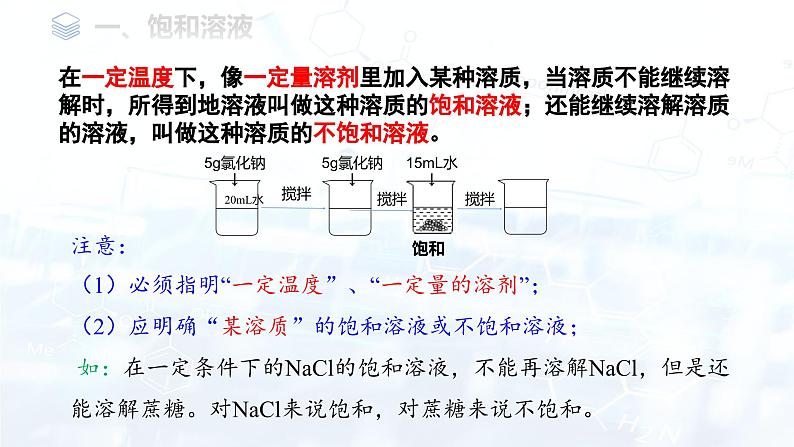
在一定温度下,像一定量溶剂里加入某种溶质,当溶质不能继续溶解时,所得到地溶液叫做这种溶质的饱和溶液;还能继续溶解溶质的溶液,叫做这种溶质的不饱和溶液。
注意:(1)必须指明“一定温度”、“一定量的溶剂”;(2)应明确“某溶质”的饱和溶液或不饱和溶液;如:在一定条件下的NaCl的饱和溶液,不能再溶解NaCl,但是还能溶解蔗糖。对NaCl来说饱和,对蔗糖来说不饱和。
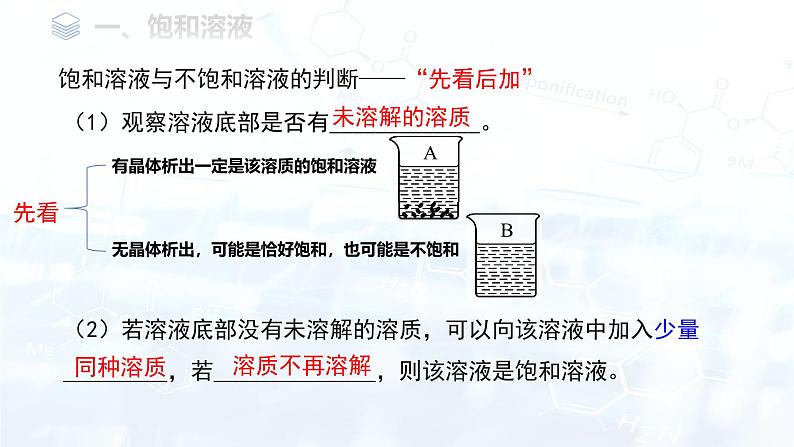
饱和溶液与不饱和溶液的判断——“先看后加”
(1)观察溶液底部是否有_____________。
(2)若溶液底部没有未溶解的溶质,可以向该溶液中加入少量_________,若______________,则该溶液是饱和溶液。
无晶体析出,可能是恰好饱和,也可能是不饱和
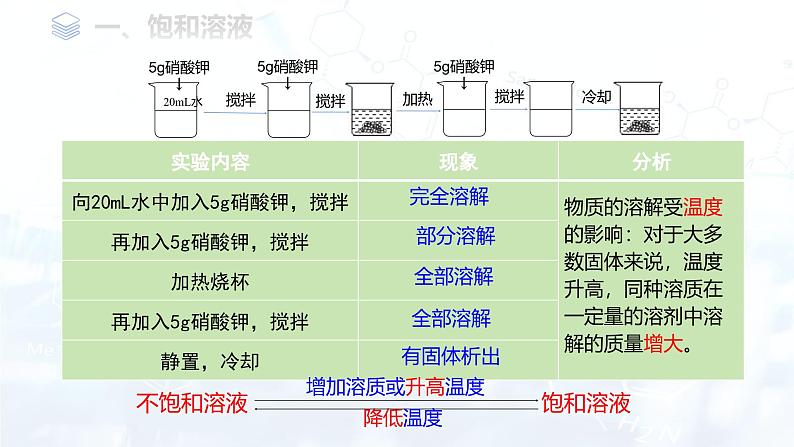
物质的溶解受温度 的影响:对于大多数固体来说,温度升高,同种溶质在一定量的溶剂中溶解的质量增大。
析出晶体后的溶液叫做母液,母液是 (饱和/不饱和)溶液。
结晶:溶液中的溶质以_____的形式析出的过程叫做结晶。
饱和溶液 结晶
增加溶质、蒸发溶剂或降低温度
(1)大多数固体溶质:
饱和溶液与不饱和溶液的相互转化
(2)少数如:熟石灰Ca(OH)2的溶解度随温度升高而减小。
增加溶质、蒸发溶剂或升高温度
饱和溶液、不饱和溶液与浓溶液、稀溶液
饱和溶液一定比不饱和溶液浓
稀溶液不一定是不饱和溶液。
浓溶液不一定是饱和溶液;
浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液;②不饱和溶液不一定是稀溶液;③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓
1.在一定温度下,某物质的饱和溶液一定是不能继续溶解物质的溶液。2.在某种溶质的饱和溶液中,再加入这种溶质,溶液的质量随之增加。3.降低温度能使不饱和的氢氧化钙溶液变饱和。4.加溶剂可以使饱和溶液变为不饱和溶液。5.所有固体物质接近饱和的溶液都可以通过降低温度而变成饱和溶液。6.饱和溶液不一定是浓溶液,也有可能是稀溶液。7.降低温度能使饱和溶液析出晶体。8.25℃时,将某KNO3溶液蒸发10g水析出ag晶体,再蒸发10g水又析出bg晶体,a与b的大小不一定相等。 9.饱和溶液析出晶体后就变成不饱和溶液。
( ) ( ) ( ) ( ) ( ) ( ) ( ) ( ) ( )
固体的溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,一般用“S”表示。四要素:①条件:一定温度 ②标准:100g溶剂 ③状态:达到饱和 ④质量:溶解度的单位:克
溶解度的含义:如20℃时NaCl的溶液度为36g含义:a.在20℃时,在100克水中最多能溶解36克NaCl。b.或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克。c.20℃时,完全溶解36gNaCl,最少需要100g水。d.
1、50℃时,硝酸钾的溶解度是90。2、t℃时,100g的水里溶解了30g氯化钠,则t℃时氯化钠的溶解度为30g。3、80℃时,硝酸钾在水中溶解27.8g形成饱和溶液,所以80℃时硝酸钾的溶解度是27.8g。4、在100g水里溶解了25.6g硝酸钾后就不能再溶解了.所以硝酸钾的溶解度为25.6g。
( ) ( )( ) ( ) ( )
影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
几种物质在不同温度时的额溶解度
溶解度及影响溶解度的因素
固体溶解度曲线纵坐标表示_______,用横坐标表示_____。意义:来表示固体物质的溶解度受_____变化影响。
几种物质在不同温度时的溶解度
a.大多数固体物的溶解度随温度升高而升高;如KNO3b.少数固体物质的溶解度受温度的影响很小;如NaClc.极少数物质溶解度随温度升高而降低。如Ca(OH)2
固体溶解度及其表示方法
(a)t3℃时a的溶解度为 ; (b)P点的的含义 ; (c)N点为 ,可通过 、 、 的方法使它变为饱和; (d)t1℃时a、b、c溶解度由大到小的顺序 ; (e)从a溶液中获取a晶体可用 的方法获取晶体;(f)从b的溶液中获取晶体,适宜采用 的方法获得晶体;
(g)t2℃ 时a、b、c的饱和溶液各W克,降温到t1℃会析出晶体的有 无晶体析出的有 ;(h)除去a中的泥沙用 ;当a中含有少量b时,提纯a,可采用 方法。 当b中含有少量a时,提纯b,可采用 方法。
在该温度时,a和c的溶解度相同
t3℃时a的不饱和溶液
1.查询某物质在某温度下的溶解度2.比较同一温度下不同物质溶解度大小3.判断溶解度随温度变化情况4.确定获得饱和溶液的方法5.确定结晶方法
1.在20℃时,向质量均为50g的5份水中分别加入一定质量的氯化钾固体,然后搅拌至完全溶解得到溶液(如有不溶解的氯化钾,则过滤除去)。加入氯化钾的质量与所得溶液的质量见下表:(1)在上表中M的值为 。(2)在20℃时,实验1所得的溶液为不饱和溶液,可通过 的方法使它变成饱和溶液(保持该温度不变)。
2.甲、乙、丙三种物质的溶解度曲线如图所示.根据图中信息回答下列问题:(1)50℃时,乙物质的溶解度是 g.(2)20℃时,甲、乙、丙三种物质溶解度由大到小的顺序为 .(3)温度为 ℃时,甲、乙两物质溶解度相同.(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液中溶质质量分数最小的是 .
3.小明同学想测定60℃时硝酸钾的溶解度,他在60℃的温度下,慢慢的往100克水中加硝酸钾固体,数据如表所示:请你来帮小明得出结论:在60℃时,硝酸钾的溶解度是 克.固体物质的溶解度除了与溶质、溶剂本身有关外,通常还与外界环境中的 有关.
气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
影响因素:①气体的性质 ②温度(温度越高,气体溶解度越小);③压强(压强越大,气体溶解度越大)
定义:在_________下,某固态物质在________里达到__________时所溶解的_____,叫做这种物质在这种溶剂里的溶解度。“S”表示。影响因素:内部:______和______的性质外部:_____。固体物质溶解度曲线(三条典型曲线)陡升_______,缓升_______,下降_________。
压强增大,S气体变____。
温度升高,S气体变____。
2.影响气体溶解度的因素:
1、如图所示是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答:(1)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 .(2)t2℃时将30g a物质加入到100g水中不断搅拌,形成的溶液是 (填“饱和溶液”或“不饱和溶液”).(3)P点的含义是 .(4)a、b、c三种物质的饱和溶液由t1℃升高到t2℃时(不考虑水分蒸发),发现其中一个烧杯中固体质量增加,则此烧杯溶液中的溶质是 .此时,三种溶液的溶质质量分数大小关系是 (填写选项序号).A.c>a=b B.a=b>c C.a>b>c D.b>a>c.
t1℃时a和c溶解度相等,都是20g
2、如图是a、b、c三种固体物质的溶解度曲线,请根据图示回答下列问题:(1)在t2℃时,a、b、c的溶解度的大小关系是 (2)P点是a、c两条曲线的交点,其含义是 。(3)t1℃时,将20ga固体放入50g水中,充分溶解后,所得溶液的质量是 g。(4)若a中含有少量的b杂质,提纯a的方法是 结晶。
在t1℃时,a、c两物质的溶解度相等
3、如图为KNO3、NaNO2(亚硝酸钠)、NaCl的溶解度曲线,请分析图象回答下列问题:(1)KNO3、NaNO2、NaCl三种物质的溶解度受温度的影响最大的是 。(2)KNO3与NaNO2的溶解度相等时的温度是 。(3)NaNO2有咸味,外观与NaCl相似,误食NaNO2会引起中毒。可用如下的方法区分它们:60℃时,取这两种固体各50g,分别加入到100g水中,充分搅拌,固体没有溶解完的是 ,固体完全溶解的是 。(4)若要使上述(3)中没有溶解完的固体完全溶解,应该采取的方法是 。(5)如图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。下列做法能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水) ( )A.从N→M:先向N中加入适量固体A再降温B.从N→M:先将N降温再加入适量固体AC.从M→N:先将M降温再将其升温D.从M→N:先将M升温再将其蒸发掉部分水。
4、已知A、B两种固体物质的溶解度曲线如图所示,请根据图回答下列问题:(1)t1℃时,A物质的溶解度 B物质的溶解度(填“>”“<”或“=”).(2)t2℃时,B物质的饱和溶液中溶质与溶剂的质量比为 .(3)将A物质的某种溶液从t3℃降至t1℃,溶液 (填“一定会”“可能会”或“一定不会”)有晶体析出.
5、茗茗测出了固体物质A在不同温度时的溶解度,并将实验数据记录于下表中:(1)通过对上表数据的分析,物质A的溶解度曲线应该是图中的 (选填“甲”或“乙”)(2)60℃时,配制130g物质A的饱和溶液,将其升温到80后,有 g晶体析出.(3)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是 (填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 .
人教版第九单元 溶液课题2 溶解度教课课件ppt: 这是一份人教版<a href="/hx/tb_c9866_t3/?tag_id=26" target="_blank">第九单元 溶液课题2 溶解度教课课件ppt</a>,共25页。PPT课件主要包含了建议用时25分钟,饱和状态,4单位克,影响因素,2温度,溶解度曲线的意义,知识拓展判断对错,[定性研究],一定温度和一定量的水,升高温度等内容,欢迎下载使用。
初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt: 这是一份初中化学人教版九年级下册第九单元 溶液课题2 溶解度示范课课件ppt,共24页。PPT课件主要包含了一饱和溶液,实验探究,想一想,溶液是否饱和的判断,概念上,外观上,饱和溶液,不饱和溶液,蒸发结晶,二溶解度等内容,欢迎下载使用。
人教版九年级下册课题2 溶解度课文课件ppt: 这是一份人教版九年级下册课题2 溶解度课文课件ppt,共27页。PPT课件主要包含了理新知·自主预习,一定温度,一定量溶剂,不能继续溶解,还能继续溶解,未溶解的溶质,少量该溶质,冷却热饱和溶液,蒸发溶剂,明重点·典例导航等内容,欢迎下载使用。













