

所属成套资源:备战2025年高考化学精品教案全套
- 备战2025年高考化学精品教案第七章化学反应速率和化学平衡第5讲化学反应速率与化学平衡的图像(Word版附解析) 教案 0 次下载
- 备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第1讲电离平衡(Word版附解析) 教案 0 次下载
- 备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第3讲酸碱中和反应及中和滴定(Word版附解析) 教案 0 次下载
- 备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第4讲盐类水解(Word版附解析) 教案 0 次下载
- 备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第5讲溶液中粒子浓度大小比较(Word版附解析) 教案 0 次下载
备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第2讲水的电离和溶液的pH(Word版附解析)
展开
这是一份备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第2讲水的电离和溶液的pH(Word版附解析),共18页。
认识思路
考点1 水的电离和水的离子积
1.水的电离
水是极弱的电解质,水的电离方程式为H2O+H2O ⇌H3O++OH-,可简写为[1] H2O⇌H++OH- ,纯水中c(H+)[2] = c(OH-)。
注意 在任何情况下水电离产生的c(H+)、c(OH-)都是相等的。
2.水的离子积常数
(1)表达式:Kw=[3] c(H+)·c(OH-) 。
(2)温度一定时,酸、碱、盐溶液中的Kw是定值,Kw=c(H+)·c(OH-)。温度升高,Kw增大,如25 ℃时,Kw=[4] 1.0×10-14 ,100 ℃时,Kw=5.5×10-13。
3.影响水的电离平衡的因素
1.易错辨析。
(1)25 ℃时,0.10 ml·L-1NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大。( ✕ )
(2)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变。( ✕ )
(3)t ℃的纯水中c(H+)=1×10-6.5 ml·L-1,此时水呈酸性。( ✕ )
(4)将水加热,Kw增大,pH减小。( √ )
2.纯水中的H+、OH-均是由水电离产生的。
(1)稀酸溶液中的OH-是 水 电离产生的;
(2)稀碱溶液中的H+是 水 电离产生的;
(3)Na2CO3溶液中的H+是 水 电离产生的,OH-是 水 电离产生的。
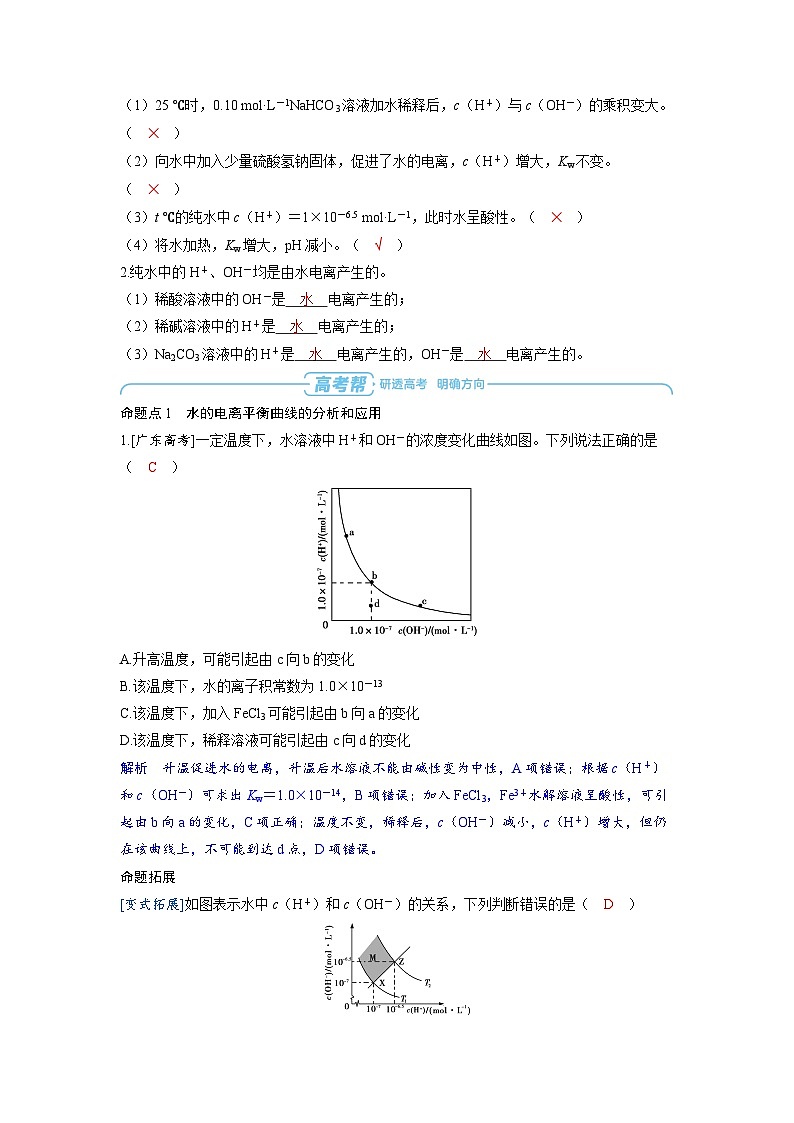
命题点1 水的电离平衡曲线的分析和应用
1.[广东高考]一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( C )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
解析 升温促进水的电离,升温后水溶液不能由碱性变为中性,A项错误;根据c(H+)和c(OH-)可求出Kw=1.0×10-14,B项错误;加入FeCl3,Fe3+水解溶液呈酸性,可引起由b向a的变化,C项正确;温度不变,稀释后,c(OH-)减小,c(H+)增大,但仍在该曲线上,不可能到达d点,D项错误。
命题拓展
[变式拓展]如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( D )
A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
解析 根据水的离子积定义可知,A项正确;XZ线上任意点都存在c(H+)=c(OH-),所以M区域内任意点均有c(H+)<c(OH-),B项正确;温度越高,Kw越大,由题图可知,T1时水的离子积小于T2时水的离子积,则T1<T2,C项正确;XZ线上只有X点的pH=7,D项错误。
技巧点拨
解答水的电离平衡曲线类试题的技巧
1.同一曲线上任意点的Kw都相等,即c(H+)·c(OH-)相等,对应的温度相同。
2.曲线外的任意点与曲线上任意点的Kw不同,对应的温度不同。
3.实现曲线上点之间的转化需保持温度不变,改变溶液的酸碱性;实现曲线上点与曲线外点之间的转化必须改变温度。
命题点2 影响水的电离平衡因素的定性分析
2.[2022浙江]25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10,下列说法正确的是( C )
A.相同温度下,等pH的C6H5ONa和CH3COONa溶液中,c(C6H5O-)>c(CH3COO-)
B.将浓度均为0.10 ml·L-1的C6H5ONa和NaOH溶液加热,两种溶液的pH均变大
C.25 ℃时,C6H5OH溶液与NaOH溶液混合,测得pH=10.00,则此时溶液中c(C6H5O-)=c(C6H5OH)
D.25 ℃时,0.10 ml·L-1的C6H5OH溶液中加少量C6H5ONa固体,水的电离程度变小
解析 同温度下,Ka(醋酸)>Ka(苯酚),苯酚的酸性比乙酸的弱,C6H5ONa的水解程度大于CH3COONa,若二者溶液的pH相等,则后者的浓度较大,c(C6H5O-)<c(CH3COO-),A项错误;C6H5ONa溶液因C6H5O-水解而显碱性,加热促进水解,c(OH-)增大,但同时Kw也增大,则c(H+)可能减小,即pH可能增大,NaOH溶液因NaOH电离而显碱性,加热时c(OH-)不变,Kw增大,则c(H+)增大,pH减小,B项错误;pH=10.00,则c(H+)=10-10 ml·L-1,而Ka=c(H+)·c(C6H5O-)/c(C6H5OH),则c(C6H5O-)/c(C6H5OH)=Ka/c(H+)=1.0,故此时溶液中c(C6H5O-)=c(C6H5OH),C项正确;苯酚溶液中存在电离平衡C6H5OH⇌C6H5O-+H+,加入苯酚钠固体,该电离平衡逆向移动,酸性减弱,且C6H5ONa可水解促进水的电离,所以水的电离程度变大,D项错误。
命题拓展
[变式拓展]25 ℃时,苯酚(C6H5OH)的Ka=1.0×10-10。
(1)反应C6H5O-+H2O⇌ C6H5OH+OH-的平衡常数为 1.0×10-4 。
(2)25 ℃时,向10 mL 0.01 ml·L-1苯酚(C6H5OH)溶液中滴加V mL 0.01 ml·L-1氨水,混合液中粒子浓度关系正确的是 D (填标号)。[已知25 ℃时,Kb(NH3·H2O)=1.7×10-5]
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度小于10 mL 0.01 ml·L-1苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
解析 (1)已知C6H5OH的Ka=1.0×10-10,则反应C6H5O-+H2O⇌ C6H5OH+OH-的平衡常数K=c(C6H5OH)×c(OH-)c(C6H5O-)=c(C6H5OH)×c(OH-)×c(H+)c(C6H5O-)×c(H+)=KwKa=1.0×10-141.0×10-10=1.0×10-4。(2)A项,+NH3·H2O +H2O,的水解程度远远大于NH4+的水解程度,V略小于10时,混合液的pH也可能大于7,错误;B项,不符合溶液呈电中性,错误;C项,为弱酸弱碱盐,促进水的电离,而显酸性,抑制水的电离,错误;D项,当V=5时,根据物料守恒可判断该式正确。
命题点3 水电离出的c(H+)或c(OH-)的定量计算与应用
3.25 ℃时,在等体积的①pH=0的H2SO4溶液、②0.05 ml·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( A )
A.1∶10∶1010∶109B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109D.1∶10∶104∶109
解析 设溶液的体积为1 L,①pH=0的H2SO4溶液中c(H+)=1.0 ml·L-1,c(OH-)=1.0×10-14 ml·L-1,电离的水的物质的量为1.0×10-14 ml;②中c(OH-)=0.1 ml·L-1,c(H+)=1.0×10-13 ml·L-1,电离的水的物质的量为1.0×10-13 ml;③中c(OH-)=1.0×10-4 ml·L-1,电离的水的物质的量为 1.0×10-4 ml;④中c(H+)=1.0×10-5 ml·L-1,电离的水的物质的量为1.0×10-5 ml。故①②③④中电离的水的物质的量之比为1∶10∶1010∶109,A项正确。
命题拓展
[变式拓展]某温度下Kw=1×10-13,计算下列由水电离出的c水(H+)或c水(OH-)。
(1)蒸馏水中,c水(H+)= 10-6.5 ml·L-1。
(2)0.05 ml·L-1 H2SO4溶液中,c水(H+)= 10-12 ml·L-1。
(3)0.1 ml·L-1 NaOH溶液中,c水(OH-)= 10-12 ml·L-1。
(4)pH=12的Na2CO3溶液中,c水(OH-)= 0.1 ml·L-1。
4.常温下,在体积均为20 mL、浓度均为0.1 ml·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离出的c水(H+)的负对数[-lg c水(H+)]
与滴加NaOH溶液体积的关系如图所示。下列说法不正确的是( A )
A.a、b、c三点溶液均显中性
B.a点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.b点溶液中的离子总浓度大于d点溶液
D.常温下,Ka(HX)≈10-5
解析 浓度均为0.1 ml·L-1的HX、HY溶液,结合题图的纵轴可知起始时HX溶液中c水(H+)=10-11 ml·L-1,HY溶液中水电离出的c水(H+)更小,说明HY酸性强于HX,HX一定为弱酸。常温下,a、b、c三点的c水(H+)均为10-7 ml·L-1,a点溶质为HX和NaX,溶液显中性,b点溶质为NaY,c点溶质为NaX和NaOH,溶液一定显碱性,A项错误;a点为HX和NaX的混合溶液,由电荷守恒c(H+)+c(Na+)=c(X-)+c(OH-),结合pH为7,说明c(Na+)=c(X-)>c(H+)=c(OH-),B项正确;由于HX为弱酸,d点为NaX溶液,NaX水解显碱性,c(H+)较小,c(H+)+c(Na+)小于b点NaY溶液中的c(H+)+c(Na+),C项正确;没有加NaOH溶液时c水(H+)=10-11 ml·L-1,则溶液中c(X-)=c(H+)=10-3 ml·L-1,c(HX)=(0.1-10-3) ml·L-1,则Ka(HX)=10-3×10-30.1-10-3≈10-5,D项正确。
技巧点拨
水电离出的c水(H+)或c水(OH-)的计算(25 ℃时)
1.酸溶液c(H+)=c酸(H+)+c水(H+)c(OH-)=c水(OH-)=c水(H+)
酸溶液中,H+来源于酸的电离和水的电离,而OH-只来源于水的电离。
2.碱溶液c(OH-)=c碱(OH-)+c水(OH-)c(H+)=c水(H+)=c水(OH-)碱溶液中,OH-来源于碱的电离和水的电离,而H+只来源于水的电离。
3.盐溶液水解呈酸性c(H+)=c水(H+)c(OH-)=Kwc(H+)水解呈碱性c(OH-)=c水(OH-)c(H+)=Kwc(OH-)中性:c(H+)=c水(H+)=c(OH-)=c水(OH-)
水解呈酸性或碱性的盐溶液中,H+和OH-均来源于水的电离。
考点2 溶液的酸碱性与pH
1.溶液的酸碱性
溶液的酸碱性取决于c(H+)与c(OH-)的相对大小,具体内容见下表:
2.pH
定义式:pH=[4] -lg c(H+) 。
在相同温度下,pH越小,溶液酸性越强;pH越大,溶液碱性越强;pH通常只表示c(H+)[或c(OH-)]≤1 ml·L-1的电解质稀溶液的酸碱性。pH每改变1,则c(H+)或c(OH-)改变10倍。
注意 除pH外,常见的还有pOH(pH+pOH=pKw)、pKa、pKb等。
3.溶液pH的测定
注意 (1)用pH试纸测定溶液pH时,试纸不能润湿。
(2)若某溶液具有漂白性或强氧化性,则不能用pH试纸测定其pH。如氯水、过氧化氢溶液、浓硝酸等。
1.易错辨析。
(1)任何温度下,利用H+和OH-浓度的相对大小均可判断溶液的酸碱性。( √ )
(2)某溶液的pH=7,该溶液一定显中性。( ✕ )
(3)用广泛pH试纸测得某溶液的pH为3.4。( ✕ )
(4)一定温度下,pH=a的氨水稀释10倍后,其pH=b,则a=b+1。( ✕ )
2.若用湿润的pH试纸(用水润湿的)测定溶液的pH:
(1)湿润的pH试纸测定NaCl溶液的pH时,其pH 不变 (填“偏大”“偏小”或“不变”,下同)。
(2)湿润的pH试纸测定碱性溶液的pH时,其pH 偏小 。
(3)湿润的pH试纸测定酸性溶液的pH时,其pH 偏大 。
命题点1 溶液酸碱性的判断
1.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a ml·L-1的一元酸HA与b ml·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( C )
A.a=b
B.混合溶液的pH=7
C.混合溶液中, c(H+)=Kw
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
解析 “一元酸”可能是“一元强酸”或“一元弱酸”,“一元碱”可能是“一元强碱”或“一元弱碱”,等物质的量浓度、等体积的一元酸与一元碱混合,混合溶液不一定呈中性,A项不符合题意;常温时,pH=7的溶液呈中性,温度为T时,pH=7的溶液不一定呈中性,B项不符合题意;若c(H+)=Kw,则c2(H+)=Kw,又Kw=c(OH-)·c(H+),有c2(H+)=c(OH-)·c(H+),c(H+)=c(OH-),故混合溶液呈中性,C项符合题意;无论混合溶液呈酸性、中性还是碱性,溶液都呈电中性,都存在c(H+)+c(B+)=c(OH-)+c(A-),D项不符合题意。
命题拓展
[题干拓展]温度为T时,水的离子积常数为Kw,该温度下,将浓度为a ml·L-1的H2SO4溶液与b ml·L-1的一元碱AOH溶液等体积混合,则可判定溶液呈中性的依据是 A (填标号)。
A.混合溶液中c(SO42-)=12c(A+)
B.混合溶液中c(H+)·c(OH-)=Kw
解析 A项,根据电荷守恒,c(H+)+c(A+)=c(OH-)+2c(SO42-),当c(H+)=c(OH-)时,有2c(SO42-)=c(A+);B项,无论溶液呈酸性、中性还是碱性,都存在c(H+)·c(OH-)=Kw。
技巧点拨
溶液酸碱性的判断方法
1.根据pH、pOH、pKw进行判断:pH<pKw<pOH,溶液呈酸性;pH=pOH=pKw,溶液呈中性;pOH<pKw<pH,溶液呈碱性。
其中:pOH=-lg c(OH-),pKw=-lgKw,pH+pOH=pKw。
2.常温下,酸、碱溶液等体积混合所得溶液的酸碱性分析
等体积的强酸(pH1)与强碱(pH2)混合
若混合前pH1+pH2>14,则混合后溶液呈碱性,pH混>7;
若混合前pH1+pH2=14,则混合后溶液呈中性,pH混=7;
若混合前pH1+pH2<14,则混合后溶液呈酸性,pH混<7。
注意:常温下,任何酸(或碱)溶液无限稀释时,溶液的pH都不可能大于7(或小于7),只能接近7。
命题点2 溶液pH的计算
2.下列说法正确的是( B )
A.[2021重庆]向0.2 ml·L-1磷酸中加水至原体积的两倍,则c(H+)>0.1 ml·L-1
B.[浙江高考]常温下,pH为3的醋酸溶液中加入醋酸钠固体,溶液pH增大
C.[浙江高考]0.1 ml·L-1的HA溶液与0.1 ml·L-1的NaOH溶液等体积混合,所得溶液pH一定等于7.0
D.0.1 ml·L-1的Na2CO3溶液中加入少量CaCl2晶体,溶液的pH增大
解析 向0.2 ml·L-1磷酸中加水至原体积的2倍,H3PO4是弱酸,故c(H+)<0.1 ml·L-1,A项错误;醋酸溶液中加入醋酸钠固体,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小,pH增大,B项正确;若HA为弱酸,则与NaOH恰好完全反应时得到的是一种强碱弱酸盐,其水溶液呈碱性,C项错误;0.1 ml·L-1的Na2CO3溶液中加入少量CaCl2晶体,两者反应生成CaCO3,CO32-浓度减小,其水解平衡逆向移动,水解生成的氢氧根离子浓度减小,溶液的pH减小,D项错误。
技巧点拨
溶液pH的计算方法
方法——强酸溶液:根据浓度及电离求c(H+)—弱酸溶液:根据浓度及Ka1(Ka)求c(H+)—强碱溶液:根据浓度及电离求c(OH-),再求c(H+)—弱碱溶液:根据浓度及Kb1(Kb)求c(OH-),再求c(H+)—酸、酸混合:c(H+)=c1(H+)V1+c2(H+)V2V1+V2—碱、碱混合:c(OH-)=c1(OH-)V1+c2(OH-)V2V1+V2,再求c(H+)—酸、碱混合:酸过量时,可直接求c(H+);碱过量时,先求c(OH-),再求c(H+)
3.[溶液的稀释]常温下,下列关于溶液的稀释的说法正确的是( B )
A.pH=3的醋酸溶液稀释100倍,pH=5
B.将1 L 0.1 ml·L-1的Ba(OH)2溶液稀释为2 L,pH=13
C.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c水(H+)=1.0×10-6 ml·L-1
D.pH=8的NaOH溶液稀释100倍,其pH=6
解析 醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释能促进醋酸电离,则pH=3的醋酸溶液加水稀释100倍,pH<5,A项错误;将1 L 0.1 ml·L-1的Ba(OH)2溶液加水稀释为2 L,溶液中c(OH-)为0.1 ml·L-1,则c(H+)=1.0×10-13 ml·L-1,所以pH=13,B项正确;pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c水(OH-)=1.0×10-8 ml·L-1,则由水电离产生的c水(H+)=1.0×10-8 ml·L-1,C项错误;将pH=8的NaOH溶液加水稀释100倍,溶液仍然呈碱性,不可能呈酸性,其溶液的pH>7,D项错误。
命题拓展
[变式拓展]常温下,体积相等、pH相等的HX、HY酸溶液,体积相等、pH相等的AOH、BOH碱溶液分别加水稀释,稀释过程中溶液的pH与加水体积的变化图像如图所示。
(1)酸性:HX > (填“>”“<”或“=”,下同)
HY;起始浓度:c(AOH) > c(BOH)。
(2)加水至V1时,AOH、BOH溶液中,水电离出的c(OH-)较大的是 BOH 溶液。
(3)加水至V1时,HX、HY溶液中,水电离出的c(H+)较大的是 HX 溶液。
1.[2024山东邹城模拟]向10 mL 1 ml·L-1的HCOOH溶液中不断滴加1 ml·L-1的NaOH溶液,并一直保持常温,所加NaOH溶液的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离出的H+的浓度。下列说法正确的是( C )
A.常温下,Ka(HCOOH)的数量级为10-5
B.a点溶液显酸性,b点溶液pH为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性先增强后减弱,最后保持不变
解析 起始时1 ml·L-1的甲酸溶液中c水(H+)=c水(OH-)=10-12 ml·L-1,酸溶液中OH-均是由水电离出来的,则溶液中c(H+)=Kwc水(OH-)=10-2 ml·L-1,HCOOH的电离平衡常数Ka(HCOOH)=c(H+)·c(HCOO-)c(HCOOH)=10-2×10-21=10-4,数量级为10-4,A错误;酸或碱抑制水的电离,盐类水解促进水的电离,a点溶液中存在HCOOH和HCOONa,c水(H+)=10-7 ml·L-1,说明HCOOH对水电离的抑制程度与HCOO-水解对水电离的促进程度相等,则溶液呈中性,b点溶液为HCOONa和过量的NaOH的混合溶液,溶液显碱性,B错误;由题图知,从a点到b点的过程中,c水(H+)先增大后减小,则水的电离程度先增大后减小,C正确;随着NaOH溶液的不断加入,溶液中离子浓度不断增大,溶液的导电性不断增强,当HCOOH完全反应后,继续加入NaOH溶液,溶液中OH-浓度增大,溶液的导电性增强,D错误。
2.已知AG=lgc(H+)c(OH-)。25 ℃时,用0.100 ml·L-1的盐酸滴定20.00 mL 0.100 ml·L-1某一元碱MOH溶液,AG与所加盐酸的体积关系如图所示。下列说法错误的是( D )
A.Kb(MOH)约为10-5.5
B.a点时,由水电离出来的c水(H+)为1×10-10.75 ml·L-1
C.b点时,加入盐酸的体积小于20.00 mL
D.由b点到c点的过程中水的电离平衡逆向移动
解析 由a点(-7.5,0)知,0.100 ml·L-1 MOH溶液中,c(H+)c(OH-)=Kwc2(OH-)=10-7.5,则c(OH-)=10-3.25 ml·L-1,MOH为一元碱,则Kb(MOH)=c(M+)·c(OH-)c(MOH) ≈c2(OH-)0.100=10-5.5,A正确;a点时, c(OH-)=10-3.25 ml·L-1,c(H+)=1×10-10.75 ml·L-1,碱溶液中H+全部由水电离产生,所以水电离出的c水(H+)为1×10-10.75 ml·L-1,B正确;b点时,AG=0,c(OH-)=c(H+),溶液呈中性,而MCl为强酸弱碱盐,M+水解使溶液呈酸性,则b点所得溶液为MCl和MOH的混合溶液,MOH还未被完全中和,加入盐酸的体积小于20.00 mL,C正确;由于b点MOH尚未被完全中和,c点AG=7.5,盐酸过量,酸、碱抑制水的电离,故由b点到c点的过程中,水的电离先被促进再被抑制,即水的电离平衡先正向移动再逆向移动,D错误。
1.[2023合肥模拟改编]下列叙述正确的是( D )
A.将水加热, c(H+)增大,pH减小,水呈酸性
B.恒温下,向水中加入少量醋酸钠固体,水的电离程度不变
C.恒温下,向水中加入少量硫酸氢钠固体,促进水的电离
D.恒温下,向水中滴入稀醋酸,水的电离平衡逆向移动,c(H+)增大
解析 将水加热,c(H+)增大,pH减小,但c(H+)=c(OH-),水仍呈中性,A项错误;恒温下,向水中加入少量醋酸钠固体,CH3COO-的水解促进水的电离,水的电离程度增大,B项错误;硫酸氢钠可在水溶液中电离出H+,使溶液呈酸性,抑制水的电离,水的电离程度减小,C项错误;恒温下,向水中滴入稀醋酸,c(H+)增大,酸会抑制水的电离,故水的电离平衡逆向移动, D项正确。
2.[2023广东实验中学期末]如图所示,X、Y、Z表示的是常温下水、一定浓度的石灰水、一定浓度的稀盐酸的近似pH。下列说法错误的是( D )
A.X中由水电离出的c(H+)=1×10-12 ml·L-1
B.Y中由水电离出的c(OH-)=1×10-7 ml·L-1
C.Z中由水电离出的c(H+)=1×10-10 ml·L-1
D.物质的量浓度:X<Z
解析 稀盐酸显酸性,pH<7;水显中性,pH=7;石灰水显碱性,pH>7。据此可判断:
稀盐酸的物质的量浓度等于稀盐酸中H+的物质的量浓度,为1×10-2 ml·L-1,石灰水的物质的量浓度等于石灰水中OH-物质的量浓度的一半,为12×1×10-141×10-10 ml·L-1=5×10-5 ml·L-1,则物质的量浓度:X>Z,D项错误。
3.[2021广东]鸟嘌呤(G)是一种有机弱碱,可与盐酸反应生成盐酸盐(用GHCl表示)。已知GHCl水溶液呈酸性,下列叙述正确的是( B )
ml·L-1 GHCl水溶液的pH=3
ml·L-1 GHCl水溶液加水稀释,pH升高
C.GHCl在水中的电离方程式为GHCl G+HCl
D.GHCl水溶液中:c(OH-)+c(Cl-)=c(GH+)+c(G)
解析 根据题中信息鸟嘌呤是有机弱碱,可知其与盐酸反应生成的GHCl为强酸弱碱盐,故GHCl溶液呈酸性。题中没有给出G的电离平衡常数和GH+的水解平衡常数,故无法确定0.001 ml·L-1 GHCl水溶液的pH,A项错误;GHCl溶液加水稀释可促进GH+水解,溶液中H+数目增多,但溶液体积增大,H+浓度减小,即溶液的pH升高,B项正确;GHCl为盐酸盐,属于强电解质,其在水中的电离方程式为GHCl GH++Cl-,C项错误;GHCl溶液中存在电荷守恒式c(OH-)+c(Cl-)=c(GH+)+c(H+),D项错误。
4.[2024重庆南开中学质检]下列有关说法不正确的是( D )
A.将盐酸逐滴滴入氨水中至过量,水的电离程度:先增大后减小
B.等浓度的Na2CO3溶液和CH3COONa溶液的pH:前者大于后者
C.向0.1 ml·L-1NaHS溶液中滴加酚酞,溶液变红,则Kw>Ka1(H2S)·Ka2(H2S)
D.pH计测得SO2和CO2饱和溶液的pH,前者小于后者,则H2SO3的酸性强于H2CO3
解析 随着盐酸的加入,生成氯化铵,氯化铵水解促进水的电离,水的电离程度逐渐增大,当盐酸和氨水恰好完全反应时水的电离程度最大,再继续滴加盐酸,水的电离受到抑制,电离程度逐渐减小,A项正确;醋酸的酸性大于碳酸,弱酸的酸性越弱,弱酸阴离子越易水解,所以等浓度的碳酸钠溶液的pH大于醋酸钠溶液的pH,B项正确;NaHS溶液呈碱性,说明HS-的水解程度大于其电离程度,Kh2(S2-)=KwKa1(H2S)>Ka2(H2S),即Kw>Ka1(H2S)·Ka2(H2S),C项正确; SO2和CO2的饱和溶液的浓度不同,不能由pH大小得出酸性强弱,D项错误。
5.[浙江高考]下列说法不正确的是( B )
A.pH>7的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、NaOH溶液,所需HCl的物质的量相同
C.相同温度下,pH相等的盐酸、CH3COOH溶液中,c(OH-)相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则c(Cl-)=c(NH4+)
解析 没有给出温度,pH>7的溶液不一定呈碱性,A项正确;pH相同的氨水和NaOH溶液,氨水的物质的量浓度大,所以中和pH和体积均相等的氨水、NaOH溶液,氨水消耗HCl的物质的量多,B项错误;相同温度下,水的离子积常数相等,盐酸和CH3COOH溶液的pH相等时,两溶液中 c(OH-)也相等,C项正确;混合后溶液中的电荷守恒为c(H+)+c(NH4+)=c(Cl-)+c(OH-),溶液呈中性,即 c(H+)=c(OH-),所以 c(NH4+)=c(Cl-),D项正确。
6.[2023山东菏泽检测]在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是( D )
A.向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B.25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化
C.温度为T时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液呈中性
D.b点对应的溶液中可大量存在:K+、Ba2+、NO3-、I-
解析 A项,因为a点对应的溶液呈中性,根据电荷守恒可知c(Na+)=c(CH3COO-),正确;B项,CH3COONa属于强碱弱酸盐,会发生水解,使c(OH-)增大,可能引起由b向a的变化,升温,溶液中的c(OH-)和c(H+)同时同等程度地增大,所以可能引起由a向c的变化,正确;C项,由图像知温度为T时Kw=10-12,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液呈中性,正确;D项,由图像知b点对应的溶液呈酸性,溶液中NO3-、I-在酸性条件下发生氧化还原反应,不能大量存在,错误。
7.[2023北京丰台区考试]在常温下,有关下列4种溶液的叙述不正确的是( C )
A.在溶液①和②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小
B.各取1 mL 4种溶液,分别稀释至10 mL,则溶液的pH:①>②>④>③
C.将溶液②和③等体积混合,所得溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.将a L 溶液②和b L 溶液④混合后,所得溶液的pH=4,则a∶b=9∶11(忽略溶液体积变化)
解析 在溶液①中存在电离平衡:NH3·H2O⇌NH4++OH-,向其中加入NH4Cl晶体后,溶液中c(NH4+)增大,电离平衡逆向移动,导致溶液中c(OH-)减小,则溶液的pH减小;向NaOH溶液中加入NH4Cl晶体后,NH4Cl电离产生的NH4+与溶液中OH-结合形成NH3·H2O,导致溶液中c(OH-)减小,则溶液的pH也减小,A项正确。溶液①和③中的溶质是弱电解质,存在电离平衡,加水促进弱电解质的电离,pH变化程度较小,而溶液②和④中的溶质是强电解质,加水稀释,pH变化程度较大,所以稀释后,溶液的pH:③<④<7,①>②>7,所以4种溶液的pH:①>②>④>③,B项正确。NaOH是强碱,CH3COOH是弱酸,当溶液②和③等体积混合后,得到的是CH3COONa与CH3COOH的混合溶液,CH3COOH电离产生的H+使溶液显酸性,即c(H+)>c(OH-),C项错误。将a L 溶液②与b L溶液④混合后,所得溶液的pH=4,则混合溶液中c(H+)=0.001(b-a)a+b ml·L-1=10-4 ml·L-1,解得a∶b=9∶11,D项正确。
8.[2023天津二模 ]常温下,向新制氯水中滴加NaOH溶液,溶液中水电离出的OH-浓度与NaOH溶液体积之间的关系如图所示。下列推断正确的是( B )
A.E、H点对应的溶液的pH分别为3和7
B.F点对应的溶液中:c(Na+)=c(Cl-)+c(ClO-)
C.G点对应的溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)>c(H+)
D.E~H点对应的溶液中,c(Cl-)+c(ClO-)+c(HClO)+c(Cl2)为定值
解析 E点为新制氯水,溶液呈酸性,由水电离出的c(OH-)=10-11 ml·L-1,则溶液pH=3,H点为NaOH和NaClO、NaCl的混合溶液,溶液呈碱性,由水电离出的c(OH-)=10-7ml·L-1,说明NaOH电离对水的电离的抑制程度和NaClO水解对水的电离的促进程度相同,溶液pH>7,A项错误;F点对应的溶液呈中性,c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),知c(Na+)=c(Cl-)+c(ClO-),B项正确;G点水的电离程度最大,对应的溶液为等物质的量浓度的NaCl、NaClO的混合溶液,由于ClO-水解,溶液呈碱性,故c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),C项错误;根据氯元素守恒,E~H点对应的溶液中n(Cl-)+n(ClO-)+n(HClO)+2n(Cl2)为定值,但随着NaOH溶液的加入,溶液体积逐渐增大,c(Cl-)+c(ClO-)+c(HClO)+c(Cl2)不为定值,D项错误。
9.[2023安徽校级联考]25 ℃时,向20.00 mL 0.1 ml·L-1 H2X溶液中滴入0.1 ml·L-1 NaOH溶液,溶液中由水电离出的c水(OH-)的负对数[-lg c水(OH-)]即pOH水与所加NaOH溶液体积的关系如图所示。下列说法正确的是( B )
A.水的电离程度:M>P
B.P点溶液中:c(OH-)=c(H+)+c(HX-)+2c(H2X)
C.N点和Q点溶液的pH相同
D.图中P点至Q点对应溶液中c(HX-)c(X2-)逐渐增大
解析 由图可知,M点水电离出的c水(OH-)=10-11.1 ml·L-1,P点水电离出的c水(OH-)=10-5.4 ml·L-1,则水的电离程度P>M,A项错误;P点溶液的溶质为Na2X,溶液中存在质子守恒c(OH-)=c(H+)+c(HX-)+2c(H2X),B项正确;N点到Q点,加入的NaOH溶液逐渐增多,溶液的pH逐渐增大,C项错误;c(HX-)c(X2-)=c(HX-)c(X2-)×c(OH-)c(OH-)=Kh(X2-)c(OH-),水解平衡常数只与温度有关,温度相同,水解平衡常数相同,在加碱的滴定过程中c(OH-)逐渐增大,故P点至Q点对应溶液中c(HX-)c(X2-)逐渐减小,D项错误。
10.[2023山东青岛期末]常温下,分别取未知浓度的KOH溶液和HA溶液,加水稀释至原体积的n倍。稀释过程中,lg n与两溶液pH的变化关系如图所示。下列叙述正确的是( B )
A.P线代表KOH溶液
B.X、Y、Z点对应溶液中水的电离程度:Z=X>Y
C.将X点对应溶液稀释105倍,所得溶液pH=8
D.等体积、pH之和为14的KOH溶液和HA溶液恰好完全反应
解析
由上述分析可知,A项错误;水的电离会受溶液中酸电离出的H+或碱电离出的OH-的抑制,X点对应溶液的pH=5,水电离出的c水(H+)=c(OH-)=Kwc(H+)=1×10-141×10-5 ml·L-1=1×10-9 ml·L-1,Z点对应溶液中水电离出的c水(H+)为1×10-9 ml·L-1,Y点对应溶液中水电离出的c水(H+)为1×10-10 ml·L-1,所以水的电离程度Z=X>Y,B项正确;常温下,酸溶液无论稀释多少倍,pH始终小于7,C项错误;HA为弱酸,HA溶液中有部分HA未电离,则pH之和为14的KOH溶液和HA溶液中HA溶液的浓度大,故等体积的二者反应时酸有剩余,D项错误。
11.[2023浙江宁波模拟]25 ℃时,将1.0 L x ml · L-1 CH3COOH溶液与0.1 ml NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl 气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量n的变化如图所示。下列叙述正确的是( B )
A.水的电离程度:①>②>③
B.点②对应的混合溶液中:c(CH3COOH)+c(CH3COO-)=x ml·L-1
C.点③对应的混合溶液中:c(Na+)>c(CH3COO-)
D.该温度下,CH3COOH的电离平衡常数Ka=10-8x-0.1
解析 ①处溶液pH<7,显酸性,说明x>0.1,CH3COOH与NaOH反应后CH3COOH有剩余,①处溶液为CH3COONa与CH3COOH的混合溶液,向其中加入NaOH发生反应CH3COOH+NaOH CH3COONa+H2O,向其中通入HCl发生反应CH3COONa+HCl CH3COOH+NaCl。酸或碱抑制水的电离,盐类水解促进水的电离,且酸或碱浓度越大,对水的电离抑制程度越大,①、②、③对应溶液的pH均不大于7,且pH②<①<③,所以水的电离程度③>①>②,A项错误。根据物料守恒知,点②对应的溶液中,c(CH3COOH)+c(CH3COO-)=x ml · L-1,B项正确。点③对应的混合溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可得c(Na+)=c(CH3COO-)=0.2 ml·L-1,溶液中c(CH3COOH)=(x-0.2) ml·L-1,则Ka=c(H+)·c(CH3COO-)c(CH3COOH)=10-7×0.2x-0.2=10-80.5x-0.1,C、D项错误。
12.[双横轴图像][2023辽宁鞍山监测]HM是一种一元弱酸,常温下,向20 mL 0.2 ml·L-1 HM溶液中逐滴加入浓度为0.2 ml·L-1的NaOH溶液,溶液中lgc(HM)c(M-)、pH、中和率(中和率=被中和的HM的物质的量反应前HM的总物质的量)的变化如图所示。下列说法错误的是( A )
A.a点时,c(HM)+c(M-)=2c(Na+)
B.溶液中水的电离程度:c点>b点
C.b点时,c(M-)>c(Na+)>c(H+)>c(OH-)
D.HM的电离常数为10-5.2
解析
课标要求
核心考点
五年考情
核心素养对接
认识水的电离,了解水的离子积常数,认识溶液的酸碱性及pH,掌握检测溶液pH的方法
水的电离和水的离子积
2022年6月浙江,T17;2020年7月浙江,T17;2020年1月浙江,T17
1.变化观念与平衡思想:建立微观粒子反应的平衡观,弱电解质以分子或离子形式在溶液中参与反应,这些反应有一定的速率和限度。
2.证据推理与模型认知:能记住水的离子积常数、pH与氢离子浓度的对应关系;能将溶液的酸碱性与pH、溶液中的微粒浓度联系起来;能基于电离平衡等预测溶液中的微粒种类与数量关系;能基于溶液中的离子反应和平衡,设计实验,解决问题;能利用溶液中的离子反应和平衡,创造性地解决实际问题
溶液的酸碱性与pH
2021重庆,T14;2020年7月浙江,T19
命题分析预测
1.结合酸碱中和滴定图像考查溶液的酸碱性判断、pH的计算、溶液中粒子浓度的大小比较等,其中水的离子积常数与弱电解质的电离常数的结合是难点;以酸碱中和滴定为载体,考查“强”滴“弱”过程中微粒浓度的变化及其他相关知识。
2.预计2025年高考选择题中仍会以图像为载体,结合水的离子积常数与弱酸或弱碱的电离常数进行命题,非选择题中利用滴定原理测定某物质的浓度及滴定操作出现的概率仍较大
pH
c(H+)/(ml·L-1)
c(H+)与c(OH-)的大小比较
酸性
<7
>10-7
c(H+)[1] > c(OH-)
中性
=7
=10-7
c(H+)[2] = c(OH-)
碱性
>7
<10-7
c(H+)[3] < c(OH-)
适用温度
25 ℃
任何温度
编号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
pH
11
11
3
3
相关教案
这是一份备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第1讲电离平衡(Word版附解析),共24页。
这是一份备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第4讲盐类水解(Word版附解析),共18页。
这是一份备战2025年高考化学精品教案第八章水溶液中的离子反应与平衡第7讲沉淀溶解平衡(Word版附解析),共18页。








