
陕西省榆林市2024-2025学年高三上学期第一次模拟检测(一模)化学试题
展开
这是一份陕西省榆林市2024-2025学年高三上学期第一次模拟检测(一模)化学试题,共21页。试卷主要包含了单选题,解答题,填空题等内容,欢迎下载使用。
一、单选题
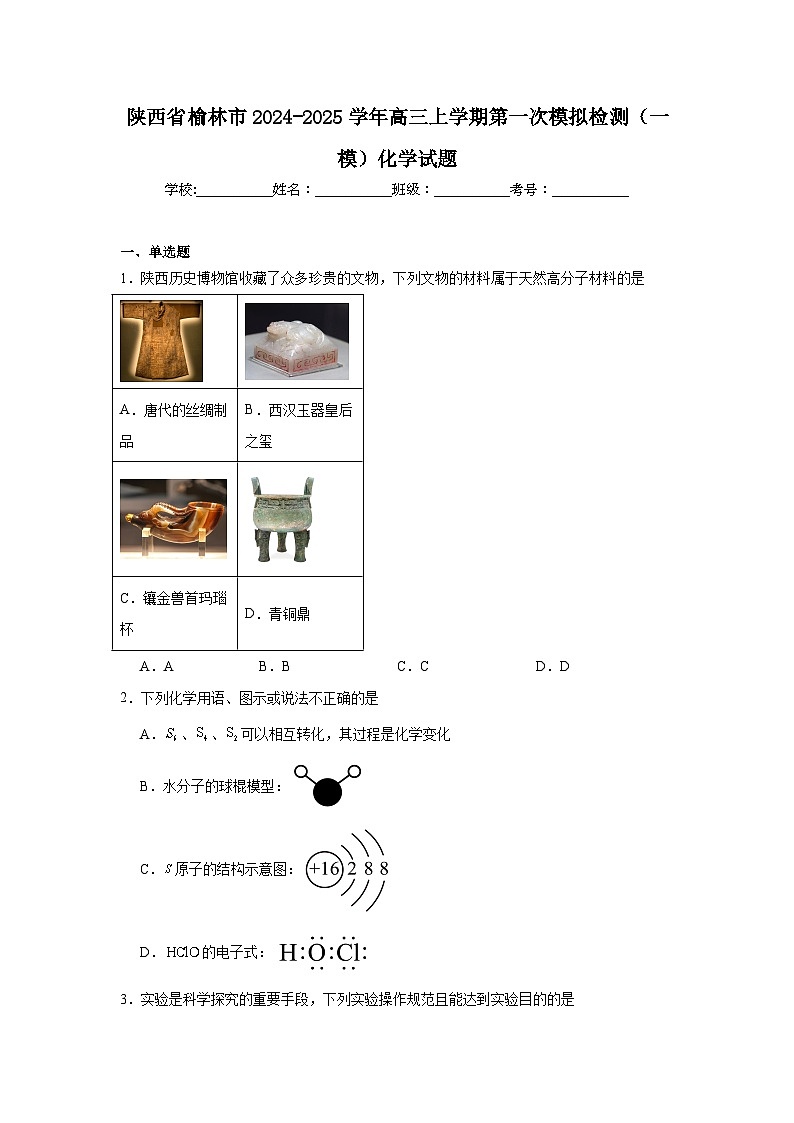
1.陕西历史博物馆收藏了众多珍贵的文物,下列文物的材料属于天然高分子材料的是
A.AB.BC.CD.D
2.下列化学用语、图示或说法不正确的是
A.、、可以相互转化,其过程是化学变化
B.水分子的球棍模型:
C.原子的结构示意图:
D.的电子式:
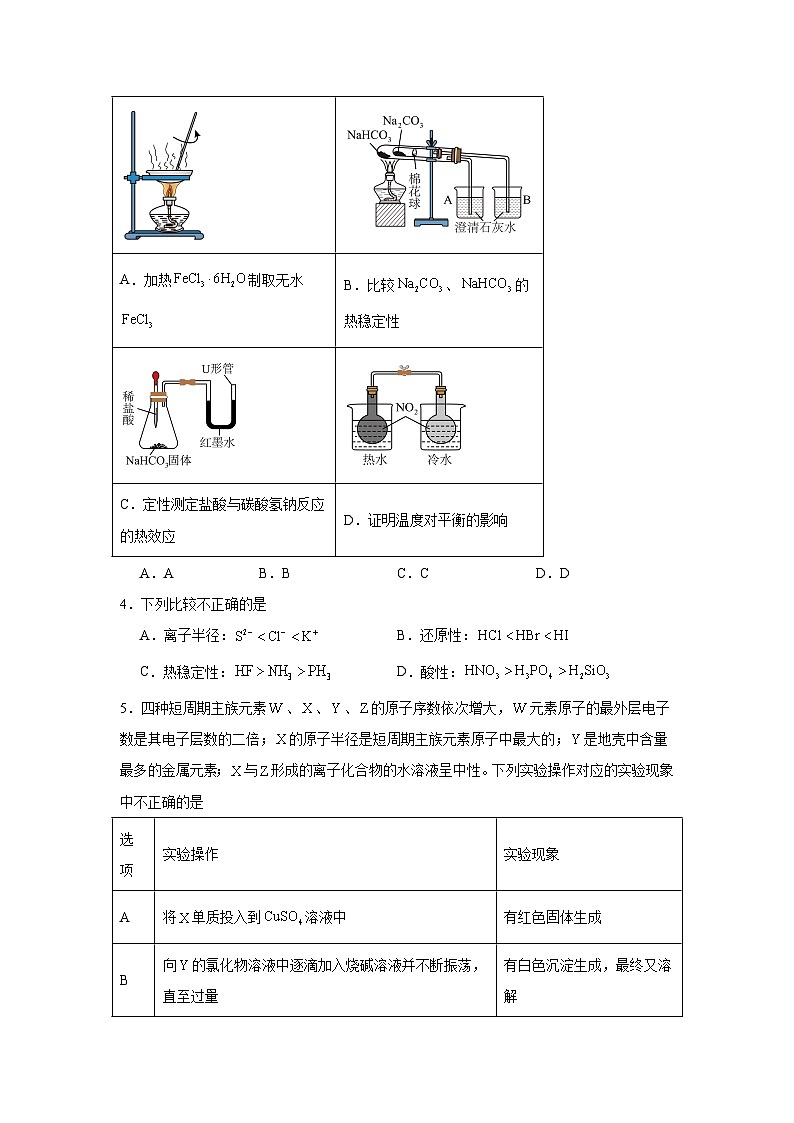
3.实验是科学探究的重要手段,下列实验操作规范且能达到实验目的的是
A.AB.BC.CD.D
4.下列比较不正确的是
A.离子半径:B.还原性:
C.热稳定性:D.酸性:
5.四种短周期主族元素、、、的原子序数依次增大,元素原子的最外层电子数是其电子层数的二倍;的原子半径是短周期主族元素原子中最大的;是地壳中含量最多的金属元素;与形成的离子化合物的水溶液呈中性。下列实验操作对应的实验现象中不正确的是
A.AB.BC.CD.D
6.以为原料,可以制备一系列的化工产品。设为阿伏加德罗常数的值,下列说法正确的是
A.常温下,中含有的极性键数目为
B.常温下,溶于中,、、的数目之和等于
C.时,的溶液中含有的数目为
D.与的反应中,每消耗,转移个电子
7.对于下列过程中发生的化学反应,相应离子方程式正确的是
A.用硫酸铜溶液除去电石气中的:
B.将通入84消毒液中(有效成分):
C.将铝屑与烧碱溶液混合放入管道,疏通管道:
D.用稀硝酸清洗试管壁上的银镜:
8.榆林市林草局为配合市政府提出办好“十件民生实事”之一的过敏性鼻炎的防治工作,实施乔灌木替代沙蒿类植物技术推广。沙蒿主要成分之一儿茶素的结构简式如图。下列有关儿茶素的说法不正确的是
A.分子中所有原子共平面B.能发生取代反应
C.水溶液呈弱酸性D.能使酸性高锰酸钾溶液褪色
9.下列操作不能达到相应检验目的的是
A.AB.BC.CD.D
10.新型太阳能氢气面板可以直接从空气中提取水、利用光电解水产生氢气,将氢气储存,可用于燃料电池。工作原理如图所示:
下列说法不正确的是
A.太阳能电池光伏板工作原理与硅原子电子跃迁有关
B.电解水的阳极反应是
C.燃料电池的正极反应是
D.燃料电池生成的水从负极一侧流场板层排出
11.陕西省镇安县重晶石矿(主要成分)分布广、储量大、品位高,某课题小组对重晶石矿研究开发了制备高纯纳米钛酸钡()工艺。部分流程如下:
下列说法不正确的是
A.酸化涉及的反应为
B.“系列操作”可为蒸发结晶、过滤、洗涤、干燥
C.钛酸四丁酯可以发生水解反应
D.“合成反应”中生成的反应是非氧化还原反应
12.用钌基催化剂催化和的反应过程如图所示。
当反应生成液态时放出的热量。下列说法正确的是
A.该反应的热化学方程式为
B.图示中物质Ⅱ为该反应的催化剂,物质Ⅲ为中间产物
C.使用催化剂可以降低反应的活化能,同时可以改变反应的焓变
D.反应历程中既有非极性键的断裂又有非极性键的形成
13.一定温度下,向容积一定的密闭容器中通入一定量的,在某催化剂表面上发生反应的方程式为: ,实验测得催化剂表面积变化时,的浓度与时间变化的关系如下表所示,下列说法正确的是
A.实验①,,
B.实验②,在时达到化学平衡状态
C.实验①、②说明,相同条件下增加催化剂的表面积,使反应速率增大
D.若将实验①的反应温度升高,该反应的平衡常数
14.稍过量零价铁与亚硫酸钠体系能有效降解废水中有机污染物活性红。
已知:
ⅰ.体系中产生的、和可将活性红氧化,其中具有强氧化性
ⅱ.、
ⅲ.开始沉淀时,完全沉淀时
开始沉淀时,完全沉淀时
下列说法不正确的是
A.由图1,时的为
B.时较时具有更好的降解效果
C.反应过程还原剂与氧化剂物质的量之比为
D.反应一段时间后零价铁表面会有产生,从而降低活性红的去除率
二、解答题
15.以银锰精矿(主要含、、)和软锰矿(主要含)为原料联合提取银和锰的一种流程示意图如下。
已知:
①酸性条件下,氧化性;
②极易溶于水;
③“浸锰”过程中矿石中的锰元素浸出,矿石中的银以的形式残留于浸锰渣中;
④“浸银”时,将中的银以形式浸出,硫元素被氧化为单质。
(1)矿石在酸浸前需粉碎,其目的是 。
(2)在溶液中,银锰精矿中的和软锰矿中的发生反应,则浸锰液中主要的金属阳离子有 ;检验“浸锰液”中是否含有的操作是 。
(3)用“浸锰液”获取的过程如下:
已知:开始沉淀,完全沉淀。
开始沉淀,完全沉淀。
①加氨水调应控制在 。
②“分离液”与饱和溶液反应的离子方程式为 。
(4)“浸银”时的离子方程式为 。
(5)解释“浸银”时加入氯化钙的作用 。
16.二氯化二硫(),沸点为,常温下是一种金黄色液体,广泛应用于化工领域。
已知的性质:
ⅰ.热稳定性较差;
ⅱ.能被氧化为(沸点为);
ⅲ.能与水发生剧烈反应:。
实验室制备。将氯气通入熔融硫黄(熔点为,沸点为)中反应制备。所用仪器(部分夹持、加热装置省略)如下图所示:
请回答下列问题:
(1)仪器的名称为 。
(2)装置A中、制备时反应的离子方程式为 。
(3)制备过程实验装置的连接顺序为A、 、C(填大写字母);C装置中所装碱石灰的作用有 。
(4)组装仪器后,检查装置气密性,加入药品;打开,向装置中通一段时间,目的是 ;再加热B装置至之间使硫黄熔融。
(5)观察到中出现金黄色液体时,可证明有生成。若实验产物中,经检验含有较多的,为提高产品纯度,减少的生成,可采取哪些措施 (任写一条即可)。
(6)测定样品的纯度(杂质不影响测定)。
称取样品于烧瓶中,加入足量的蒸馏水充分反应;用水蒸气将生成的和全部蒸出,并用足量的溶液充分吸收;然后向其中加入足量的溶液,过滤、洗涤、干燥、称量,得到固体。样品中的质量百分含量为 。
17.甲醇是重要的工业原料,制备技术是目前研究的热点。
(1)甲烷氧化制备甲醇是一种原子利用率高的方法。
已知下列反应的热化学方程式:
反应①
反应②
反应③
上述哪些反应的原子利用率达到了百分之百 (填序号“①”、“②”、“③”或多选);反应③若增大压强,平衡 (填“正向”、“逆向”或“不”)移动。
(2)电喷雾电离等方法得到的(、、等)与反应可得。与可以高选择性反应生成,体系的能量随反应进程的变化如下图所示:
①步骤Ⅰ是 过程(填“吸热”或“放热”)。
②写出与反应的总反应方程式: ;加快该反应速率的方法有 (写出一条即可)。
(3)光催化制甲醇技术是目前的研究热点。下图所示,铜基纳米光催化材料还原的机理为:光照时,低能价带失去电子并产生空穴(具有强氧化性)。
①太阳光激发下,在导带和价带中除了产生电子和空穴外,还会生成 (填写微粒名称)参与的还原。
②光催化原理与电解原理类似,写出高能导带的反应式: 。
三、填空题
18.阿司匹林()具有解热、镇痛、抗炎等多种药理作用。阿司匹林由水杨酸()和乙酸酐()在,浓硫酸催化下反应制得。
请根据题意完成下列填空:
(1)阿司匹林中官能团的名称是 。
(2)合成阿司匹林的化学反应方程式是 ;其反应类型是 。
(3)检测阿司匹林固体样品中是否含水杨酸的方法是 。
(4)水杨酸最多消耗 碳酸氢钠。
(5)能同时满足下列条件的水杨酸的同分异构体共有 种;
①分子中有苯环
②苯环上的一硝基取代物有两种
③能与银氨溶液发生反应生成银镜
写出符合以上要求的所有物质的结构简式: 。
A.唐代的丝绸制品
B.西汉玉器皇后之玺
C.镶金兽首玛瑙杯
D.青铜鼎
A.加热制取无水
B.比较、的热稳定性
C.定性测定盐酸与碳酸氢钠反应的热效应
D.证明温度对平衡的影响
选项
实验操作
实验现象
A
将单质投入到溶液中
有红色固体生成
B
向的氯化物溶液中逐滴加入烧碱溶液并不断振荡,直至过量
有白色沉淀生成,最终又溶解
C
将的单质通入到溶液中
溶液变为黄色
D
将的最高价氧化物通入到溶液中
有白色胶状物质生成
选项
检验目的
操作
现象
A
食盐中的钠元素
用洁净的铂丝在酒精灯上灼烧至无色,再蘸取食盐溶液,进行焰色试验
产生黄色火焰
B
尿液中含有葡萄糖等还原性糖
将少量尿液滴入新制氢氧化铜、加热
产生砖红色沉淀
C
鸡蛋蛋清液中含有蛋白质
取少量蛋清液,滴几滴浓硝酸
蛋清液变黄
D
洁厕灵中含有
取洁厕灵适量加入粉末
产生大量气泡
编号
表面积
0
20
40
60
80
①
②
参考答案:
1.A
【详解】A.丝绸主要成分为蛋白质,属于天然高分子化合物,因此丝绸是一种天然高分子材料,故A符合题意;
B.西汉皇后之玺是西汉玉器,主要成分是硅酸盐,属于硅酸盐材料,故B不符合题意;
C.玛瑙的主要成分是二氧化硅,镶嵌的为金单质,因此不属于天然高分子材料,故C不符合题意;
D.青铜为铜合金,属于合金,属于金属材料,故D不符合题意;
故答案选A。
2.C
【详解】A.有新物质生成的变化属于化学变化,S6、S4、S2相互转化的过程中有新物质生成,所以其过程是化学变化,A正确;
B.水分子的球棍模型呈V形或角形,B正确;
C.S原子的结构示意图:,C错误;
D.HClO 的电子式:,D正确;
故选C。
3.D
【详解】A.在加热过程中会水解生成氢氧化铁,得不到无水,应在氯化氢气体氛围下加热,A错误;
B.受热分解生成碳酸钠、二氧化碳和水,二氧化碳气体能使澄清石灰水变浑浊,为了比较、的热稳定性,应放在温度较高的大试管中,应放在温度较低的小试管中,B错误;
C.盐酸与碳酸氢钠反应是吸热反应,温度降低使压强减小,U形管的液面左高右低,同时反应生成二氧化碳气体,会使U形管的液面左低右高,因此无法通过观察U形管中红墨水的液面差,定性测定盐酸与碳酸氢钠反应的热效应,C错误;
D.在圆底烧瓶中存在平衡:∆H<0,在热水中即升高温度,平衡逆向移动,颜色加深,在冷水中即降低温度,平衡正向移动,颜色变浅,能证明温度对平衡的影响,能达到实验目的,D正确;
故选D。
4.A
【详解】A.核外电子层数越多则离子半径越大,电子层结构相同的离子,核电荷数越大半径越小,故离子半径:,故A错误;
B.同主族从上到下,元素的非金属逐渐减弱,因此阴离子的还原性逐渐增强,故还原性:,故B正确;
C.同主族从上到下,非金属的气态氢化物的热稳定性逐渐减弱,热稳定性:,故C正确;
D.同周期从左到右,元素的非金属逐渐增强,同主族从上到下,元素的非金属逐渐减弱,非金属性越强则最高价含氧酸的酸性越强,非金属性:,故酸性:,故D正确;
故答案选A。
5.A
【分析】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W元素的最外层电子数是其电子层数的二倍,W是C元素,X的原子半径是短周期主族元素原子中最大的,X是Na元素,Y是地壳中含量最多的金属元素,Y是Al元素,X与Z形成的离子化合物的水溶液呈中性,则Z为Cl元素,由此分析回答。
【详解】A.将单质钠投入到CuSO4溶液中,钠先和水反应生成NaOH和氢气,NaOH和CuSO4反应生成Cu(OH)2蓝色沉淀,钠不能置换出单质铜,所以无大量红色固体生成,A错误;
B.当向氯化铝溶液中逐滴加入烧碱溶液时,首先发生反应生成氯化钠和氢氧化铝,氢氧化铝为白色沉淀,继续滴加氢氧化钠溶液至过量时,氢氧化铝沉淀会溶解,生成偏铝酸钠,B正确;
C.将氯气通入到NaBr溶液中,发生反应生成氯化钠和溴单质,生成的单质溴使溶液变为黄色,C正确;
D.将CO2通入到Na2SiO3溶液中,发生反应生成碳酸钠和硅酸,生成的硅酸为白色沉淀,D正确;
故选A。
6.A
【详解】A.,HCl含有的是H-Cl极性键,即中含有的2mlH-Cl极性键,即含有的极性键数目为,故A正确;
B.氯气并不能完全溶于水中,且与水的反应为可逆反应,因此还存在有大量的氯气分子,故B错误;
C.未说明溶液的体积,无法通过浓度计算出的数目,故C错误;
D.根据图中信息可知,与的反应为:,发生的是歧化反应,即氯元素的化合价既有升高也有降低,则每消耗,转移个电子,故D错误;
故答案选A。
7.C
【详解】A.硫化氢为弱电解质,不能拆开,反应的离子方程式为:,故A错误;
B.次氯酸钠具有强氧化性,将二氧化硫氧化为硫酸根,因此反应的离子方程式为:,故B错误;
C.铝屑与烧碱溶液反应生成Na[Al(OH)4]和氢气,离子方程式为:,故C正确;
D.试管壁上的银镜用稀硝酸清洗:,故D错误;
故答案选C。
8.A
【详解】A.甲烷为正四面体结构,分子中存在结构,故分子中所有原子不可能共平面,A错误;
B.分子中存在苯环、醇羟基,可以发生取代反应,B正确;
C.分子中含有酚羟基,其主要的化学性质在于它的弱酸性,因此该物质的水溶液会呈弱酸性,C正确;
D.分子中含有羟基,能使酸性高锰酸钾溶液褪色,D正确;
故选A。
9.D
【详解】A.钠的焰色是黄色,取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取食盐溶液,进行焰色试验,若产生黄色火焰,证明食盐中的钠元素,A正确;
B.葡萄糖具有还原性,能与新制的氢氧化铜共热产生砖红色沉淀,故可以用此方法检验尿液中是否含有葡萄糖等还原性糖,B正确;
C.蛋白质遇浓硝酸发生显色反应,出现黄色,故可用此方法检验鸡蛋蛋清液中是否含有蛋白质,C正确;
D.取洁厕灵适量加入粉末,产生大量气泡,证明洁厕灵中含有比碳酸酸性更强的物质,但不能证明该酸是HCl,D错误;
故选D。
10.D
【分析】电解水时,阴极上水提供的氢离子得到电子发生还原反应,阳极上水通过的氢氧根离子失去电子发生氧化反应;燃料电池中,通入氢气的一极为负极、发生氧化反应,通入氧气的一极为正极、发生还原反应;
【详解】A.太阳能电池光伏板工作原理主要是光电效应,与硅原子电子跃迁有关,A正确;
B.据分析,电解水的阳极产生氧气,电极反应式是,B正确;
C.燃料电池的正极上氧气被还原,氢离子参与下,得电极反应式是,C正确;
D.图2中负极方程式为H2-2e-=2H+,,结合选项C,燃料电池生成的水从正极一侧流场板层排出,D不正确;
选D。
11.B
【分析】重晶石矿经一系列转化得到BaS溶液,BaS溶液中加入稀盐酸酸化得到BaCl2和H2S气体,然后向溶液中加入过量NaOH经一系列操作得到Ba(OH)2•8H2O,溶液1中含有NaCl和过量的NaOH,Ba(OH)2•8H2O溶解后加入Ti(OC4H9)4得到BaTiO3粗产品,然后通过洗涤得到BaTiO3。
【详解】A.酸化步骤中BaS溶液加入稀盐酸酸化得到BaCl2和H2S气体,反应的离子方程式为,A正确;
B.从溶液中获取晶体,采用蒸发浓缩至有晶膜出现时停止加热、冷却结晶、过滤、洗涤、干燥的方法,所以“系列操作”可为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,B错误;
C.钛酸四丁酯含有酯基,在NaOH溶液或浓硫酸作用下发生水解反应,C正确;
D.“合成反应”中生成的没有电子转移,所以不是氧化还原反应,D正确;
故选B。
12.A
【详解】A.该图为钌(Ru)基催化剂催化CO2(g)和H2(g)的反应示意图,反应生成92g液态HCOOH时放出62.4kJ的热量,2ml CO2(g)和2ml H2(g)时反应生成92g (2ml)液态HCOOH放出62.4kJ的热量,则热化学方程式为CO2(g)+H2(g) =HCOOH(l) ΔH=-31.2kJ/ml-1,A正确;
B.物质I为反应起点存在的物质,且在整个过程中量未发生改变,物质I为催化剂,物质Ⅱ、Ⅲ为中间过程出现的物质,为中间产物,B错误;
C.催化剂可以降低反应的活化能,但不能改变反应的焓变,C错误;
D.由反应示意图可知反应过程中不存在非极性键的形成,D错误;
故选A。
13.C
【详解】A.实验①,由表格中数据可知,,平均反应速率,故A错误;
B.根据表格中的数据可知,实验②,60min时A浓度为的1.9ml/L,80min时A浓度为1.8ml/L,A的浓度不变时说明达到平衡状态,但此变化并不能说明A的浓度不再改变,因此不能说明在80min时达到化学平衡状态,故B错误;
C.实验①,催化剂表面积为,根据表格中数据可知,,,实验②,催化剂表面积为,根据表格中数据可知,,,可知相同条件下增加催化剂的表面积,使反应速率增大,故C正确;
D.根据表格的数据可知,实验①中60min、80min时A的浓度均为0.8ml/L,说明60min时反应已经达到平衡,列出三段式为:
上述条件下该反应的平衡常数,该反应为放热反应,升高温度,平衡逆向移动,因此,故D错误;
故答案选C。
14.C
【详解】A.由图1,当c()=c()时,pH=7.22,则,,故A正确;
B.由图2可知,转化为,根据题意可知,可以降解废水中有机污染物活性红,pH=4时的浓度高于pH=8时的浓度,具有更好的降解效果,故B正确;
C.由图2可知,的反应中,铁元素的化合价从+2价升高到+3价,,因此反应为,作为还原剂,O2作为氧化剂,因此还原剂与氧化剂物质的量之比为4:1,故C错误;
D.反应一段时间后,零价铁表面产生,具有还原性,可以和反应生成和,从而除去,故D正确;
故答案选C。
15.(1)增大接触面积,加快反应速率,使其充分反应
(2) 、 取少量浸锰液于试管中,滴加铁氰化钾溶液,若有蓝色沉淀产生,说明含有,反之则无
(3) (或)
(4)
(5)增大浓度有利于难溶溶解,生成,提高浸出率
【分析】“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,由于酸性条件下,氧化性,可知“浸锰”过程同时去除FeS2,发生反应主要为,矿石中的银以Ag2S的形式残留于浸锰渣中,“浸银”时加入FeCl3溶液将Ag2S转化为形式浸出,反应为:,“沉银”过程中可以用铁粉作为还原剂,可将还原为单质银;
“浸锰液”中所含主要溶质为硫酸锰、硫酸铁,加入氨水调节pH主要是为了除去Fe3+,使其转化为氢氧化铁沉淀,过滤后,得到硫酸锰溶液,加入饱和碳酸氢铵溶液沉锰,过滤后向其中加入硫酸,最后得到较为纯净的硫酸锰溶液。
【详解】(1)矿石在酸浸前需粉碎,其目的是:增大接触面积,加快反应速率,使其充分反应。
(2)根据分析可知,在溶液中,银锰精矿中的和软锰矿中的发生反应,MnO2为氧化剂被还原为,FeS2被氧化为溶于水的Fe3+和硫酸根,则该反应的离子方程式为:,则浸锰液中主要的金属阳离子有:、;
由于浸锰液中含有,避免的干扰可知,检验“浸锰液”中是否含有的操作是:取少量浸锰液于试管中,滴加铁氰化钾溶液,若有蓝色沉淀产生,说明含有,反之则无。
(3)①调节pH主要是为了除去Fe3+,因此加氨水调应控制在:(或);
②“分离液”中主要为硫酸锰,与饱和溶液反应后产生碳酸锰沉淀,离子方程式为:。
(4)“浸银”时,将中的银以形式浸出,硫元素被氧化为单质S,反应为:。
(5)“浸银”时,反应为:,加入氯化钙的作用为:增大浓度有利于难溶溶解,生成,提高浸出率。
16.(1)球形干燥管
(2)
(3) E、D、B、F 吸收未反应的氯气,防止污染空气,同时吸收空气中的水蒸气,防止其进入装置,与反应
(4)排出装置内的空气,防止氧气与熔融的硫反应
(5)减慢分液漏斗中浓盐酸滴加速度(或打开K1通入适量N2等)
(6)
【分析】由实验装置图可知,装置A中二氧化锰与浓盐酸共热反应制备氯气,浓盐酸具有挥发性,制得的氯气中混有氯化氢和水蒸气,装置E中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,装置B中氯气与硫共热反应制备二氯化二硫,装置F用于冷凝收集二氯化二硫,装置C中盛有的碱石灰用于吸收未反应的氯气,防止污染空气,同时防止空气中的水蒸气进入装置F,使二氯化二硫水解,则装置的连接顺序为AEDBFC。据此分析作答。
【详解】(1)仪器的名称为球形干燥管。答案为:球形干燥管。
(2)浓盐酸与二氧化锰加热反应制取氯气,离子方程式为:。答案为:。
(3)装置E中盛有的饱和食盐水用于除去氯化氢气体,装置D中盛有的浓硫酸用于干燥氯气,装置B中氯气与硫共热反应制备二氯化二硫,装置F用于冷凝收集二氯化二硫,装置C中盛有的碱石灰用于吸收未反应的氯气,防止污染空气,同时防止空气中的水蒸气进入装置F,使二氯化二硫水解,则装置的连接顺序为A、E、D、B、F、C。答案为:E、D、B、F;吸收未反应的氯气,防止污染空气,同时吸收空气中的水蒸气,防止其进入装置,与反应。
(4)高温下,硫容易和氧气发生反应,为了排尽装置内空气,所以要先通入氮气。答案为:排出装置内的空气,防止氧气与熔融的硫反应。
(5)二氯化二硫能被氯气氧化为SCl2,为提高产品纯度,应减小氯气的量,故可调节A中分液漏斗活塞,控制液体滴加速度,控制氯气的生成速率,可以减少的生成,或通入一定量的氮气,对氯气的浓度进行稀释,也可以起到相同的作用。答案为:减慢分液漏斗中浓盐酸滴加速度(或打开K1通入适量N2等)。
(6)根据反应、H2O2+SO2=H2SO4、H2SO4+BaCl2=BaSO4↓+2HCl,可得出反应关系式为:,则样品中二氯化二硫的含量为:。答案为:。
17.(1) ①② 正向
(2) 放热 升温;加入催化剂等
(3) 氢离子
【详解】(1)根据盖斯定律可知,该反应③=,得,可得;
原子利用率百分之百,是指反应中反应物中的原子完全转化成了生成物,可知反应①②均是原子利用率百分之百;
反应③的正反应方向为气体分子数减少的反应,增大压强则朝气体分子减少的方向进行,即反应向正反应方向进行。
(2)①步骤Ⅰ中的反应物的能量比生成的能量高,因此该反应为放热过程;
②根据反应进程可知,与反应最终产生甲醇和M+,总反应方程式:;
加快该反应速率的方法有:升温;加入催化剂等(任写一种)。
(3)①光照时,低能价带失去电子并产生空穴(,具有强氧化性),相当于电解池的阳极,结合图知,在低能价带上,H2O直接转化为O2的电极反应式为:2H2O+4h+=O2+4H+,反应生成氢离子可参与高能带上的还原再生;
②已知光催化原理与电解原理类似,由图可知,高能导带的电极反应为:二氧化碳得电子发生还原反应得到甲醇,由此可知其电极反应式为:。
18.(1)羧基、酯基
(2) 取代反应
(3)取少量阿司匹林样品,研磨,加水溶解,向其中滴加1~2滴FeCl3溶液,若溶液变为紫色,则阿司匹林中含有水杨酸,反之则无
(4)1
(5) 3 、、
【详解】(1)根据阿司匹林的结构简式,可知阿司匹林中官能团的名称是羧基、酯基;
(2)
水杨酸和乙酸酐发生取代反应生成阿司匹林和乙酸,反应的化学反应方程式是;其反应类型是取代反应。
(3)水杨酸中含有酚羟基,酚羟基遇FeCl3发生显色反应,检测阿司匹林固体样品中是否含水杨酸的方法是:取少量阿司匹林样品,研磨,加水溶解,向其中滴加1~2滴FeCl3溶液,若溶液变为紫色,则阿司匹林中含有水杨酸,反之则无。
(4)羧基可与碳酸氢钠反应,酚羟基和碳酸氢钠不反应,水杨酸最多消耗1碳酸氢钠。
(5)
①分子中有苯环;②苯环上的一硝基取代物有2种,说明结构对称;③能跟银氨溶液反应生成银镜,则含-CHO或HCOO-,则符合条件的水杨酸的同分异构体有、、,共3种。
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
D
A
A
A
C
A
D
D
题号
11
12
13
14
答案
B
A
C
C
相关试卷
这是一份2025届陕西榆林高三上学期第一次模拟检测(一模)化学试题(含答案),共5页。
这是一份陕西省安康市2024-2025学年高三上学期第一次质量联考(一模)化学试题,文件包含陕西省安康市2024-2025学年高三上学期第一次质量联考一模化学试题pdf、化学参考答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。
这是一份陕西省榆林市2025届高三年级第一次模拟检测一模化学试卷含答案,共10页。试卷主要包含了11,5 Ba 137,1 NA等内容,欢迎下载使用。









