

2025届高考化学二轮复习:专题十五 化学实验综合 教案
展开
这是一份2025届高考化学二轮复习:专题十五 化学实验综合 教案,共26页。教案主要包含了解题技巧,真题链接等内容,欢迎下载使用。
【解题技巧】
1.读题需认真,找出探究内容
答题时一定要通读全题,找出需要探究的问题,这样才能做到心里有数,避免答题的盲目性。
2.审题应仔细,提取有用信息
在认真通读全题的前提下,一定要仔细审题,找出题中的关键字、词、重要现象,提炼出有用的信息,为顺利作答奠定基础。
3.敢于大胆猜想,联想相关反应原理
实验探究题中的探究内容可能是教科书之外没学的内容,解答时,要善于发现材料中的问题,结合题目和已有知识进行大胆猜想,并结合猜想的理由或依据进行推断,从有用信息中提炼出规律和原理,看牵涉到已学过的哪些化学知识,再将其迁移到未知的问题在推断过程中发觉行不通时,再果断改变思路和方向,并找出原因。
这就要求学生从给的信息中获取有用的信息。
【真题链接】
1.[2024年湖北高考真题]碱金属的液氨溶液含有的蓝色溶剂化电子是强还原剂。锂与液氨反应的装置如图(夹持装置略)。下列说法错误的是( )
A.碱石灰有利于逸出
B.锂片必须打磨出新鲜表面
C.干燥管中均可选用
D.双口烧瓶中发生的变化是
2.[2024年湖南高考真题]某学生按图示方法进行实验,观察到以下实验现象:
①铜丝表面缓慢放出气泡,锥形瓶内气体呈红棕色;
②铜丝表面气泡释放速度逐渐加快,气体颜色逐渐变深;
③一段时间后气体颜色逐渐变浅,至几乎无色;
④锥形瓶中液面下降,长颈漏斗中液面上升,最终铜丝与液面脱离接触,反应停止。
下列说法正确的是( )
A.开始阶段铜丝表面气泡释放速度缓慢,原因是铜丝在稀中表面钝化
B.锥形瓶内出现了红棕色气体,表明铜和稀反应生成了
C.红棕色逐渐变浅的主要原因是
D.铜丝与液面脱离接触,反应停止,原因是硝酸消耗完全
3.[2024年全国高考真题]实验室中利用下图装置验证铁与水蒸气反应。下列说法错误的是( )
A.反应为
B.酒精灯移至湿棉花下方实验效果更好
C.用木柴点燃肥皂泡检验生成的氢气
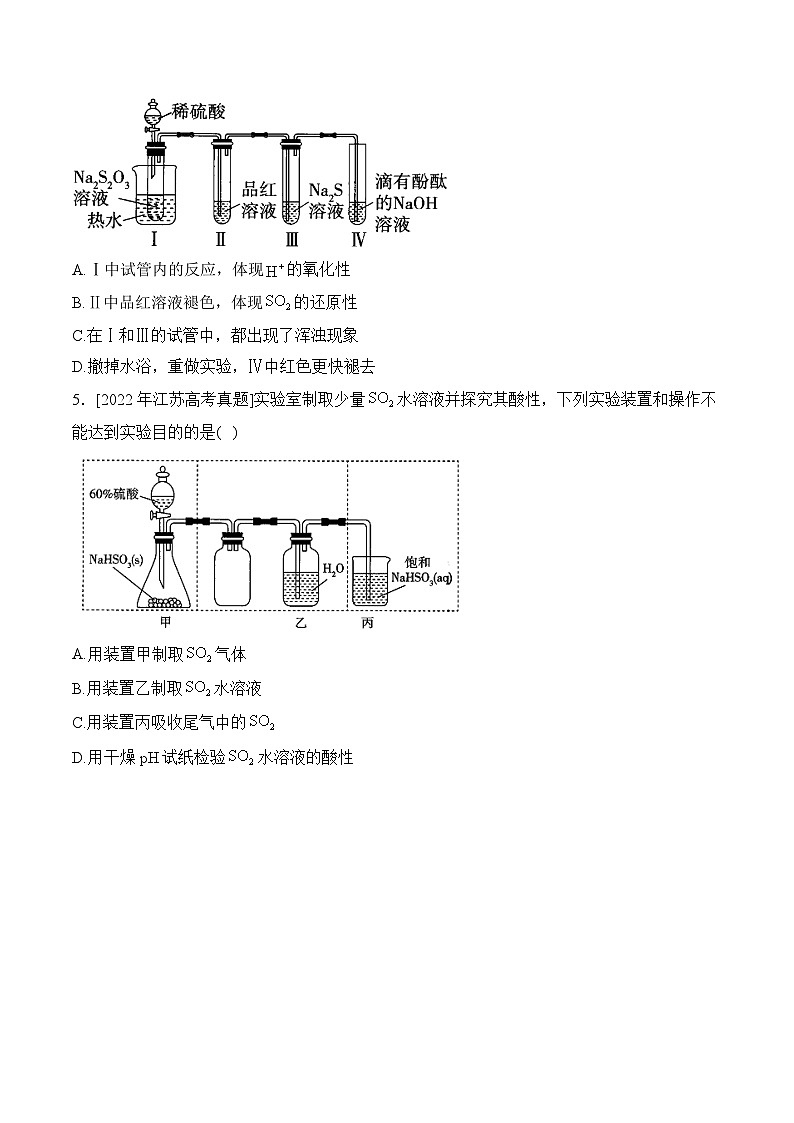
D.使用硬质玻璃试管盛装还原铁粉4.[2023年广东高考真题]按如图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )
A.Ⅰ中试管内的反应,体现的氧化性
B.Ⅱ中品红溶液褪色,体现的还原性
C.在Ⅰ和Ⅲ的试管中,都出现了浑浊现象
D.撤掉水浴,重做实验,Ⅳ中红色更快褪去
5.[2022年江苏高考真题]实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是( )
A.用装置甲制取气体
B.用装置乙制取水溶液
C.用装置丙吸收尾气中的
D.用干燥pH试纸检验水溶液的酸性
参考答案
1.答案:C
解析:A.碱石灰为生石灰和氢氧化钠的混合物,可以吸收浓氨水中的水分,同时吸水过程大量放热,有利于逸出,A正确;
B.锂片表面有Li2O,Li2O会阻碍Li和液氨的接触,所以必须打磨出新鲜表面,B正确;
C.第一个干燥管目的是干燥氨气,为酸性干燥剂能与氨气反应,所以不能用,而装置末端的干燥管作用为吸收过量的氨气,可用,C错误;
D.双口烧瓶中发生的变化是,D正确;
故选C。
2.答案:C
解析:金属铜与稀硝酸不会产生钝化。开始反应速率较慢,可能的原因是铜表面有氧化铜,A说法错误;由于装置内有空气,铜和稀反应生成的NO迅速被氧气氧化为红棕色的,产生的浓度逐渐增加,气体颜色逐渐变深,B说法错误;装置内氧气逐渐被消耗,生成的量逐渐达到最大值,同时装置内的能与溶液中的反应,气体颜色变浅,C说法正确;由于该装置为密闭体系,生成的NO无法排出,逐渐将锥形瓶内液体压入长颈漏斗,铜丝与液面脱离接触,反应停止,D说法错误。
3.答案:B
解析:铁与水蒸气在高温下反应生成和,A正确;铁与水蒸气反应需在高温下进行,将酒精灯移至湿棉花下方,铁粉处不能产生高温,B错误;反应生成的氢气可吹出肥皂泡,用火柴点燃肥皂泡,可听到尖锐的爆鸣声,C正确;由于反应需在高温条件下进行,故需使用耐高温的硬质玻璃试管盛装还原铁粉,D正确。
4.答案:C
解析:实验剖析
Ⅰ中试管内发生反应,该反应中只有中硫元素的化合价发生变化,硫酸只体现酸性,没有体现氧化性,A错误;二氧化硫使品红溶液褪色,体现的漂白性,B错误;由上述分析可知,Ⅰ和Ⅲ中都反应生成硫沉淀,都会出现浑浊,C正确;升高温度能加快反应速率,撤掉水浴,重做实验,温度降低,反应速率减慢,生成二氧化硫的速率减慢,Ⅳ中红色褪去减慢,D错误。
5.答案:C
解析:60%硫酸与反应可得气体,A正确;通入水中形成的水溶液,B正确;在饱和溶液中的溶解度很小,C错误;测定溶液的酸碱性时,用玻璃棒蘸取待测液点到干燥的pH试纸上,观察试纸颜色的变化,D正确。
重难突破
1.药物贝诺酯有消炎、镇痛、解热的作用,在实验室依据酯化反应原理和以下装置(夹持和水浴加热装置略)制备贝诺酯(沸点),实验中利用环己烷与水的共沸体系(沸点)带出水分。已知体系中沸点最低的有机物是环已烷(沸点)。下列说法正确的是( )
A.反应时水浴温度不能高于
B.根据环己烷带出水的体积可推测出反应的限度和速率
C.因为蒸出的是共沸体系,故锥形瓶中不会出现分层现象
D.贝诺酯可以用氢氧化钠除去其中混杂的有机酸
2.某同学设计下列装置制备少量(沸点为128.7℃,能与水、乙醇以任意比混溶)。下列说法正确的是( )
A.配制乙醇与浓硫酸混合液的方法是:在不断搅拌下向浓硫酸中加入乙醇
B.装置b中可盛放酸性溶液以除去杂质
C.装置c中发生的反应为
D.最后用分液的方法从装置c中分离出
3.实验室制备硝基苯的原理是在50~60 ℃时,苯与浓硝酸在浓硫酸作用下发生反应:。实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
A.水浴加热的优点是使反应物受热均匀、容易控制温度
B.反应后,可用仪器a、b蒸馏得到产品
C.硝基苯有苦杏仁气味,密度比水的大
D.将浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至50 ℃以下,在不断振荡下逐滴加入少量苯
4.二氧化氯()是国际上公认的安全、无毒的绿色消毒剂。它是一种有刺激性气味的气体,熔点为-59.5℃,沸点为10.0℃,易溶于水且几乎不与冷水反应,气体浓度过高时易发生分解引起爆炸,制备二氧化氯溶液的装置如图所示:
下列说法错误的是( )
A.实验中通入空气的作用之一是稀释
B.装置②作安全瓶
C.装置①中发生的反应中氧化剂与还原剂的物质的量之比为1:2
D.当看到装置③中导管内液面上升时,应增大空气的通入速度
5.是中学非常重要的一种试剂,制备方法有很多,碱熔氧化法是其中一种常用方法。具体制备过程如下:
医
①将和KOH置于坩埚中加热熔融,多次加入适量粉末,加强热5分钟,充分反应后冷却,将固体捣碎,加水溶解,微热,趁热减压过滤得到溶液;
②将溶液转移到图示三颈烧瓶中,通入,使发生歧化反应:。
下列说法错误的是( )
A.熔融时不能用瓷坩埚,可用铁坩埚
B.步骤①中与KOH的质量之比理论上应该是87:112
C.开始时应打开旋塞1、2、4,关闭旋塞3、5,通入后,未被反应的会被收集到气囊a中
D.重复使用气囊a中的操作:关闭旋塞1、3,打开旋塞2、5,轻轻挤压气囊a,将气体压入溶液中继续反应
6.用如图装置探究和在NaOH溶液中的反应。通入适当比例的和,发生的化学反应为。下列叙述正确的是( )
A.实验室中可用Cu与1的硝酸制备二氧化氮气体
B.装置II中的玻璃管起到平衡气压作用,可将多余气体直接排出
C.由该反应可知氧化性顺序:
D.通过观察装置I、III中的气泡的快慢控制和的通入量
7.亚硝酰硫酸()主要用于重氮化反应。在实验室中,将二氧化硫通入到浓硫酸和浓硝酸的混合液中,在低于条件下发生氧化还原反应制备少量(硝酸被还原,二氧化硫被氧化,夹持装置略)。已知:遇水分解,溶于浓硫酸不分解。下列说法错误的是( )
A.导管a的作用是平衡气压,保证液体顺利滴下
B.装置B中多孔球泡的作用为增大反应物接触面积,使反应更充分
C.装置C中溶液因吸收挥发出的而褪色,原理是具有漂白性
D.该实验装置可能导致的产率偏低
8.利用以下装置制备、纯化CO,并探究CO和的反应()。下列说法正确的是( )
A.装置b中的试剂可选用无水
B.装置d中的试剂可选用NaOH溶液
C.实验开始时,依次点燃装置a、c处酒精灯
D.加热一段时间后,硬质玻璃管中粉末由白色变为淡黄色
9.四氯化钛()极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如图装置(部分加热和夹持装置省略),用、炭粉与制备。下列说法不正确的是( )
A.②中应盛装饱和食盐水
B.冷凝管有冷凝、回流和导气的作用
C.反应结束时,应先停止③处的加热,后停止①处的加热
D.该设计存在不足,如④⑤之间缺少防止水蒸气进入④的装置
10.三氯化碘()在药物合成中用途广泛,其熔点为33 ℃,沸点为73 ℃,氯气与碘单质需在温度稍低于70 ℃下反应制备,实验室制备装置如图所示(夹持装置省略)。下列说法不正确的是( )
A.仪器a中的药品为二氧化锰
B.装置B的作用是除杂,也作安全瓶,能监测实验进行时装置C中是否发生堵塞
C.装置C中的硅胶用于吸收水,干燥氯气
D.装置D最恰当的加热方式是用水浴加热
11.如图所示为“双色双喷泉”实验装置,图中烧瓶Ⅰ、Ⅱ中分别充满氨气和氯化氢,烧杯内盛装滴有紫色石蕊试液的蒸馏水。下列说法错误的是( )
A.在实验室中,可用浓氨水和生石灰制备氨气,用浓盐酸和浓硫酸制备氯化氢
B.在实验室中制备干燥的氨气时,可以选用碱石灰作干燥剂
C.实验中同时打开止水夹a、c、d,即可在烧瓶Ⅰ、Ⅱ中分别形成蓝色和红色喷泉
D.喷泉结束后,将烧瓶内溶液混合后转移至蒸发皿中蒸干,可得氯化铵固体
12.常作有机合成的催化剂,易潮解,升华温度为178℃。某化学活动小组用下列装置制备无水,下列说法正确的是( )
A.上述实验方案只存在1处错误
B.反应开始时,先点燃④的酒精灯,再启动①中反应
C.装置②和装置③的位置不能互换
D.含有的浓盐酸与足量的反应生成
13.乙炔()和乙烯的化学性质相似,可用如图所示装置制备乙炔气体,发生反应:,并验证其化学性质。下列说法正确的是( )
A.若Ⅰ中增加加热装置,Ⅵ中导管口冒出的黑烟变少
B.Ⅱ中有黑色沉淀生成
C.Ⅲ、Ⅳ中溶液均褪色,说明乙炔具有漂白性
D.Ⅴ中溶液变浑浊,说明Ⅰ中有生成
14.“消洗灵”常应用于医院床上用品的洗涤消毒,其化学组成可以表示为。实验室制备的装置如图所示,反应时可观察到C装置中三颈烧瓶内有晶体析出(夹持装置略)。
下列说法正确的是( )
A.试剂X为浓硫酸
B.多孔球泡的作用是防倒吸
C.C中与按物质的量之比1:2混合时的总反应化学方程式为
D.冰水的作用之一是降低温度,使产物充分析出
15.利用如图装置制备,并以为原料制备。已知:高于60℃时,分解生成和NaCl。下列说法错误的是( )
A.和均作还原剂
B.装置②,④的作用分别是防倒吸、吸收未反应的污染气体
C.从装置④反应后的溶液中获得晶体,可采用常压蒸发结晶
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中
16.苯胺为无色油状液体,沸点为184 ℃,易被氧化,有碱性,与酸反应生成盐。实验室利用如下装置(夹持及加热装置略)制备苯胺,其原理为。制备反应结束后,关闭止水夹K,加入生石灰,调整好温度计的位置,继续加热,收集182~186 ℃的馏分,得到较纯苯胺。下列说法错误的是( )
A.反应前,应先通一段时间再加热
B.该加热方式不能为水浴加热
C.生石灰可以用代替
D.蒸馏时,为防止冷凝管炸裂,应更换为空气冷凝管
17.已知:在加热条件下,烯烃可由卤代烃在NaOH醇溶液中发生反应生成。下列有关1-丁烯的制备、净化、收集、性质验证的装置不能达到实验目的的是( )
A.用装置甲制备1-丁烯
B.用装置乙除去1-丁烯中混有的乙醇蒸气
C.用装置丙收集1-丁烯
D.用装置丁验证1-丁烯与酸性溶液反应
18.高纯单晶硅是重要的半导体材料,在各种集成电路、芯片和CPU的制作中有不可替代的作用。实验室中模拟制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是( )(已知:电负性,的沸点为31.8℃,熔点为-126.5℃,在空气中易自燃,遇水会剧烈反应)
A.实验过程中,加热石英管前应先对进行验纯
B.实验开始时,排尽装置中的空气是为了防止自燃和水解
C.尾气通入NaOH溶液中,发生反应的化学方程式为
D.为提高装置Ⅳ中的利用率,装置Ⅲ应使用冷水浴
19.亚硝酰硫酸()主要用于重氨化反应。在实验室中,将二氧化硫通入到浓硫酸和浓硝酸的混合液中,在低于20 ℃条件下发生氧化还原反应制备少量(硝酸被还原,二氧化硫被氧化,夹持装置略)。已知:遇水分解,溶于浓硫酸不分解。
下列说法错误的是( )
A.导管a的作用是平衡气压,保证液体顺利滴下
B.装置B中多孔球泡的作用为增大反应物接触面积,使反应更充分
C.装置C主要用于吸收挥发出的
D.该实验装置可能导致的产量偏高
20.用图1所示的装置制备乙酸乙酯,并用图2所示的步骤分离乙酸乙酯、乙醇和乙酸。下列说法正确的是( )
A.反应试剂的加入顺序为浓硫酸→乙醇→乙酸
B.操作1、操作2是分液,操作3是蒸馏
C.若要进一步得到干燥的乙酸乙酯可用碱石灰
D.A是乙酸乙酯,E是乙醇,试剂a可以是硫酸
21.实验室用冰水浴分别冷却溶液、30 mL 6% 以及15 mL浓氨水,搅拌下将三者混合,继续冰水浴30 min,待溶液中不再有固体析出后,经“一系列操作”得到含固体混合物。将所得固体置于试管中加热,发生反应:,利用下列装置可测量的产率,下列有关说法正确的是( )
A.中阳离子和阴离子的个数比为1:2
B.一系列操作中包括“蒸发结晶”
C.制备的化学方程式为
D.反应结束后,J、K两管液面的差值即为氧气的体积
22.丙烯酸乙酯()天然存在于菠萝等水果中,是一种食品用合成香料。某小组设计如图装置制备丙烯酸乙酯(加热仪器省略)。下列说法错误的是( )
A.丙烯酸乙酯中碳原子的杂化轨道类型有
B.冷凝管的作用是冷凝回流,提高原料利用率
C.当油水分离器中液面保持稳定时说明酯化反应达到平衡
D.可用溶液除杂、分液提纯产品
23.实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石()反应制备,反应装置如图所示,下列说法不正确的是( )
A.曲颈甑是一种原始的蒸馏烧瓶
B.反应温度如果过高,制得的可能会呈现黄色
C.反应的化学方程式为(浓)
D.可从实验室选用无色透明洁净的试剂瓶盛装制得的硝酸
24.实验室可用少量的溴和足量的乙醇制备1,2-二溴乙烷,反应原理为,。制备装置如图所示。下列说法不正确的是( )
A.使用恒压滴液漏斗的目的是防止有机物挥发,使漏斗内液体顺利滴下
B.实验中为了防止有机物大量挥发,应缓慢提升反应温度至170 ℃
C.装置C中应加入NaOH溶液,以吸收反应中可能生成的酸性气体
D.实验过程中应用冰水冷却装置D,以避免的大量挥发
25.氮化铬(CrN)具有高硬度和良好的耐磨性。实验室利用与反应制备氮化铬,可选择的装置如图所示。下列说法错误的是( )
A.装置的连接顺序为A→D→E→B→C→E
B.A装置中分液漏斗内盛放的是溶液,圆底烧瓶中盛放的是NaOH溶液
C.B与C装置之间采用粗玻璃管的目的是防止升华冷凝堵塞导管
D.制得的CrN中往往含有少量,生成的化学方程式为
答案以及解析
1.答案:B
解析:A.实验中利用环己烷-水的共沸体系(沸点69℃)带出水分,体系中沸点最低的有机物是环己烷(沸点81℃),则反应时水浴温度应高于69℃,低于81℃,A项错误;
B.蒸出的是共沸体系,环己烷与水不混溶,锥形瓶中冷却为液体后会出现分层现象,根据环己烷带出水的体积,结合反应方程式,可估算出反应进度,当水的体积不再变化时,反应达到最大限度,B项正确;
C.蒸出的是共沸体系,环己烷与水不混溶,锥形瓶中冷却为液体后会出现分层现象,C项错误;
D.贝诺酯、有机酸均可以和氢氧化钠反应,则不可以用氢氧化钠除去其中混杂的有机酸,D项错误;答案选B。
2.答案:C
解析:A.浓硫酸的密度比乙醇的大,应在不断搅拌下向乙醇中加入浓硫酸,A项错误;
B.装置b中应盛放浓的溶液,因高锰酸钾溶液可氧化乙烯,B项错误;
C.先与水反应生成,再与乙烯加成,C项正确;
D.与水互溶,应先中和再蒸馏,D项错误;
答案选C。
3.答案:B
解析:水浴加热的优点为反应物受热均匀、容易控制温度,A正确;反应后,液体分层,应用分液漏斗分离,粗产品用蒸馏烧瓶(不用圆底烧瓶)和冷凝管蒸馏得到硝基苯,B错误;硝基苯有苦杏仁气味,密度比水的大,C正确;混合时要使热量及时散失,防止苯挥发,由于浓硫酸的密度大于浓硝酸,为避免液体迸溅,应向浓硝酸中加入浓硫酸,待冷却后,将苯加入所得的混合物中,D正确。
4.答案:C
解析:A(√),由上述分析知,通入空气可以稀释,防止发生爆炸;B(√),装置②为安全瓶,可防止装置③中液体倒吸进装置①中;C(×),装置①中发生反应的化学方程式为,其中是氧化剂,是还原剂,侧氧化剂与还原剂的物质的量之比为2:1;D(√),当看到装置③中导管内液面上升时,说明发生倒吸现象,应增大空气的通入速度,通过增大气体压强,将导管内液体压回装置③中。
5.答案:C
解析:由题意可知,、KOH、在加热条件下反应生成锰酸钾,根据质量守恒可知,还会相生成氯化钠、水,反应为,由于该过程中使用KOH,瓷坩埚易被腐蚀,故熔融时不能用瓷坩埚,子可用铁坩埚,A正确;根据反应可知,理论上,与KOH的质量之比为(87×3):(56×6)=87:112,B正确;开始时应该打开旋塞1、3、4,关闭旋塞2、5,往溶液中通入发生反应,没有反应的被收集到气囊a中,C错误;当气囊a收集到较多气体时,关闭旋塞1、3,打开旋塞2、5,轻轻挤压气囊a,将a中的压入溶液中继续反应,未反应的又被收集在气囊b中,D正确。
6.答案:D
解析:A.实验室中用Cu与1的硝酸反应,1的硝酸是稀硝酸只能生成NO,得不到二氧化氮气体,制备二氧化氮应该用浓硝酸,故A错误;
B.装置II中的玻璃管起到平衡气压作用,但和都是有毒气体,需要使用完全处理装置,不能直接排放,故B错误;
C.该反应中是氧化剂,是还原剂,是氧化产物,故只能得出氧化性顺序,但不能得出,故C错误;
D.由于同温同压下,气体的体积之比等于其物质的量之比,故可以通过观察装置I、Ⅲ中的气泡的快慢控制和的通入量,故D正确;
答案为D。
7.答案:C
解析:导管a的作用是平衡气压,使液体顺利滴下,A正确;多孔球泡可以增大与液体的接触面积,使反应更充分,B正确;装置C的主要作用是利用氢氧化钠溶液吸收未反应完的二氧化硫,防止污染空气,但不能漂白酚䣭,C错误;装置C中的水蒸气会进入装置B中使水解,导致产率降低,应在装置B、C间增加一个装有浓硫酸的洗气瓶,D正确。
8.答案:C
解析:装置b的作用是防止a中水蒸气、甲酸进入装置c,因此装置b中试剂可选用碱石灰等碱性干燥剂,A项错误;装置d的作用是吸收未反应完全的CO,防止污染空气,而NaOH溶液不能与CO反应,B项错误;实验过程中需先点燃装置a处酒精灯,利用装置a产生的CO将装置内空气排尽,防止空气中氧气与CO反应生成干扰实验,再点燃装置c处酒精灯,C项正确;加热一段时间后,若CO与反应生成,则硬质玻璃管中粉末颜色由淡黄色变为白色,D项错误。
9.答案:A
解析:因四氯化钛()极易水解,遇空气中的水蒸气即产生“白烟”,而①制得的氯气中含有水蒸气,所以②中应盛装浓硫酸,A错误;的熔、沸点较低,制得的应经过冷凝处理,则该装置中的冷凝管具有冷凝、回流和导气的作用,B正确;反应结束时,先停止③处加热,后停止①处加热,可以使制得的在氯气氛围中冷却,防止空气进入装置中使变质,C正确;因四氯化钛()极易水解,所以应在装置④和⑤之间加一个防止水蒸气进入④的装置,D正确。
10.答案:A
解析:用二氧化锰与浓盐酸制取氯气需要加热,A错误;饱和食盐水可除去中混有的HCl,根据装置B中长颈漏斗导管内外的液面变化,可以判断装置C是否发生堵塞,B正确;装置C是利用硅胶吸收水蒸气,C正确;装置D中碘和氯气反应生成,的熔点为33 ℃,沸点为73 ℃,最恰当的加热方式是用水浴加热,D正确。
11.答案:D
解析:氨水中加入生石灰,生石灰与水反应放出大量的热,促进分解产生氨气,浓盐酸中加入浓硫酸,浓硫酸吸收水,且放出大量的热,可促进浓盐酸挥发,A正确;
碱石灰与氨气不反应,可用于干燥氨气,B正确;
打开止水夹a、c、d,氨气和氯化氢反应而导致两个烧瓶内压强减小,从而形成喷泉,氨水呈碱性,HCl的水溶液呈酸性,则可分别形成蓝色和红色喷泉,C正确;
氯化铵不稳定,受热易分解,蒸干得不到固体,D错误。
12.答案:C
解析:A.二氧化锰和浓盐酸的反应需要加热;氯化铝易升华,导出氯化铝的导管太细,容易堵塞导管;装置⑥中氢氧化钠溶液中水易挥发,进入装置⑤使产品变质,共3处错误,A错误;
B.先启动①中反应,通入氯气排净装置内的空气,再点燃④的酒精灯,使氯气在与铝发生反应,B错误;
C.实验中产生的氯气中含有氯化氢气体和水蒸气杂质,应该先除去氯化氢后除去水蒸气,故装置②和装置③的位置不能互换,C正确;
D.二氧化锰和浓盐酸随着反应的进行,浓盐酸变成稀盐酸,不再生产氯气,故含有14.6gHCl的浓盐酸与足量的反应生成的小于0.1ml,D错误;
故选C。
13.答案:B
解析:若Ⅰ中增加加热装置,随着温度升高,乙炔的生成速率加快,Ⅴ中流出的乙炔气体的流量更大,Ⅵ中黑烟变多,A错误;电石中含有CaS杂质,可发生水解反应:、,和反应过程中放热,会促进的水解平衡正向移动,有气体逸出,进入Ⅱ中与溶液发生反应:,生成CuS黑色沉淀,B正确:由乙炔与乙烯的化学性质相似可知,Ⅲ中乙炔和溴单质发生加成反应,使溴的溶液褪色,乙炔具有还原性,在Ⅳ中被酸性高锰酸钾氧化为,使Ⅴ中溶液变浑浊,C、D错误。
14.答案:D
解析:由题图可知,A中高锰酸钾与浓盐酸反应产生,中混有的HCl经过试剂X(饱和食盐水)除去,防止HCl消耗NaOH导致产率降低,由C中试剂可知,制得的无需干燥,A错误;进入C中与NaOH反应生成NaClO,再将b中混合液滴入C中反应生成,多孔球泡的作用是增大反应物的接触面积,使气体充分反应,B错误;C中与按物质的量之比1:2混合时的总反应化学方程式为,C错误;冰水能降低温度,减小产物的溶解度,促进产物析出,D正确。
15.答案:C
解析:A.1中发生反应,S的化合价升高,为还原剂;中O元素化合价也升高,为还原剂,A正确;
B.装置②,④的作用分别是防倒吸、吸收生成的,防止污染空气,B正确;
C.与氢氧化钠溶液反应,,氯酸钠提取工艺以蒸发冷却结晶法和盐析法为主,C错误;
D.反应结束时,通氮气的目的是将仪器中残留的气体排入④中,排空污染气体,保证试验结束安全,D正确;
故选C。
16.答案:C
解析:苯胺易被氧化,实验时,应先通一段时间,排尽装置中的空气再加热,A正确;该反应的温度为140 ℃,而水浴加热的温度最高为100 ℃,故该加热方式不能为水浴加热,B正确;生石灰是碱性干燥剂,不与苯胺反应,是酸性干燥剂,可与苯胺发生反应,故不能用代替生石灰,C错误;当蒸馏物的沸点较高时,一般使用空气冷凝管进行冷凝,以免直形冷凝管因通水冷却导致玻璃温度骤降而炸裂,D正确。
17.答案:C
解析:由题意可知,1-溴丁烷在NaOH醇溶液、加热条件下发生反应生成1-丁烯,A正确;1-丁烯不溶于水,乙醇易溶于水,因此可将混合气体通入水中除去1-丁烯中混有的乙醇蒸气,B正确;1-丁烯的密度大于空气的密度,排空法收集时应该从长导管通入1-丁烯,从短导管排出空气,C错误;1-丁烯中存在碳碳双键,能使酸性溶液褪色,D正确。
18.答案:D
解析:A.实验过程中,应先对进行验纯再加热石英管,防止氢气不纯导致实验失败,故A正确;
B.在空气中易自燃,遇水会剧烈反应,实验开始时,排尽装置中的空气是为了防止自燃和水解,故B正确;
C.电负性中H为-1价,具有还原性,可与氢氧化钠溶液发生归中反应化学方程式为:,故C正确;
D.Ⅳ中是为了使气化,使得气化后的与氢气在石英管中反应,不可使用冷水浴,故D错误;
故选D。
19.答案:D
解析:导管a的作用是平衡气压,使液体顺利滴下,A正确;多孔球泡可以增大与液体的接触面积,使反应更充分,B正确;装置C的主要作用是利用氢氧化钠溶液吸收未反应完的二氧化硫,防止污染空气,C正确;装置A、C中的水蒸气会进入装置B中使水解,导致产量降低,应在装置A和B、B和C间各增加一个装有浓硫酸的洗气瓶,D错误。
20.答案:D
解析:A.浓硫酸混合时剧烈放热,为防止液体飞溅,浓硫酸应后加入,反应试剂的加入顺序为乙醇→浓硫酸→乙酸,故A错误;
B.操作1分离出乙酸乙酯,分离方法为分液,操作2分离出乙醇,操作3是分离出乙酸,分离方法均为蒸馏,故B错误;
C.乙试管内液体是分离乙酸乙酯,碱石灰内成分之一氢氧化钠与乙酸乙酯能反应,不可以用碱石灰干燥,故C错误;
D.操作1分离出乙酸乙酯,A是乙酸乙酯,操作2分离出乙醇,E是乙醇,试剂a将乙酸钠转化为乙酸,试剂a可以是硫酸,故D正确;
故选:D。
21.答案:C
解析:A.中阳离子和阴离子的个数比为1:1,A错误;
B.一系列操作是过滤、洗涤、干燥,不需蒸发结晶,B错误;
C.制备的化学方程式为方程式正确,C正确;
D.反应结束后,上下移动量气管使J和K中液面相平再读数,反应前后量气管的读数差即为氧气的体积,D错误;
答案选C。
22.答案:D
解析:A.丙烯酸乙酯中存在碳碳双键、碳氧双键和只连单键的碳原子,碳原子的杂化轨道类型有,故A正确;
B.乙醇沸点较低,冷凝管的作用是使反应物冷凝回流,提高原料利用率,故B正确;
C.反应得到平衡时,水的量不变,此时油水分离器中液面保持稳定,说明酯化反应达到平衡,故C正确;
D.丙烯酸乙酯在溶液中会水解,应该用饱和碳酸氢钠溶液除杂、分液提纯产品,故D错误;
故选D。
23.答案:D
解析:曲颈甑是一种原始的蒸馏烧瓶,是长弯颈、圆球体的蒸馏烧瓶,A正确;浓硝酸受热易分解,分解生成的溶解在硝酸中呈现黄色,B正确;和浓硫酸反应生成和,反应的化学方程式为(浓),C正确;硝酸见光易分解,应避光保存在棕色试剂瓶中,D错误。
24.答案:B
解析:因为有机物乙醇易挥发,使用恒压滴液漏斗的目的是防止有机物挥发,恒压滴液漏斗可以保证体系内部压强不变,漏斗内液体可以顺利滴下,A正确;由和浓硫酸的混合液制时,为了减少副反应的发生,应迅速升温到170 ℃,B错误;由于浓硫酸具有强氧化性,具有还原性,浓硫酸会与发生氧化还原反应生成和,也能与反应,装置C中应加入NaOH溶液,用于吸收反应中可能生成的酸性气体,C正确;易挥发,为了提高原料的利用率,实验过程中应用冰水冷却装置D,以避免的大量挥发,D正确。
25.答案:B
解析:A装置中用来制备,D装置用来控制的流速以及检验后续装置是否堵塞,E装置干燥,B装置中和反应制备CrN,由于易升华,粗导管可防止遇冷凝结堵塞导管,极易水解,E装置可防止空气中的水蒸气进入C中使水解,故装置的连接顺序为A→D→E→B→C→E,A正确;溶液与NaOH溶液反应制时需要加热,装置A中无加热装置,B错误;B与C装置之间采用粗玻璃管的目的是防止升华的遇冷凝固堵塞导管,C正确;制得的CrN中往往含有少量,根据氧化还原反应原理,生成的化学方程式为,D正确。
相关教案
这是一份2025届高考化学二轮复习:专题十三 综合化学实验的设计与评价,现象与结论的表述 教案,共28页。教案主要包含了解题技巧,真题链接等内容,欢迎下载使用。
这是一份2025届高考化学二轮复习:专题十一 化学实验基础 教案,共26页。教案主要包含了考查方式,解题技巧,真题链接等内容,欢迎下载使用。
这是一份2025届高考化学二轮复习:专题三十 化学反应原理综合 教案,共84页。教案主要包含了考查方式,真题链接等内容,欢迎下载使用。








