
江苏省2025年1月普通高中学业水平合格性化学考试 导学案 课时3 离子反应
展开
这是一份江苏省2025年1月普通高中学业水平合格性化学考试 导学案 课时3 离子反应,共8页。试卷主要包含了 离子反应, 离子方程式, 离子共存等内容,欢迎下载使用。
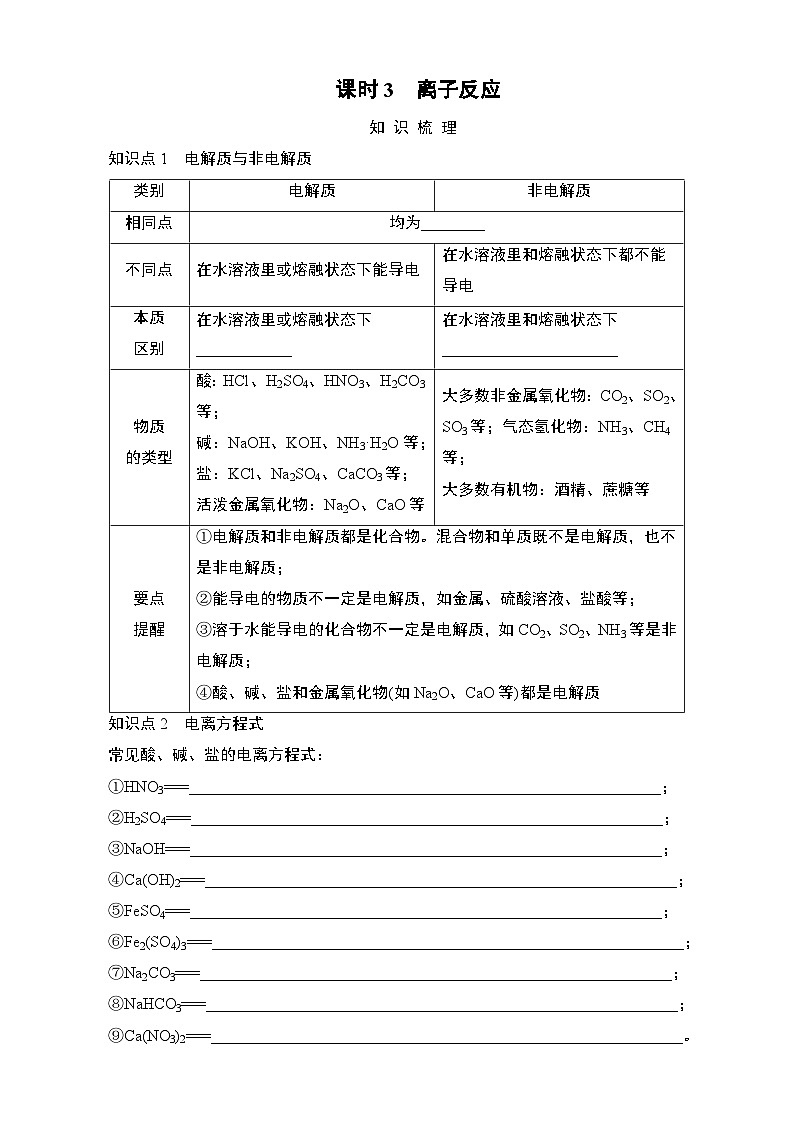
知识点1 电解质与非电解质
知识点2 电离方程式
常见酸、碱、盐的电离方程式:
①HNO3===___________________________________________________________;
②H2SO4===___________________________________________________________;
③NaOH===___________________________________________________________;
④Ca(OH)2===___________________________________________________________;
⑤FeSO4===___________________________________________________________;
⑥Fe2(SO4)3===___________________________________________________________;
⑦Na2CO3===___________________________________________________________;
⑧NaHCO3===___________________________________________________________;
⑨Ca(NO3)2===___________________________________________________________。
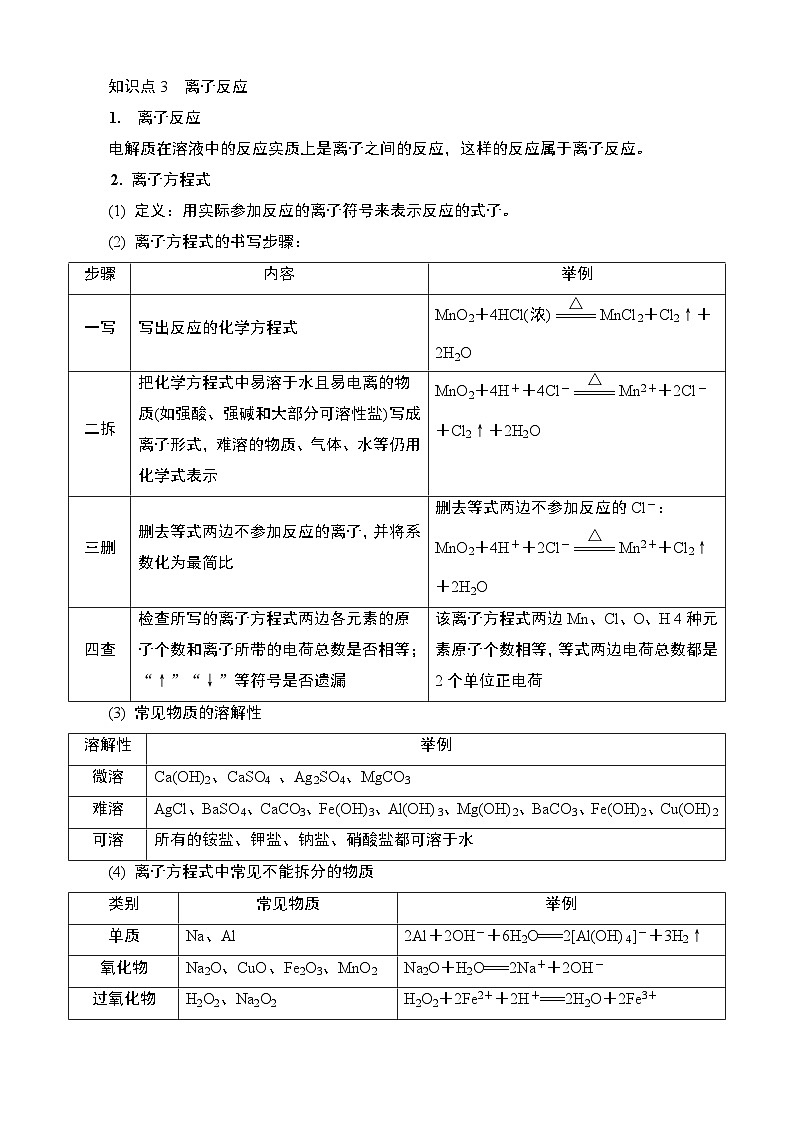
知识点3 离子反应
1. 离子反应
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
2. 离子方程式
(1) 定义:用实际参加反应的离子符号来表示反应的式子。
(2) 离子方程式的书写步骤:
(3) 常见物质的溶解性
(4) 离子方程式中常见不能拆分的物质
(5) 离子方程式正误判断的七个角度
①看是否符合客观事实
如铁与稀盐酸反应:
2Fe+6H+===2Fe3++3H2↑(×)
Fe+2H+===Fe2++H2↑(√)
②看是否符合拆分原则
如石灰石加入稀盐酸中:
COeq \\al(2-,3)+2H+===CO2↑+H2O(×)
CaCO3+2H+===Ca2++CO2↑+H2O(√)
③看是否遵守质量守恒定律
如Na2O2与H2O反应:
2Na2O2+2H2O===2Na++2OH-+O2↑(×)
2Na2O2+2H2O===4Na++4OH-+O2↑(√)
④看是否遵守电荷守恒
如氯化铁溶液腐蚀铜板:
Cu+Fe3+===Fe2++Cu2+ (×)
Cu+2Fe3+===2Fe2++Cu2+(√)
⑤看是否漏掉参加反应的离子
如CuSO4与Ba(OH)2溶液反应:
Ba2++SOeq \\al(2-,4)===BaSO4↓(×)
Ba2++SOeq \\al(2-,4)+Cu2++2OH-===BaSO4↓+Cu(OH)2↓(√)
⑥看化学计量数简化是否正确
如Ba(OH)2溶液和稀硫酸反应:
Ba2++OH-+H++SOeq \\al(2-,4)===BaSO4↓+H2O(×)
Ba2++2OH-+2H++SOeq \\al(2-,4)===BaSO4↓+2H2O(√)
⑦看是否漏掉“↑”或“↓”
如锌与稀硫酸反应:
Zn+2H+===Zn2++H2(×)
Zn+2H+===Zn2++H2↑(√)
[及时巩固]
写出下列反应的离子方程式。
①铁与稀硫酸反应:___________________________________________;
②NaOH与盐酸反应:___________________________________________________;
③澄清石灰水和盐酸反应:
___________________________________________________________;
④硫酸钠溶液与氢氧化钡溶液反应:
___________________________________________________________;
⑤用NaHCO3治疗胃酸过多:
___________________________________________________________;
⑥实验室制取氯气:__________________________________________________;
⑦金属钠与水反应:____________________________________________________;
⑧电解饱和NaCl溶液:_____________________________________________________。
3. 离子共存
(1) 常见离子不能大量共存的情况
(2) 无色溶液中离子不能共存的情况
(3) 发生复分解反应不能共存的情况
(4) 发生氧化还原反应不能共存的情况
如NOeq \\al(-,3)(H+)与Fe2+、Fe3+与I-、Fe2+与ClO-等发生氧化还原反应而不能共存。
知识点4 常见离子的检验
典 型 例 题
类型1 离子共存
(2023·江苏学测)在含有大量的Ag+、H+、NOeq \\al(-,3)溶液中,还能大量共存的离子是( )
A. Cl- B. K+
C. OH- D. COeq \\al(2-,3)
(2022·江苏学测)下列离子可与H+、Cl-、Ba2+共存的是( )
A. COeq \\al(2-,3) B. Ag+
C. NOeq \\al(-,3) D. SOeq \\al(2-,3)
(2024·扬州合格考模拟)在含有大量的Na+、Cl-、OH-的溶液中,还可能大量共存的离子是( )
A. COeq \\al(2-,3) B. H+
C. NHeq \\al(+,4) D. Ag+
(2024·常州合格考模拟)某溶液中存在大量的H+、Cl-、SOeq \\al(2-,4),则该溶液中还可能大量存在的是( )
A. HCOeq \\al(-,3) B. Ba2+
C. Ag+ D. Al3+
(2023·扬州学测合格考)在含有大量NHeq \\al(+,4)、SOeq \\al(2-,4)、NOeq \\al(-,3)的溶液中,还可能大量存在的离子是( )
A. OH- B. Na+
C. Ba2+ D. Ag+
类型2 离子方程式
(2023·江苏学测)下列反应的离子方程式书写正确的是( )
A. 电解饱和NaCl溶液:H2O+2Cl-eq \(=====,\s\up9(电解))H2↑+Cl2↑+2OH-
B. Cl2与 NaOH溶液反应制取“84”消毒液:Cl2+2OH-===Cl-+ClO-+H2O
C. 向卤水中通入Cl2制取Br2:Cl2+Br-===Br2+Cl-
D. 用NaHCO3治疗胃酸过多:COeq \\al(2-,3)+2H+===CO2↑+H2O
(2022·江苏学测)下列NaOH参与反应的离子方程式正确的是( )
A. NaOH溶液吸收Cl2:Cl2+2OH-===2ClO-+H2O
B. 与NaHCO3溶液反应:HCOeq \\al(-,3) +OH-===H2O+CO2↑
C. 与MgCl2溶液反应:MgCl2+2OH-===Mg(OH)2↓+2Cl-
D. 与NH4Cl溶液加热:NHeq \\al(+,4) +OH-eq \(=====,\s\up9(△))NH3↑+H2O
(2020·江苏学测)下列反应不能用离子方程式H++ OH-===H2O来表示的是( )
A. CH3COOH+NH3·H2O===H2O+CH3COONH4
B. H2SO4 +2KOH===K2SO4 +2H2O
C. HNO3 +NaOH===NaNO3 +H2O
D. HCl+NaOH===NaCl+H2O
(2021·江苏学测)下列反应的离子方程式书写正确的是( )
A. 碳酸钡溶于盐酸:COeq \\al(2-,3)+2H+===H2O+CO2↑
B. 二氧化锰制氯气:MnO2+4H++2Cl-eq \(=====,\s\up9(△))Mn2++Cl2↑+2H2O
C. 铜片插入浓硝酸:3Cu+8H++2NOeq \\al(-,3)===3Cu2++2NO↑+4H2O
D. 氢氧化铝溶于NaOH溶液:Al(OH)3+2OH-===2[Al(OH)4]-
(2024·徐州合格考模拟)下列反应的离子方程式正确的是( )
A. Cl2与NaOH溶液反应制取漂白剂:Cl2+2OH-===H++Cl-+HClO
B. 向FeCl2溶液中通入Cl2:Cl2+Fe2+===2Cl-+Fe3+
C. 用石灰乳与浓缩的海水制备氢氧化镁:Mg2++2OH-===Mg(OH)2↓
D. 实验室制Cl2:MnO2+4H++2Cl-eq \(=====,\s\up9(△))Mn2++Cl2↑+2H2O
课时3 离子反应
[知识梳理]
[知识点1] 化合物 自身能发生电离 自身均不能发生电离
[知识点2] ①H++NOeq \\al(-,3) ②2H++SOeq \\al(2-,4) ③Na++OH- ④Ca2++2OH- ⑤Fe2++SOeq \\al(2-,4) ⑥2Fe3++3SOeq \\al(2-,4)
⑦2Na++COeq \\al(2-,3) ⑧Na++HCOeq \\al(-,3) ⑨2NOeq \\al(-,3)+Ca2+
[知识点3]
[及时巩固]
①Fe+2H+===Fe2++H2↑
②H++ OH-===H2O ③H++ OH-===H2O
④Ba2++SOeq \\al(2-,4)===BaSO4↓
⑤H++HCOeq \\al(-,3)===H2O+CO2↑
⑥MnO2+4H++2Cl-eq \(=====,\s\up9(△))Mn2++2H2O+Cl2↑
⑦2Na+2H2O===2Na++2OH-+H2↑
⑧2H2O+2Cl-eq \(=====,\s\up9(电解))H2↑+Cl2↑+2OH-
3. (3) OH- OH-
[知识点4] 黄色 蓝色钴玻璃 紫色
[典型例题]
例题1 B
例题2 C 【解析】COeq \\al(2-,3)与H+结合生成CO2和H2O, COeq \\al(2-,3)与Ba2+结合生成BaCO3沉淀,不能大量共存,A不选;Ag+与Cl-结合生成AgCl沉淀,不能大量共存,B不选;NOeq \\al(-,3) 与三种离子之间不反应,可以大量共存,C选;SOeq \\al(2-,3)与Ba2+结合生成BaSO3沉淀,SOeq \\al(2-,3)与H+结合生成SO2和H2O,不能大量共存,D不选。
例题3 A 【解析】H+与OH-结合生成H2O,不能大量共存,B不选;NHeq \\al(+,4)与OH-结合生成NH3·H2O,不能大量共存,C不选;Ag+与Cl-结合生成AgCl沉淀,不能大量共存,D不选。
例题4 D 【解析】HCOeq \\al(-,3)与H+结合生成CO2和H2O,不能大量共存,A不选;SOeq \\al(2-,4)与Ba2+结合生成BaSO4,不能大量共存,B不选;SOeq \\al(2-,4)与Ag+结合生成Ag2SO4微溶物,不能大量共存,C不选。
变式1 B
例题5 B 【解析】氧原子不守恒,正确的离子方程式为2H2O+2Cl-eq \(=====,\s\up9(电解))H2↑+Cl2↑+2OH-,A错误;原子不守恒,正确的离子方程式为Cl2+2Br-===Br2+2Cl-,C错误;用NaHCO3治疗胃酸过多的离子方程式为HCOeq \\al(-,3)+H+===CO2↑+H2O,D错误。
例题6 D 【解析】氧原子不守恒,用NaOH溶液吸收Cl2的离子方程式为Cl2+2OH-===ClO-+Cl-+H2O,A错误;NaOH与NaHCO3溶液反应生成碳酸钠和H2O,离子方程式为HCOeq \\al(-,3)+OH-===H2O+COeq \\al(2-,3),B错误;MgCl2为可溶性盐,写离子方程式要拆开,正确为Mg2++2OH-===Mg(OH)2↓,C错误。
例题7 A 【解析】CH3COOH+NH3·H2O===CH3COONH4+H2O的离子方程式为CH3COOH+NH3·H2O===CH3COO-+NHeq \\al(+,4)+H2O,A符合题意。
例题8 B 【解析】碳酸钡难溶,在离子方程式中不能拆分,正确的离子方程式为BaCO3+2H+===Ba2++H2O+CO2↑,A错误;铜和浓硝酸反应生成的气体是NO2,正确为Cu+4H++2NOeq \\al(-,3)===Cu2++2NO2↑+2H2O,C错误;氢氧化铝和氢氧化钠反应的离子方程式为Al(OH)3+OH-===[Al(OH)4]-,D错误。
变式2 D 【解析】Cl2与NaOH溶液反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,A错误;FeCl2溶液中通入Cl2的离子方程式为Cl2+2Fe2+===2Cl-+2Fe3+,B错误;反应物是石灰乳,故Ca(OH)2在离子反应中不拆分,石灰乳与浓缩的海水制备氢氧化镁的离子方程式为Ca(OH)2+Mg2+===Mg(OH)2+Ca2+,C错误。
类别
电解质
非电解质
相同点
均为________
不同点
在水溶液里或熔融状态下能导电
在水溶液里和熔融状态下都不能导电
本质
区别
在水溶液里或熔融状态下____________
在水溶液里和熔融状态下______________________
物质
的类型
酸:HCl、H2SO4、HNO3、H2CO3等;
碱:NaOH、KOH、NH3·H2O等;
盐:KCl、Na2SO4、CaCO3等;
活泼金属氧化物:Na2O、CaO等
大多数非金属氧化物:CO2、SO2、SO3等;气态氢化物:NH3、CH4等;
大多数有机物:酒精、蔗糖等
要点
提醒
①电解质和非电解质都是化合物。混合物和单质既不是电解质,也不是非电解质;
②能导电的物质不一定是电解质,如金属、硫酸溶液、盐酸等;
③溶于水能导电的化合物不一定是电解质,如CO2、SO2、NH3等是非电解质;
④酸、碱、盐和金属氧化物(如Na2O、CaO等)都是电解质
步骤
内容
举例
一写
写出反应的化学方程式
MnO2+4HCl(浓)eq \(=====,\s\up9(△))MnCl2+Cl2↑+2H2O
二拆
把化学方程式中易溶于水且易电离的物质(如强酸、强碱和大部分可溶性盐)写成离子形式,难溶的物质、气体、水等仍用化学式表示
MnO2+4H++4Cl-eq \(=====,\s\up9(△))Mn2++2Cl-+Cl2↑+2H2O
三删
删去等式两边不参加反应的离子,并将系数化为最简比
删去等式两边不参加反应的Cl-:
MnO2+4H++2Cl-eq \(=====,\s\up9(△))Mn2++Cl2↑+2H2O
四查
检查所写的离子方程式两边各元素的原子个数和离子所带的电荷总数是否相等;“↑”“↓”等符号是否遗漏
该离子方程式两边Mn、Cl、O、H 4种元素原子个数相等,等式两边电荷总数都是2个单位正电荷
溶解性
举例
微溶
Ca(OH)2、CaSO4 、Ag2SO4、MgCO3
难溶
AgCl、BaSO4、CaCO3、Fe(OH)3、Al(OH)3、Mg(OH)2、BaCO3、Fe(OH)2、Cu(OH)2
可溶
所有的铵盐、钾盐、钠盐、硝酸盐都可溶于水
类别
常见物质
举例
单质
Na、Al
2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑
氧化物
Na2O、CuO、Fe2O3、MnO2
Na2O+H2O===2Na++2OH-
过氧化物
H2O2、Na2O2
H2O2+2Fe2++2H+===2H2O+2Fe3+
难溶
物
CaCO3、Cu(OH)2、Fe(OH)3
CaCO3+2H+===Ca2++CO2↑+H2O
弱电解质
CH3COOH、HClO、H2O
Cl2+H2OH++Cl-+HClO
气体
NH3、NO2、CO2
HCOeq \\al(-,3)+H+===CO2↑+H2O
特别
提醒
氨水在反应物中写为NH3·H2O,澄清石灰水中Ca(OH)2在反应物中拆分为“Ca2++2OH-”
酸性
溶液
能与H+大量共存的阴离子只有强酸的酸根阴离子(如Cl-、SOeq \\al(2-,4)、NOeq \\al(-,3)等),其余的阴离子都不能大量存在
碱性
溶液
能与OH-大量共存的阳离子有K+、Na+、Ba2+等,其余的阳离子都不能大量存在
特别提醒:HCOeq \\al(-,3)既不能与H+大量共存,又不能与OH-大量共存
所含离子
Fe3+
Fe2+
Cu2+
MnOeq \\al(-,4)
溶液颜色
棕黄色
浅绿色
蓝色
紫红色
类型
常考举例
生成沉淀
Ba2+与SOeq \\al(2-,4)、COeq \\al(2-,3),Ca2+与COeq \\al(2-,3)、SOeq \\al(2-,4),Cl-与Ag+
生成气体
H+与COeq \\al(2-,3)、HCOeq \\al(-,3), NHeq \\al(+,4)与________
生成水或弱电解质
H+与________、CH3COO-
离子
选用试剂
实验操作及实验现象
有关离子方程式
Na+
—
做焰色试验,火焰呈________
—
K+
—
做焰色试验,透过________观察,火焰呈________
—
NHeq \\al(+,4)
NaOH溶液
加热,产生能使湿润红色石蕊试纸变蓝的气体
NHeq \\al(+,4)+OH-eq \(=====,\s\up9(△))NH3↑+H2O
Fe3+
KSCN溶液
溶液呈红色
Fe3++3SCN-Fe(SCN)3
Cl-
HNO3溶液、
AgNO3溶液
先加硝酸酸化,再加AgNO3溶液产生白色沉淀
Ag++Cl-===AgCl↓
SOeq \\al(2-,4)
盐酸、
BaCl2溶液
先加盐酸酸化,再加BaCl2溶液产生白色沉淀
Ba2++SOeq \\al(2-,4)===BaSO4↓
相关试卷
这是一份江苏省2025年1月普通高中学业水平合格性化学考试 导学案 课时8 氯及其化合物,共7页。试卷主要包含了 氯气的物理性质, 氯气的化学性质等内容,欢迎下载使用。
这是一份江苏省2025年1月普通高中学业水平合格性化学考试 导学案 课时5 化学实验基础,共14页。试卷主要包含了 物质的分离装置与操作, 常见物质的除杂,200 ml/L KCl溶液等内容,欢迎下载使用。
这是一份江苏省2025年1月普通高中学业水平合格性化学考试 导学案 课时4 氧化还原反应,共7页。试卷主要包含了 氧化剂, 还原剂, 还原产物, 氧化产物, 氧化还原反应的两条线关系等内容,欢迎下载使用。










