





化学选择性必修2第2章 微粒间相互作用与物质性质第3节 离子键、配位键与金属键评课课件ppt
展开
这是一份化学选择性必修2第2章 微粒间相互作用与物质性质第3节 离子键、配位键与金属键评课课件ppt,共17页。PPT课件主要包含了什么是离子键,离子键,离子键的形成,离子键的特征,拓展视野,离子极化,金属样品,联想质疑,金属键,无饱和性等内容,欢迎下载使用。
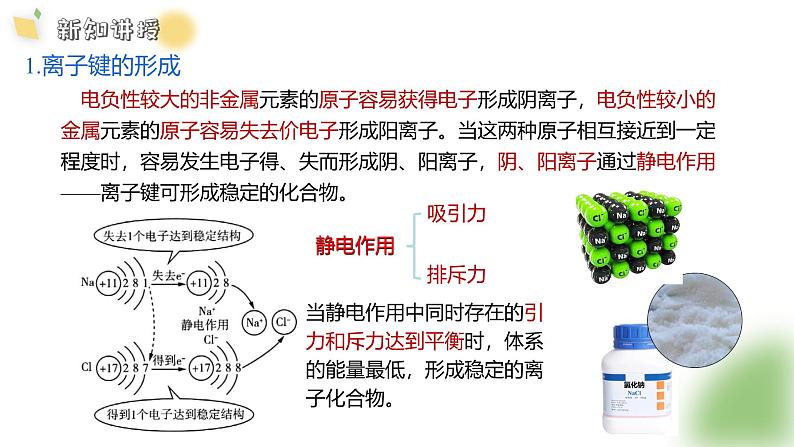
阴阳离子间通过静电作用形成的化学键。
2.哪些物质中存在离子键?
注意:①全由非金属元素组成的物质也可以含离子键,如:铵盐NH4Cl ②AlCl3、BeCl2等中存在的是共价键。
3.形成离子键的两元素原子的电负性要求?
成键原子所属元素的电负性差值越大(一般>1.7),原子之间越容易发生电子得失,形成离子键。
电负性较大的非金属元素的原子容易获得电子形成阴离子,电负性较小的金属元素的原子容易失去价电子形成阳离子。当这两种原子相互接近到一定程度时,容易发生电子得、失而形成阴、阳离子,阴、阳离子通过静电作用——离子键可形成稳定的化合物。
当静电作用中同时存在的引力和斥力达到平衡时,体系的能量最低,形成稳定的离子化合物。
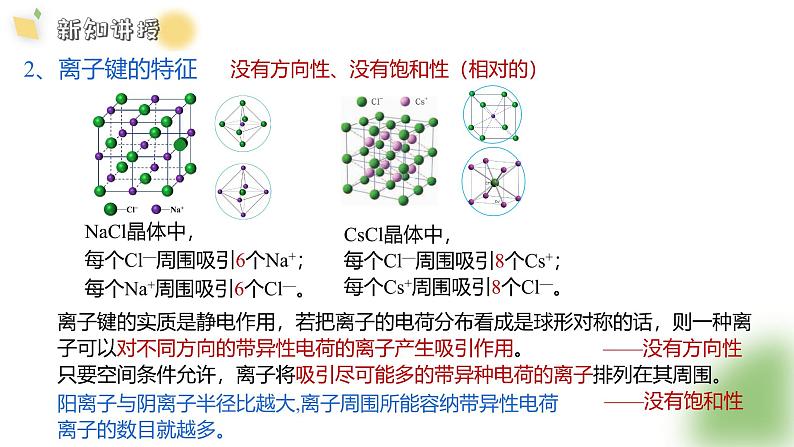
CsCl晶体中,每个Cl—周围吸引8个Cs+;每个Cs+周围吸引8个Cl—。
NaCl晶体中,每个Cl—周围吸引6个Na+;每个Na+周围吸引6个Cl—。
离子键的实质是静电作用,若把离子的电荷分布看成是球形对称的话,则一种离子可以对不同方向的带异性电荷的离子产生吸引作用。 ——没有方向性
阳离子与阴离子半径比越大,离子周围所能容纳带异性电荷离子的数目就越多。
没有方向性、没有饱和性(相对的)
只要空间条件允许,离子将吸引尽可能多的带异种电荷的离子排列在其周围。——没有饱和性
思考1:食盐具有较高的熔点和沸点以及较大的硬度,如何解释呢?
离子键的影响因素:离子所带电荷数越多,离子半径越小,离子键越强。
练:下列离子化合物熔点最高的是( ) A.KCl B.NaCl C.MgO D.Na2O
Mg2+和O2-所带电荷为2,且Mg2+半径在所给阳离子中最小,O2-半径比Cl-小,故MgO中的离子键最强。
在NaCl中,Na+Cl-离子间存在着较强的离子键,破坏它需要较多的能量。
离子键越强,离子化合物的硬度越大,熔沸点越高。
观察卤化银AgX(X=F、Cl、Br、I)的部分结构参数和性质(表2-3-1),你是否会产生疑问∶为什么从 AgCl到 Agl,实测键长与离子半径之和的差距在逐渐增大,难溶性随之增加?这些变化的本质原因是什么?
从表面上看,卤化银是由带正电荷的 Ag+和带负电荷的X-通过离子键结合在一起的,它们都应当是离子化合物,但实际上并非如此。这是因为,基本上呈球对称的离子本身所带有的电荷会形成一个电场,阴、阳离子在相互的电场作用下,会使离子内的电子分布发生相对偏移。这种在电场的作用下产生的离子中的电子分布发生偏移的现象称为离子极化。离子极化可能导致阴、阳离子的外层轨道发生重叠,从而使得许多离子键不同程度地带有一些共价性,继而导致键长缩短、键能增加,甚至出现结构变异。对卤化银系列化合物而言,由于从F-到I-半径增大,在具有较强极化能力的 Ag+的极化下,促使AgX的键型由离子键(AgF)向共价键过渡,Agl已成为以共价键为主的结构,因而从 AgF 到 AgI ,卤化物的性质发生了一定的变化。
1. 通过实验测知,将1 ml Cu、1 ml Fe、1ml W转变成气态原子,需吸收的能量分别为 306.7 kJ、340.2 kJ和 824.0 kJ,因此金属铜、金属铁、金属钨的熔点分别高达1083℃、1 538℃和3 422 C。2、钠的硬度小,铁的硬度大。
由金属元素的原子构成的金属单质内存在一种强烈的相互作用。这种相互作用的强弱又影响金属的性质。
金属键——存在于固体金属单质或合金中
定义:成键原子:实质:特征:
“自由电子”和金属阳离子之间的强的相互作用。
电子在整个三维空间运动,属于整块固态金属,被所有原子所共用,从而把所有的原子维系在一起。
金属元素的电负性、电离能较小,金属原子的价电子易脱离原子核的束缚。 ——“自由电子”
金属原子半径减小,价电子数增多,单质中所形成金属键依次增强,故钠、镁、铝熔沸点和硬度的大小顺序是:钠<镁<铝
价电子数相同,随原子序数的递增,原子半径依次增大,则单质中所形成金属键依次减弱,故钠、钾、铷、铯熔沸点和硬度的大小顺序是:钠>钾>铷>铯
2、判断钠、镁、铝熔沸点和硬度的大小?
1、判断钠、钾、铷、铯熔沸点和硬度的大小?
金属原子半径越小,价电子越多,金属键就越强。
(1)同周期金属单质,从左到右(如Na、Mg、Al)熔、沸点升高
(2)同主族金属单质,从上到下(如碱金属)熔、沸点降低
(4)合金的熔、沸点比其各成分金属的熔、沸点低
(3)金属晶体熔点差别很大,如汞常温为液体,熔点很低(-38.9 ℃),而铁等金属熔点很高(1535 ℃)。
(1)不透明,有金属光泽
固体金属中有“自由电子”,能够吸收所有频率的光并很快放出。
金属在粉末状态时,金属原子的取向杂乱,排列不规则,吸收可见光后不能再反射出来,所以金属粉末常呈暗灰色或黑色
在外加电场的作用下,“自由电子”发生定向移动而形成电流。
当金属中有温度差时,通过不停运动着的“自由电子”与金属阳离子间的碰撞,把能量由高温处传向低温处,从而使整块金属达到相同的温度。
金属键没有方向性,当金属受到外力作用时,金属原子间发生相对滑动而不会破坏金属键,金属发生形变但不会断裂。
原子半径越大,价电子数越少,金属键越弱,反之,金属键越强
金属键越强,金属的熔沸点越高,硬度越大
相关课件
这是一份高中化学第3节 离子键、配位键与金属键精品课件ppt,共37页。PPT课件主要包含了教材分析,离子键,Na+,Cl-,金属键等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第3节 离子键、配位键与金属键优质ppt课件,共37页。PPT课件主要包含了教材分析,离子键,Na+,Cl-,金属键等内容,欢迎下载使用。
这是一份高中鲁科版 (2019)第2章 微粒间相互作用与物质性质第3节 离子键、配位键与金属键多媒体教学课件ppt,共36页。PPT课件主要包含了教材分析,Cl-,离子键,Na+,Cl-,金属键等内容,欢迎下载使用。










