
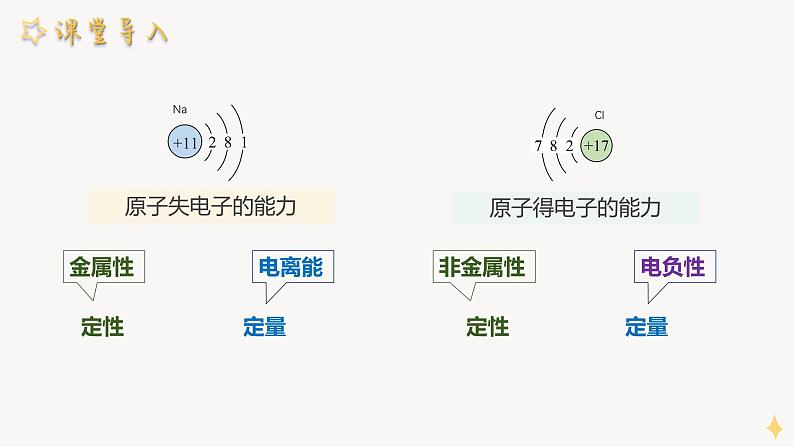



高中鲁科版 (2019)第1章 原子结构与元素性质第3节 元素性质及其变化规律背景图ppt课件
展开
这是一份高中鲁科版 (2019)第1章 原子结构与元素性质第3节 元素性质及其变化规律背景图ppt课件,共26页。PPT课件主要包含了原子失电子的能力,金属性,电离能,原子得电子的能力,非金属性,电负性,稀有气体,具有稳定的电子层结构,规律探究,He1s2等内容,欢迎下载使用。
气态基态原子或气态基态离子失去一个电子所需要的最小能量。
符号: I 单位: kJ·ml-1
可利用电离能数值判断金属元素的原子在气态时失去电子的难易程度。
电离能数值越大,该气态原子越难失去电子。
电离能数值越小,该气态原子越容易失去电子。
元素原子失去一个电子的电离能称为第一电离能,常用符号I1表示;在此基础上再失去一个电子的电离能称为第二电离能,常用符号I2 表示;以此类推,还有第三、第四电离能等。
M(g) = M+(g) + e- I1(第一电离能)M+(g) = M2+(g) + e- I2(第二电离能)M2+(g) = M3+(g) + e- I3(第三电离能)
同一元素的电离能逐级增大:I1 < I2 < I3
为什么通常元素的第二电离能高于第一电离能,第三电离能又高于第二电离能?
形成正离子后,原子核对电子的束缚力整体提升,且越后电离的电子可能处于距离原子核更近的轨道之上,因此对于同一元素,电离能逐级增加。
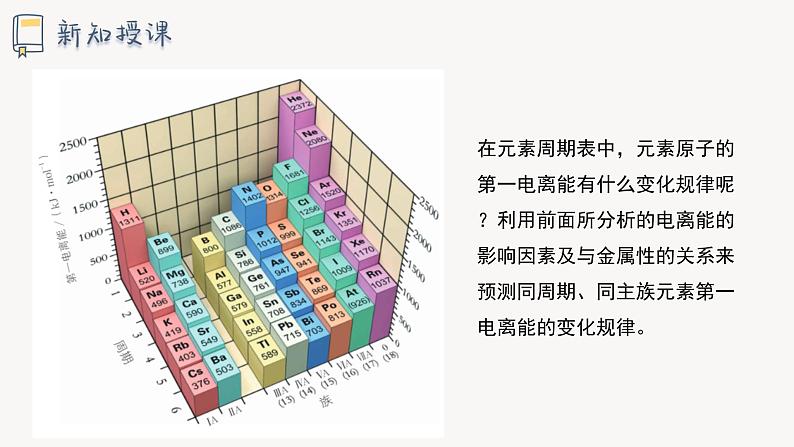
在元素周期表中,元素原子的第一电离能有什么变化规律呢?利用前面所分析的电离能的影响因素及与金属性的关系来预测同周期、同主族元素第一电离能的变化规律。
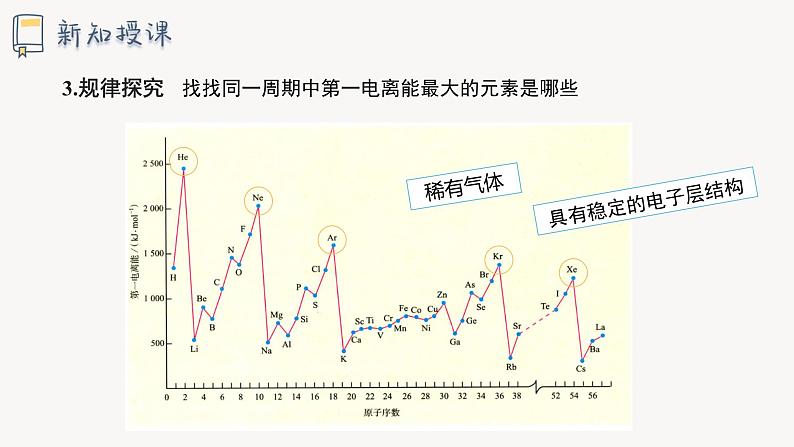
找找同一周期中第一电离能最大的元素是哪些
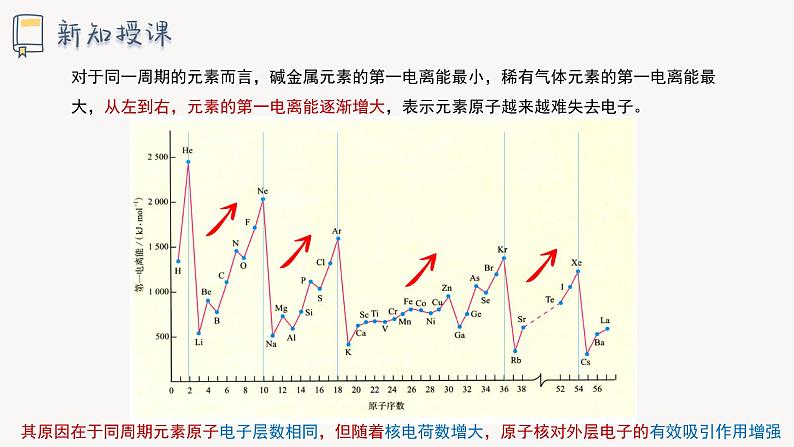
对于同一周期的元素而言,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大,从左到右,元素的第一电离能逐渐增大,表示元素原子越来越难失去电子。
其原因在于同周期元素原子电子层数相同,但随着核电荷数增大,原子核对外层电子的有效吸引作用增强
同主族元素,总体上自上而下第一电离能逐渐减小,表明自上而下原子越来越容易失去电子。
这是因为同主族元素原子的价电子数相同,但自上而下,虽然核电荷数在增加,但原子半径逐渐增大占据主导,原子核对外层电子的有效吸引作用逐渐减弱 。
为什么在II A族和V A族的元素第一电离能会比相邻元素第一电离能大呢?第二周期Be第一电离能大于B,N大于O;第三周期Mg大于Al,P大于S的原因是什么?能用原子半径和核电荷数解释吗?
书写He的核外电子排布式,再书写第2周期Be、N元素和第3周期M、P的核外电子排布式,对比一下,你们从中得到了什么启发?
Be:1s22s2 (B:1s22s22p1) N:1s22s22p3 (O:1s22s22p4)
Mg:1s22s22p63s2 (Al:1s22s22p1) P:1s22s22p63s23p3 (S:1s22s22p63s23p4)
具有全充满、半充满及全空的电子构型的元素稳定性较高,其电离能数值较大
过渡元素的第一电离能的变化不太规则。对于同一周期的元素而言,从左到右随着元素原子序数的增加,第一电离能总体上略有增加。这是因为对这些元素的原子来说,增加的电子大部分排布在(n-1)d或(n-2)f轨道上,原子核对外层电子的有效吸引作用变化不是太大。
确定元素原子的核外电子排布
如:Li的逐级电离能I1≪I2 Mg > AlB.第一电离能Na < Mg < AlC.电负性:Na < Mg Mg > Al
相关课件
这是一份高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律一等奖ppt课件,共41页。PPT课件主要包含了教材分析,电离能的应用等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律优秀课件ppt,共41页。PPT课件主要包含了教材分析,电离能的应用等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第3节 元素性质及其变化规律优质课课件ppt,共46页。PPT课件主要包含了教材分析,元素周期律,表现形式,元素周期表,原子半径及其变化规律,元素的性质,原子结构,O2PtF6,O2+,PtF6-等内容,欢迎下载使用。









