第三单元《物质构成的奥秘》-2024-2025学年九年级化学上学期期末复习考点清单(人教版)
展开
这是一份第三单元《物质构成的奥秘》-2024-2025学年九年级化学上学期期末复习考点清单(人教版),共8页。学案主要包含了易错警示等内容,欢迎下载使用。
物质构成的奥秘
课题1 分子和原子
课题2 原子的结构
课题3 元素
考点7 元素和元素符号
考点8 元素周期表
考点6 相对原子质量
考点5 离子
考点4 原子的结构
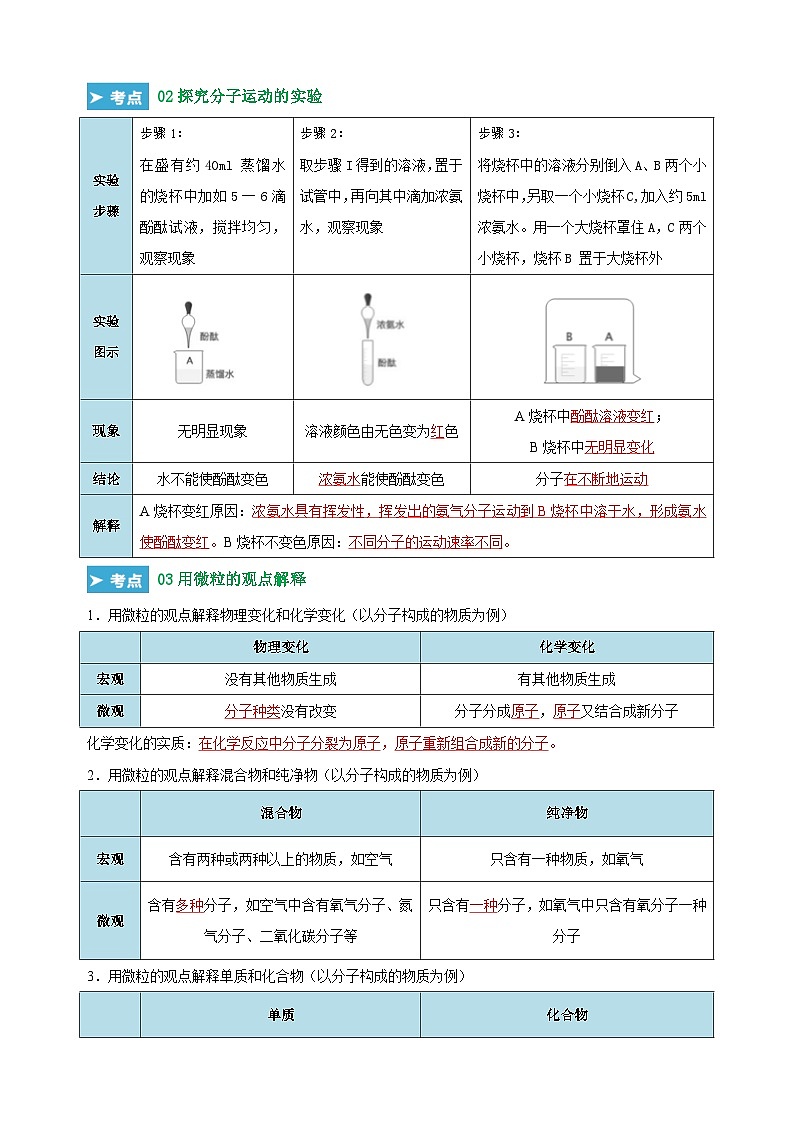
考点2 探究分子运动的实验
考点1 物质由微观粒子构成
考点3用微粒的观点解释
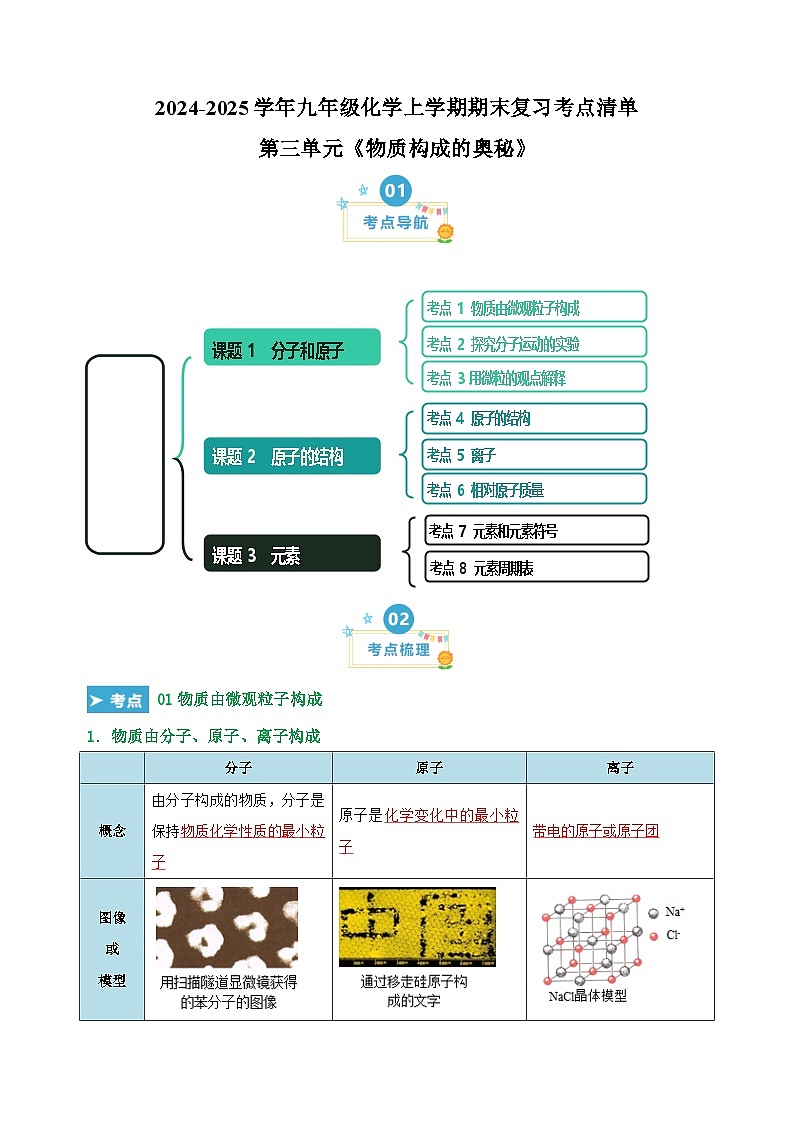
01物质由微观粒子构成
1.物质由分子、原子、离子构成
【易错警示】
分子不能保持物质的物理性质。
物质的物理性质如颜色、气味、状态密度等都是宏观的,是该物质的大量分子聚集在一起才表现出来的属性,单个分子不能保持物质的物理性质。如:二氧化硫有刺激性气味,而单个二氧化硫分子不具有刺激性气味。
【易错警示】
物质的化学性质由构成该物质的粒子来保持
1.由分子构成的物质,化学性质由构成它的分子保持。
如:氧气的化学性质由构成它的氧分子保持,虽然氧分子是由氧原子构成,但氧原子不能保持氧气的化学性质,因为氧气不是直接由氧原子构成的。
2.由原子构成的物质,化学性质由构成它的原子保持。
如:铁的化学性质由铁原子保持。
3.由离子构成的物质,化学性质由构成它的阴阳离子共同保持。
如:氯化钠的化学性质由氯离子和钠离子共同保持。
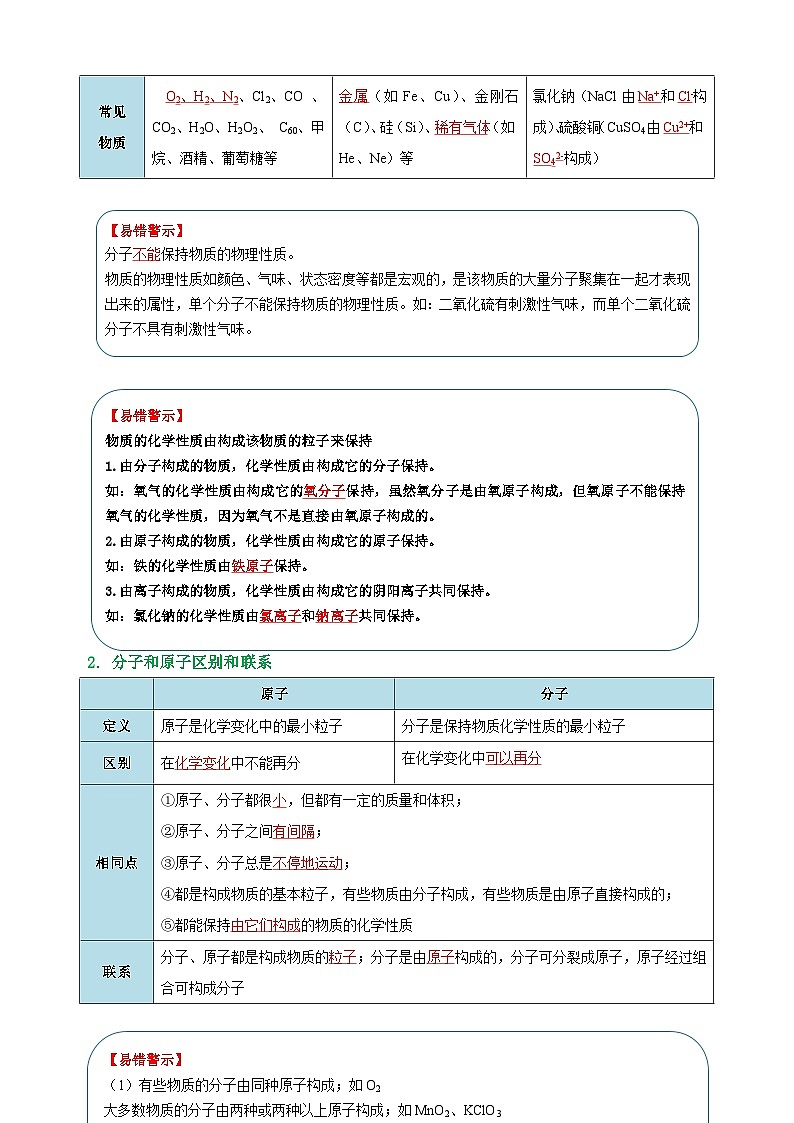
2.分子和原子区别和联系
【易错警示】
(1)有些物质的分子由同种原子构成;如O2
大多数物质的分子由两种或两种以上原子构成;如MnO2、KClO3
相同的原子也可构成不同的分子;如O2和O3、H2O、H2O2
(2)分子构成的描述:
①××分子由××原子和××原子构成。
例如:水分子由氢原子和氧原子构成
②一个××分子由几个××原子和几个××原子构成。
例如:一个水分子由一个氧原子和二个氢原子构成
(3)分子由原子构成,不同的原子大小不同,但分子不一定都比原子大,分子只是一定比构成它的原子大。
分子由原子构成,不同的原子大小不同,但分子不一定都比原子大,分子只是一定比构成它的原子大。
02探究分子运动的实验
03用微粒的观点解释
1.用微粒的观点解释物理变化和化学变化(以分子构成的物质为例)
化学变化的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
2.用微粒的观点解释混合物和纯净物(以分子构成的物质为例)
3.用微粒的观点解释单质和化合物(以分子构成的物质为例)
4.用微粒的观点解释现象:
04 原子的结构
1.原子的构成
2.原子的核外电子的排布
3.原子结构示意图
4.原子结构和元素的化学性质关系
05 离子
1.离子的形成
【易错警示】
(1)形成离子过程中,原子质子数不变,所以原子的种类不变;核外电子数改变,化学性质改变。
(2)金属原子若失去最外层电子,则电子层数减少1层,非金属原子得到电子,电子层数不改变。
2.离子与原子的区别和联系
06 相对原子质量
1.相对原子质量
2.原子质量与相对原子质量的比较
【易错警示】
(1)相对原子质量不等于原子的实际质量,它是个比值;无质量单位。
(2)原子的实际质量越大,其相对原子质量就越大。
(3)两种原子的相对原子质量之比等于它们的实际质量之比。
(4)质子、中子的质量大约相等(相对质量都约等于1),电子的质量很小,可忽略不计,故原子的质量主要集中在原子核上。
07 元素和元素符号
1.元素
【易错警示】
1.元素的化学性质与相应原子的最外层电子数密切相关。
2.一般情况下,两种元素,若属于同一类别,对应的原子最外层电子数相等,则化学性质相似。
如:氧元素和硫元素,对应的氧原子和硫原子最外层电子数都是6,则氧元素与硫元素化学性质相似
3.氢元素与钠元素化学性质不相似。钠原子易失去电子,氢原子不太易失去电子。
4.氦元素与镁元素化学性质也不相似。镁原子易失去2个电子,氦原子既不易失电子,也不易得电子。
2.元素符号:
08 元素周期表
【易错警示】
(1)原子的电子层数=元素所在周期数;电子层数相同的原子在同一周期。
(2)最外层电子数=所在主族数;最外层电子数相同的原子在同一主族。
分子
原子
离子
概念
由分子构成的物质,分子是保持物质化学性质的最小粒子
原子是化学变化中的最小粒子
带电的原子或原子团
图像
或
模型
常见
物质
O2、H2、N2、Cl2、CO 、CO2、H2O、H2O2、 C60、甲烷、酒精、葡萄糖等
金属(如Fe、Cu)、金刚石(C)、硅(Si)、稀有气体(如He、Ne)等
氯化钠(NaCl由Na+和Cl-构成)、硫酸铜(CuSO4由Cu2+和SO42-构成)
原子
分子
定义
原子是化学变化中的最小粒子
分子是保持物质化学性质的最小粒子
区别
在化学变化中不能再分
在化学变化中可以再分
相同点
①原子、分子都很小,但都有一定的质量和体积;
②原子、分子之间有间隔;
③原子、分子总是不停地运动;
④都是构成物质的基本粒子,有些物质由分子构成,有些物质是由原子直接构成的;
⑤都能保持由它们构成的物质的化学性质
联系
分子、原子都是构成物质的粒子;分子是由原子构成的,分子可分裂成原子,原子经过组合可构成分子
实验步骤
步骤1:
在盛有约40ml 蒸馏水的烧杯中加如5一6滴酚酞试液,搅拌均匀,观察现象
步骤2:
取步骤I得到的溶液,置于试管中,再向其中滴加浓氨水,观察现象
步骤3:
将烧杯中的溶液分别倒入A、B两个小烧杯中,另取一个小烧杯C,加入约5ml 浓氨水。用一个大烧杯罩住A,C两个小烧杯,烧杯B 置于大烧杯外
实验
图示
现象
无明显现象
溶液颜色由无色变为红色
A烧杯中酚酞溶液变红;
B烧杯中无明显变化
结论
水不能使酚酞变色
浓氨水能使酚酞变色
分子在不断地运动
解释
A烧杯变红原因:浓氨水具有挥发性,挥发出的氨气分子运动到B烧杯中溶于水,形成氨水使酚酞变红。B烧杯不变色原因:不同分子的运动速率不同。
物理变化
化学变化
宏观
没有其他物质生成
有其他物质生成
微观
分子种类没有改变
分子分成原子,原子又结合成新分子
混合物
纯净物
宏观
含有两种或两种以上的物质,如空气
只含有一种物质,如氧气
微观
含有多种分子,如空气中含有氧气分子、氮气分子、二氧化碳分子等
只含有一种分子,如氧气中只含有氧分子一种分子
单质
化合物
宏观
含有同种元素的纯净物,如氧气、氮气
含有不同种元素的纯净物,如二氧化碳、水
微观
分子中只含有一种原子,如氧气分子只含氧原子,氮气分子只含氮原子
分子中含有两种或多种原子,如二氧化碳分子中含有氧原子和碳原子
原因
分子(原子)在不断运动
温度越高,分子运动越快
分子(原子)间有间隔
常见现象
湿衣服的晾干、闻到花香、红墨水在水中的扩散、煤堆在墙角一段时间后墙变黑等
湿衣服晾在太阳下比阴凉处干得快,夏天比冬天干得快
物质的三态变化、热胀冷缩现象、气体能被压缩、水和酒精混合后体积小于原来两者体积之和、体温计工作原理等
原子的构成
原子由居于原子中心的带正电的原子核和核外带负电的电子构成,
原子核由带正电的质子和不带电的中子构成。
原子不显电性的原因
原子核带的正电荷数与核外电子带的负电荷数相等,但电性相反。
一般规律
(1)在原子中,核电荷数=质子数=核外电子数
(2)不同种类的原子质子数不同
(3)原子中质子数不一定等于中子数
(4)并不是所有原子的原子核中都有中子。例如:氢原子核中无中子
电子层
电子运动没有固定的轨道,但在原子核外一定的区域内运动,这些区域成为“电子层”。
离核最近的为第一层,依次为第二层、第三层…。
核外电子的分层排布
在多电子原子中,电子能量不同,能量越低,离核越近,能量越高,离核越远。
核外电子排布的规律
①核外电子总是尽量排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层,以此类推。
②第一层最多为2个电子,第二层最多为8个电子;
③最外层电子数不超过8个电子(若第一层为最外层时,不超过2个电子)
圆圈内的数字
表示原子核的质子数
“+”号
表示原子核带正电性
弧线
表示电子层
弧线上的数字
表示该电子层上的电子数
注意点
圆圈内的数字等于弧线上的数字之和(核内质子数=核外电子数)
原子
原子的最外层电子数特点
得失电子
元素性质
稀有气体原子
8个(He为2个)
既不得电子,也不失电子
比较稳定
金属原子
一般少于4个
易失去电子
不稳定
非金属原子
一般多于4个
易得到电子
不稳定
定义
带电的原子(或原子团)叫离子
形成
分类
阳离子
带正电的原子(或原子团),如H+、NH4+
阴离子
带负电的原子(或原子团),如Cl−、CO32-
离子符号
书写
在元素符号右上角标出离子所带电荷数,如Al3+、O2−
含义
离子结构
示意图
阳离子
圆圈内数字大于弧线上数字之和,如镁离子结构示意图
阴离子
圆圈内数字小于弧线上数字之和,如氧离子结构示意图
原子
离子
阳离子
阴离子
结构
质子数=电子数
质子数〉电子数
质子数〈电子数
电性
不带电
带正电
带负电
联系
定义
以一种碳原子的质量的1/12作为标准,其他原子的质量与它相比较所得的比,就是这种原子的相对原子质量。
表达式
符号
Ar
单位
相对原子质量是一个 “比值”,单位为“1” ,通常省略不写。
近似计算
相对原子质量≈质子数+中子数
原子质量
相对原子质量
来源与性质
实际测出来的,绝对值
比较得出的,相对值
数值
非常小,10-26~10-27级
大于或等于1
单位
有单位,如“克”“千克”等
有单位,为“1”,省略不写
定义
具有相同质子数(或核电荷数)的一类原子的总称。
“同一类原子”包括:
= 1 \* GB3 ①质子数相同,中子数不同的原子。如:质子数为1中子数分别为0、1、2的三种氢原子都属于氢元素
= 2 \* GB3 ②质子数相同的原子和简单离子。如:Na和Na+属于同种元素。
种类
元素的种类由原子的质子数决定。
质子数不同,元素种类就不同;
不同种元素的本质区别:质子数不同
化学性质
元素的化学性质由原子的最外层电子数决定
相对稳定结构:最外层电子数为8(只有一层则为2)
= 1 \* GB3 ①达到相对稳定结构的原子:其元素的化学性质相似,都不活泼;
= 2 \* GB3 ②未达到相对稳定结构的原子:若都为同一类原子,最外层电子数相同,化学性质相似,若不是同一类原子,则不好比较(即同类相同才相似)
存在形式
= 1 \* GB3 ①单质形式
= 2 \* GB3 ②化合物形式
如:氧元素以单质形式存在于O2中,又以化合物形式存在于SO2、CO2、H2O、KMnO4等物质中
分类
= 1 \* GB3 ①金属元素:“钅”字旁(汞和金除外)
= 2 \* GB3 ②非金属元素:“石”“氵”字旁,“气”字头等
= 3 \* GB3③稀有气体元素:“气”字头
含量
地壳中含量前四位的元素: O、Si、Al、Fe
人体中含量前三位的元素: O、C、H
空气中前两位的元素: N、O
海水中前四位的元素:O、H、Cl、Na
元素符号书写
由一个字母表示的元素符号要大写;由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
元素符号含义
宏观
表示一种元素
微观
表示该元素的一个原子
特殊
某些由原子构成的物质,元素符号还表示物质
如H:表示氢元素,一个氢原子;
Fe:表示铁元素,一个铁原子,铁这种物质
数字+元素符号
只表示微观意义:几个原子。
如5O:表示5个氧原子; 3Ne:3个氖原子。
编制者
门捷列夫
原子序数
元素周期表按元素原子核电荷数递增的顺序给元素编号。
原子序数=质子数=核电荷数=核外电子数
横行(周期)
元素周期表有7个横行,每一横行元素的电子层数相同,最外层电子数从左到右由1依次增加至8,元素种类从金属元素→非金属元素→稀有气体元素(第一周期除外)
纵列(族)
同一纵列元素的最外层电子数相同,电子层数依次增加,共有18个纵列,16个族(8、9、10三个纵列共同组成1个族)
每一格
相关学案
这是一份第3章《物质构成的奥秘》-2024-2025学年九年级化学上学期期末复习考点清单(沪教版·全国),共4页。学案主要包含了易错警示等内容,欢迎下载使用。
这是一份第五单元《化学方程式》-2024-2025学年九年级化学上学期期末复习考点清单(人教版),共6页。学案主要包含了易错警示等内容,欢迎下载使用。
这是一份第七单元《燃料及其利用》-2024-2025学年九年级化学上学期期末复习考点清单(人教版),共6页。学案主要包含了易错警示等内容,欢迎下载使用。








