

选择性必修2本章复习导学案
展开
这是一份选择性必修2本章复习导学案,共48页。学案主要包含了单元知识清单等内容,欢迎下载使用。
考点1 氢原子结构模型
原子核外电子运动模型的历史发展过程
一、道尔顿模型
英国自然科学家约翰·道尔顿提出了世界上第一个原子(1803年)。
理论:①原子都是不能再分的粒子;
②同种元素的原子的各种性质和质量都相同;
③原子是微小的实心球体。
汤姆森的葡萄干面包模型
葡萄干面包模型是1904年约瑟夫·约翰·汤姆森()(英国物理学家)提出的模型,他认为原子是一个带正电荷的球,电子镶嵌在里面,形状酷似“葡萄干布丁”(Plum pudding),也称“枣糕模型”或“葡萄干面包模型”。
汤姆孙、汤姆逊、汤姆生等是不同的教材对人名的音译不同。
三、卢瑟福的行星模型(有核模型)
汤姆森的学生卢瑟福(英国物理学家)完成的α粒子轰击金箔实验(散射实验),否认了葡萄干面包式模型的正确性。
1911年卢瑟福提出行星模型:原子的大部分体积是空的,电子按照一定轨道围绕着一个带正电荷的很小的原子核运转。
行星模型由卢瑟福在提出,以经典电磁学为理论基础,主要内容有:
①原子的大部分体积是空的
②在原子的中心有一个很小的原子核。
③原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部。带负电的电子在核空间进行绕核运动。
四、玻尔的原子结构(能级结构)
1913年玻尔(丹麦物理学家)在卢瑟福的行星模型和普朗克的量子论基础上提出了核外电子分层排布的原子结构模型。
五、现代电子云模型
电子云是1926年奥地利学者薛定谔在德布罗意关系式的基础上,对电子的运动做了适当的数学处理,提出了薛定谔方程,再用三维坐标将解表示出来,就得到了电子云。
原子光谱发展沿袭
一、原子光谱
1、光谱:光谱就是通过棱镜或光栅的分光作用,将一束复色光分解成各种波长的单色光,按照波长或频率大小顺序排列起来形成的图案。
2、连续光谱和线光谱:得到的图案如果是一条连续的亮带,就是连续光谱;得到的图案如果是不连续的亮线,就是线光谱。各元素原子的线光谱就叫做原子光谱。
图中最上一条是连续谱,其他几条则既有线光谱又有连续谱。
气体中中性原子的发光光谱都是线状谱,说明原子只发出几种特定频率的光。不同原子的亮线位置不同,说明不同原子的发光频率是不一样的,因此,这些亮线称为原子的特征谱线。既然每种原子都有自己的特征谱线,我们就可以利用它来鉴别物质和确定物质的组成成分。这种方法称为光谱分析。
微观粒子既有波动性又有粒子性,描述宏观物体运动的经典力学不适用于描述微观粒子的运动。
3、原子光谱的形成和种类
二、玻尔的原子结构模型
1、波尔原子结构模型的主要观点:
(1)原子中的电子只能在某些确定半径的圆周轨道上运绕原子和运动,这些轨道称为定态轨道;
(2)在不同定态轨道上运动的电子具有不同的能量(E),而且能量是量子化①的,即轨道能量是“一份一份”地增加或减少的。轨道能量与n值有关。n的取值为正整数1、2、3、、∞,n值越小,电子离核越近;反之能量就越高。一般把原子能量最低的电子状态称为基态②。对于氢原子而言,当核外的一个电子处于n = 1的轨道时能量最低,这个状态就称为氢原子的基态;当这个电子跃迁至n > 1的轨道上运动时,这些状态称为氢原子的激发态②。
(3)电子在不通过能量的两个轨道之间发生跃迁时,才会辐射或吸收能量。如果电子从高能量的轨道跃回低能量轨道,就会以光的形式释放出这些能量,光辐射的波长(λ)与两个轨道的能量差(ΔE)有关。
——相关概念解释:
①量子化:玻尔认为能量是量子化的,即能量是以一个微小单位的形式存在和转播的;
②基态和激发态:
基态:基态是指在正常状态下,原子处于最低轨道,这时电子在离核最近的轨道上运动的这种定态。
激发态:激发态一般是指电子激发态,原子或分子吸收一定的能量后,电子被激发到较高轨道但尚未离开原子的状态。
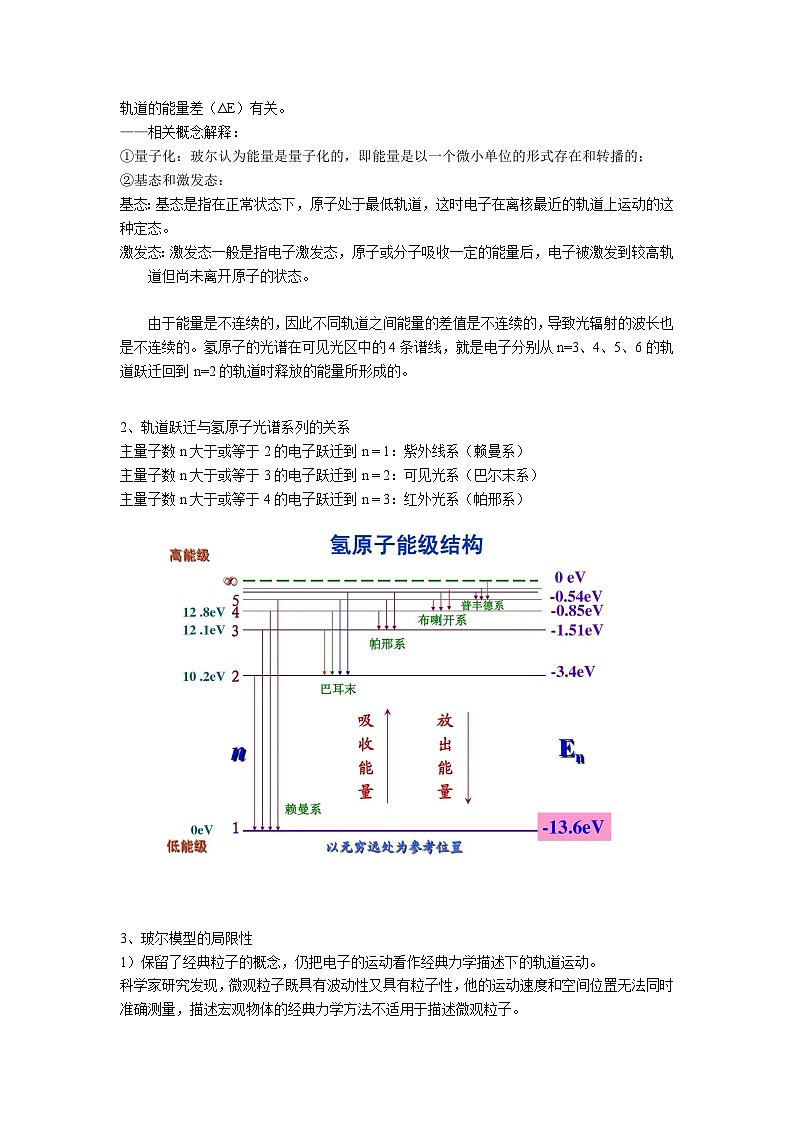
由于能量是不连续的,因此不同轨道之间能量的差值是不连续的,导致光辐射的波长也是不连续的。氢原子的光谱在可见光区中的4条谱线,就是电子分别从n=3、4、5、6的轨道跃迁回到n=2的轨道时释放的能量所形成的。
2、轨道跃迁与氢原子光谱系列的关系
主量子数n大于或等于2的电子跃迁到n = 1:紫外线系(赖曼系)
主量子数n大于或等于3的电子跃迁到n = 2:可见光系(巴尔末系)
主量子数n大于或等于4的电子跃迁到n = 3:红外光系(帕邢系)
3、玻尔模型的局限性
1)保留了经典粒子的概念,仍把电子的运动看作经典力学描述下的轨道运动。
科学家研究发现,微观粒子既具有波动性又具有粒子性,他的运动速度和空间位置无法同时准确测量,描述宏观物体的经典力学方法不适用于描述微观粒子。
2)对稍微复杂一点的原子(多电子原子)如氦原子,就无法解释他的光谱现象。
【思考】
(教材P5)光辐射的波长和电子跃迁时吸收或释放的能量ΔE有关,
ΔE=E2—E1=h·cλ (h =6.626×10—34J·s,为普朗克常数;c =2.997 924 58×108m·s—1,为真空中光速)
请指出氢原子中电子分别从n=5和n=2的轨道跃迁道基态时,哪种光辐射的波长更长。
【答案】n=5对应的轨道与n=2对应的轨道相对比,n=5的轨道能量更高,与n=1轨道的能量差值更大,释放能量更多,ΔE5→1 > ΔE2→1但ΔE与波长λ成反比,故电子从n=2跃迁至n=1(基态)光辐射的波长更长。(规律:主量子数数值越大,相邻主量子数之间差值越小;能量变化越小,波长越长)
(教材P6)每当夜幕降临,华灯初上,五颜六色的灯光就把城市装扮的五彩缤纷。请联系氢原子光谱的成因,说民这些美丽的光是怎样产生的。
【答案】霓虹灯内充有稀有气体,当外电路接通后,变压器输出端会产生几千伏甚至几万伏高压,当这一电压接到霓虹灯两端后,管内带电粒子(电子)就会发生跃迁,发出五颜六色的光。
氢原子结构模型
基本概念
1、原子轨道
当电子处于不同的运动状态时具有的能量是不同的。我们把氢原子中电子的一个空间运动状态称为一个原子轨道。
需要注意的是,此处轨道的含义和玻尔原子结构模型中轨道的含义完全不同,它既不是圆周轨道,也不是其他经典意义上的固定轨迹。
【理解】
玻尔原子模型中的“轨道”是指运行其中的电子每时每刻都有确定的速度、位置、能量和角动量;
本节所提及的“轨道”(属于量子力学中的轨道中的一种)是指一种量子状态,他具有某种特定的能量和角动量(对应于确定的主量子数、角量子数和磁量子数),但其速度和位置都是不能确定的,只有一个概率分布,电子位置的概率分布能够用“电子云”这个概念能够形象的表示出来。
2、能层与能级
电子运动的空间离核的远近是不同的。人们用n表示电子层数,n相同的原子轨道成为一个电子层,n的取值为正整数1、2、3、4、5、6、。
一个电子层也叫做一个能层,和n =1、2、3、4、5、6、的电子层相对应的能层符号分别用K、L、M、N、O、P、表示。当n =1时,K层的电子离核最近,电子的运动状态能量最低;n越大,表示电子离核越远,电子的运动状态能量越高。
n相同的原子轨道,轨道呈现的图像形状可以不同,我们分别用s、p、d、表示不同形状的原子轨道。例如:s轨道是呈球形的,p轨道是呈哑铃形的。
不同形状的原子轨道可能有不同的能量,因此同一能层中的原子轨道,还可以分成不同的能级,如n s、n p、n d、n f等能级。第一能层只有1s一个能级,第二层有2s、2p两个能级。
同一的原子轨道在三维空间坐标系中还可以有不同的伸展方向。
s轨道只有一种空间取向,所以n s只有一个原子轨道。p轨道分别沿x轴、y轴、z轴有三个不同的伸展方向,所以n p有px、py、pz三个原子轨道。d轨道有5个伸展方向,则n d有5个原子轨道。f轨道有7个伸张方向,则n f有七个原子轨道。
如图是s轨道和p轨道的轨道空间伸展方向。
我们将电子层的n值和表示轨道形状的s、p、d、f结合起来表示原子轨道,如1s、2s、2p(2px、2py、2pz)等。
此外,原子核外电子还存在一种被称为“自旋”的运动状态。处于同一原子轨道的电子有两种不同的运动状态,通常用向上箭头“↑”和向下箭头“↓”表示。当然,电子“自旋”并非真像地球绕轴自旋一样,它只是表示电子的两种不同的自旋状态。
原子中的能级按能量由低到高、由下往上排列的示意图叫原子的能级图。在只有一个电子的氢原子中,原子轨道的能量仅与n值有关,因此n相同的原子轨道处于同一能级。
3d
3p
3s
2p
2s
1s
3、电子云
由于微观粒子运动的特性,用统计的方法来了解电子在原子核外空间某处出现的概率大小。
为了方便理解,人们常用小黑点的疏密程度来表示电子在原子核外单位体积内出现的概率大小。
点密集的地方表示电子在单位体积内出现的概率大;点稀疏的地方表示电子在单位体积内出现的概率小。这种对电子在原子核外空间单位体积出现概率大小的形象化描述称为电子云。
下图是1s和2p轨道的电子云空间分布图
1s 轨道上的电子(也称1s电子)在空间出现的概率分布呈球形对称,并且电子在原子核附近单位体积内出现的概率大,离核越远,单位体积内电子的出现概率越小。
处于2p轨道的电子在空间单位体积内出现的的概率是沿着一个坐标轴(x轴、y轴或z轴)对称分布的。
二、原子光谱分析
原子光谱分析法主要包括原子发射光谱分析法和原子吸收光谱分析法。
考点2 能层与能级
1.能层
(1)核外电子按能量不同分成能层并用符号K、L、M、N、O、P、Q…表示。
(2)能层越高,电子的能量越高,能量的高低顺序为E(K)<E(L)<E(M)<E(N)<E(O)<E(P)<E(Q)。
2.能级
(1)定义:根据多电子原子的能量也可能不同,将它们分为不同能级。
(2)表示方法:分别用相应能层的序数和字母s、p、d、f等表示,如n能层的能级按能量由低到高的排列顺序为ns、np、nd、nf等。
(3)能层、能级与最多容纳的电子数
由上表可知:
①能层序数等于该能层所包含的能级数,如第三能层有3个能级。
② s、p、d、f 各能级可容纳的电子数分别为1、3、5、7的2倍。
③原子核外电子的每一能层最多可容纳的电子数与能层的序数(n)间存在的关系是2n2。
【注】(1)不同能层之间,符号相同的能级的能量随着能层数的递增而增大。
(2)在相同能层各能级能量由低到高的顺序是ns
相关学案
这是一份高中化学沪科技版(2020)选择性必修3本章复习学案及答案,共53页。学案主要包含了单元知识清单,教学建议,核心归纳,糖类的结构和组成,教学参考等内容,欢迎下载使用。
这是一份沪科技版(2020)选择性必修1本章复习学案设计,共58页。学案主要包含了单元知识清单,教学建议等内容,欢迎下载使用。
这是一份高中化学沪科技版(2020)必修第二册第5章 金属及其化合物本章复习学案设计,共38页。学案主要包含了金属铝,化学反应速率等内容,欢迎下载使用。










