


所属成套资源:【备战2025年学考】高中化学学业水平合格性考试总复习(全国通用)模拟卷+专题训练(知识清单+考点精炼)教师版+学生版
第05讲 原子结构与元素周期表-2025年高中化学学业水平合格性考试总复习(全国通用).zip
展开
这是一份第05讲 原子结构与元素周期表-2025年高中化学学业水平合格性考试总复习(全国通用).zip,文件包含第05讲原子结构与元素周期表原卷版docx、第05讲原子结构与元素周期表解析版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
1、了解原子结构与元素性质的关系。
2、知道周期与族的概念,能描述元素周期表的结构,理解元素周期表结构与原子结构的关系。
3、规范表达1~18号元素在周期表中的位置。
4、依据元素周期表及元素周期律判断有关物质的性质。
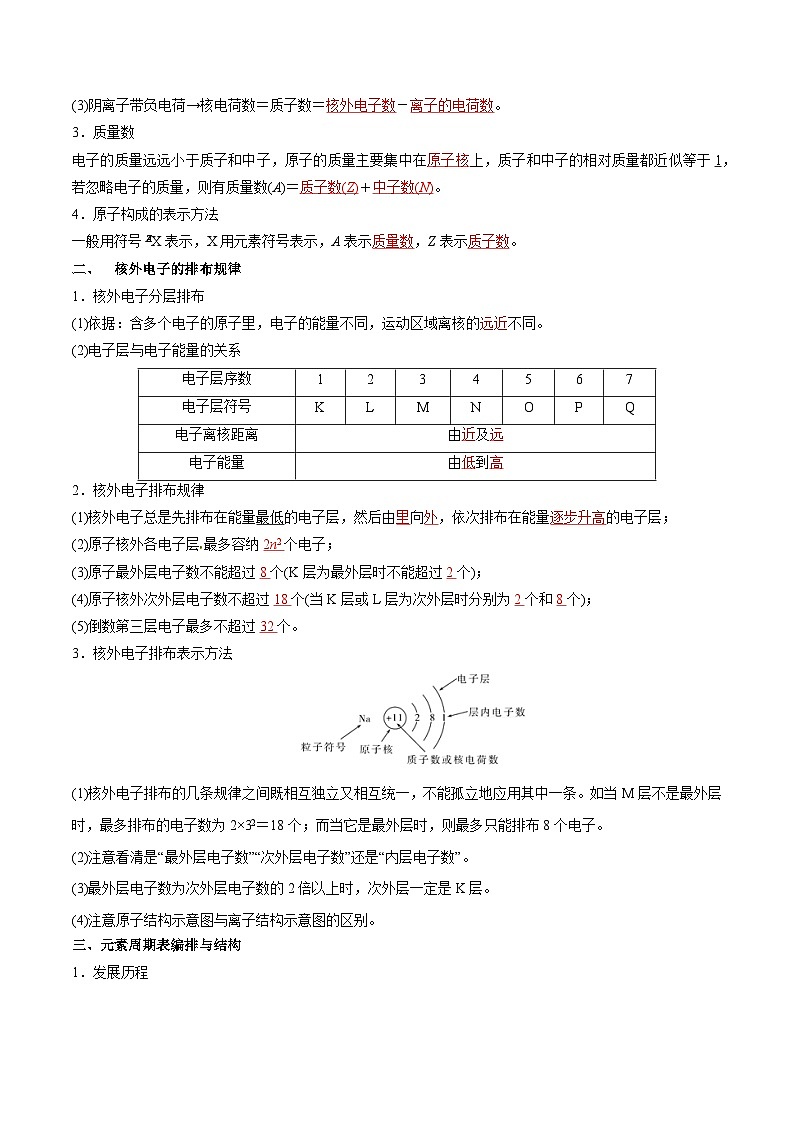
一、原子的构成源:学§科§网]
1.构成原子的微粒
原子核的构成一定有质子,有质子的微粒不一定有中子,如1H;有质子的微粒不一定有电子,如H+。
2.微粒的核电荷数、质子数和核外电子数的关系:
(1)原子呈电中性→核电荷数=质子数= 。
(2)阳离子带正电荷→核电荷数=质子数= + 。
(3)阴离子带负电荷→核电荷数=质子数= - 。
3.质量数
电子的质量远远小于质子和中子,原子的质量主要集中在 上,质子和中子的相对质量都近似等于1,若忽略电子的质量,则有质量数(A)= + 。
4.原子构成的表示方法
一般用符号eq \\al(A,Z)X表示,X用元素符号表示,A表示 ,Z表示 。
二、 核外电子的排布规律
1.核外电子分层排布
(1)依据:含多个电子的原子里,电子的能量不同,运动区域离核的远近不同。
(2)电子层与电子能量的关系
2.核外电子排布规律
(1)核外电子总是先排布在能量最低的电子层,然后由 向 ,依次排布在能量 的电子层;
(2)原子核外各电子层最多容纳 个电子;
(3)原子最外层电子数不能超过 个(K层为最外层时不能超过 个);
(4)原子核外次外层电子数不超过 个(当K层或L层为次外层时分别为 个和 个);
(5)倒数第三层电子最多不超过 个。
3.核外电子排布表示方法
(1)核外电子排布的几条规律之间既相互独立又相互统一,不能孤立地应用其中一条。如当M层不是最外层时,最多排布的电子数为2×32=18个;而当它是最外层时,则最多只能排布8个电子。
(2)注意看清是“最外层电子数”“次外层电子数”还是“内层电子数”。
(3)最外层电子数为次外层电子数的2倍以上时,次外层一定是K层。
(4)注意原子结构示意图与离子结构示意图的区别。
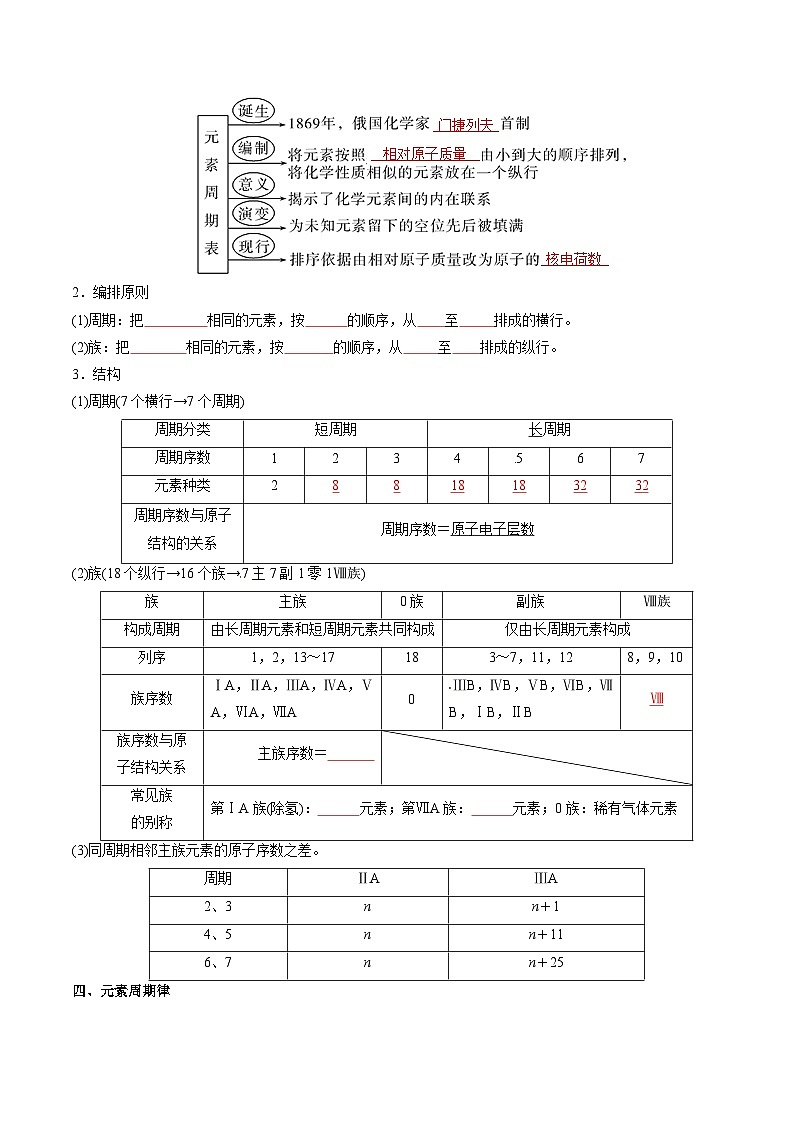
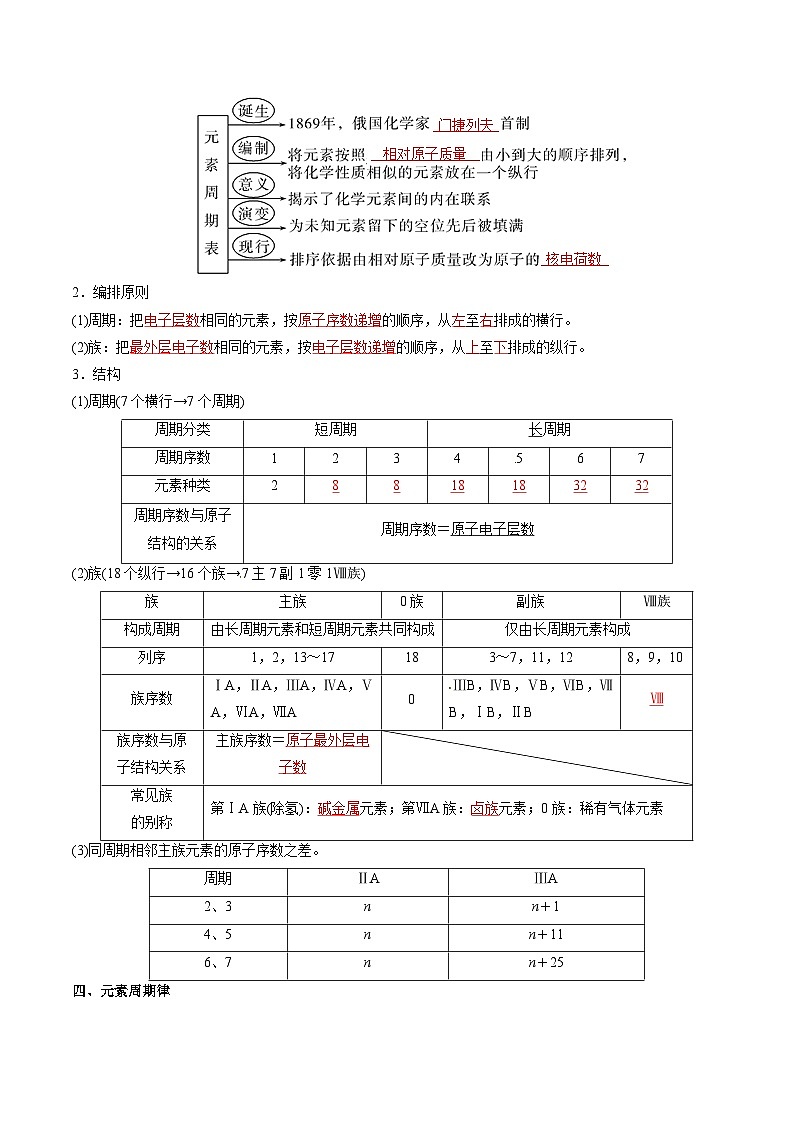
三、元素周期表编排与结构
1.发展历程
2.编排原则
(1)周期:把 相同的元素,按 的顺序,从 至 排成的横行。
(2)族:把 相同的元素,按 的顺序,从 至 排成的纵行。
3.结构
(1)周期(7个横行→7个周期)
(2)族(18个纵行→16个族→7主7副1零1Ⅷ族)
(3)同周期相邻主族元素的原子序数之差。
四、元素周期律
1.同周期元素原子的核外电子排布、原子半径和化合价的变化规律
(1)随着原子序数的递增,元素原子的最外层电子数 _、原子半径逐渐 、化合价最高正价和负价逐渐 (第ⅣA族出现负价),都呈周期性的变化。
【特别提醒】
(1)F无正价,O无最高正价;(2)金属只有正价,只有非金属才有负价。
2.同周期元素金属性和非金属性的变化规律
(1)Na、Mg、Al的比较
(2)Si、P、S、Cl的比较
(3)结论:随着原子序数的递增,同周期主族元素的金属性逐渐 、非金属性逐渐 ,呈现周期性的变化。
理论解释:在同一周期中,各元素的原子核外电子层数虽然相同,但从左到右,核电荷数依次 ,原子半径逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此元素的金属性逐渐减弱、非金属性逐渐增强。
3.同周期元素原子结构和元素性质变化规律
元素的性质随着原子序数的递增而呈现 变化的规律。实质是 发生周期性变化的必然结果。
考点一 原子的构成
【典型例题】
【例1】(2024高二下·江苏·学业考试)俗名往往反映了物质的组成、性质或用途。下列对物质俗名的理解不正确的是
A.臭氧:具有腥臭味B.双氧水:1个分子中有2个氧原子
C.铁红:呈红色D.烧碱:具有可燃性
【例2】(2024高二上·福建·学业考试)医疗上可用液氮冷冻麻醉。氮气液化过程发生改变的是
A.元素种类B.分子间距C.原子数目D.化学键
【例3】(2023高一下·吉林·学业考试)下列关于原子的说法中,不正确的是
A.质子数是6B.质量数是14C.中子数是8D.电子数是12
【即时演练】
1.(2023高二上·江苏徐州·学业考试)下列化学用语表示正确的是
A.钠原子的结构示意图:B.的结构式:Cl-Cl
C.的电子式:D.NaClO的名称:氯酸钠
2.(2024高一下·北京·学业考试)某元素原子的结构示意图为,由此得到的结论不正确的是
A.该原子有3个电子层B.该元素属于金属元素
C.该元素属于短周期元素D.该元素的最高正化合价为+6
3.(2023高一下·天津河东·学业考试)下列有关化学用语的表示正确的是
A.质子数为17、中子数为20的氯原子:B.二氧化碳分子的结构式:
C.氯分子的电子式: D.氯离子()的结构示意图:
考点二 原子核外电子的排布
【典型例题】
【例1】(2024高一下·浙江绍兴·学业考试)下列说法不正确的是
A.CCl4、C2H4、SiO2都是共价化合物
B.SO2溶于水时,需克服共价键和分子间作用力
C.某物质在熔融状态能导电;则该物质中一定含有离子键
D.CO2和N2中,每个原子的最外层都具有8电子稳定结构
【例2】(2023高二上·江苏徐州·学业考试)O、S原子结构相同的是
A.中子数B.电子层数C.最外层电子数D.核电荷数
【例3】(2024高一下·天津红桥·学业考试)某元素R的原子结构示意图为,下列关于该原子的说法正确的是
A.原子在化学反应中易得到7个电子
B.元素位于周期表中第三周期
C.属于金属元素
D.最高价氧化物化学式为R7O2
【即时演练】
1.(2023高一上·广东·学业考试)和是铜的两种稳定同位素,被应用于环境示踪。和具有
A.相同质量数B.相同质子数C.相同中子数D.不同电子数
2.(2024高二上·江苏泰州·学业考试)是重要的核工业原料。下列有关说法正确的是
A.与互为同位素B.与互为同素异形体
C.含有92个中子D.核外有143个电子
3.(2023高二·四川·学业考试)某微观粒子的结构示意图为 ,下列关于该粒子的说法错误的是
A.核电荷数为16B.核外有3个电子层
C.属于非金属原子D.在化学反应中容易失去6个电子
考点三 元素周期表
【典型例题】
【例1】(2024高一下·浙江温州·学业考试)短周期元素X、Y、Z、M在周期表中的位置如图所示,已知Y的原子序数是X的2倍。下列说法正确的是
A.元素的最高正价:X>MB.氢化物的稳定性:Y>X
C.离子半径:Z>YD.M的最高价氧化物的水化物是中强酸
【例2】(2024高二下·北京·学业考试)某元素的原子结构示意图为,下列关于该元素的说法不正确的是
A.元素符号是SB.属于短周期元素
C.非金属性比氧的强D.加热条件下,其单质能与铁反应
【例3】(2023高一下·北京·学业考试)某元素的原子结构示意图为。下列关于该元素的说法中,不正确的是
A.元素符号是PB.属于短周期元素C.非金属性比硫的强D.最高正化合价是价
【即时演练】
1.(2023高一·辽宁鞍山·学业考试)下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③与氢元素能组成日常生活中常见的化合物。
②元素和③元素形成的氢化物,其稳定性的强弱顺序为
A.②大于③B.②小于③C.②等于③D.不确定
2.(2023高一·辽宁鞍山·学业考试)下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③与氢元素能组成日常生活中常见的化合物。
③元素和④元素形成常见离子化合物的化学式为
A.NaOB.NaO2C.NaO或Na2O2D.Na2O或Na2O2
3.(2023高一下·浙江·学业考试)X、Y、Z、W为短周期元素,如下表所示,其中W原子的最外层电子数是其内层电子的。下列说法不正确的是
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为W>Z>Y>X
D.最高价氧化物对应水化物的酸性:W>Z
考点四 元素周期表
【典型例题】
【例1】(2024高二·江苏南通·学业考试)短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期,且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径: r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的简单气态氢化物的热稳定性比Z的强
D.X、Y、Z 三种元素可以组成共价化合物,也可以组成离子化合物
【例2】(2024高一下·浙江·学业考试)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。X的最外层电子是内层电子的2倍,Z是地壳中含量最多的元素,Q是纯碱中的一种元素。下列说法不正确的是
A.X的简单气态氢化物呈正四面体形
B.最高正价:ZX
【例3】(2023高一下·浙江·学业考试)X、Y、Z、W四种短周期主族元素,其相对位置如图所示,Y原子最外层电子数是内层的2倍,Z原子在同周期中原子半径最大。下列说法不正确的是
A.最高化合价:W>X
B.原子半径:Z>Y
C.非金属性:Z>W
D.Z2Y2中存在离子键
【即时演练】
1.(2023高二·江苏扬州·学业考试)7N、8O、11Na、13Al、16S 、17Cl是元素周期表中的短周期主族元素,下列说法正确的是
A.气态氢化物的热稳定性:H2O < H2S
B.原子半径:r(N) < r(O)
C.碱性强弱:NaOH < Al(OH)3
D.非金属性:S < Cl
2.(2023高一下·浙江温州·学业考试)短周期主族元素W、X、Y、Z、Q的原子序数依次增大,W只有一个质子,W、Y同主族。X无最高正价,Z的原子序数是X的两倍。下列说法不正确的是
A.原子半径:
B.简单阳离子的得电子能力:
C.最高价氧化物对应水化物的酸性:
D.W、X、Y三种元素形成的化合物中只含离子键
3.(2023高一下·黑龙江·学业考试)短周期元素的离子aW2+、bX+、cY2-、dZ-都具有相同的电子层结构,下列推断正确的是
A.原子半径:W>X>Z>YB.离子半径:Y2->Z->X+>W2+
C.a+2=c-2D.热稳定性:H2Y>HZ
1.(2024高二下·江苏盐城·学业考试)X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M电负性最小,Z与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正确的是
A.沸点:B.M与Q可形成化合物,
C.键角大小:D.与离子空间结构均为三角锥形
2.(2023高二·江苏南京·学业考试)海水晒盐得到NaCl与卤水。氯碱工业电解饱和NaCl溶液得到Cl2和NaOH,Cl2与NaOH溶液反应可制取漂白剂;以NaCl、NH3、CO2等为原料可得到NaHCO3,NaHCO3可用于治疗胃酸过多。利用Cl2的氧化性可提取卤水中的溴元素,Br和Cl都位于元素周期表VIIA族,Br位于Cl的下一周期;从卤水中也可提取镁。下列化学用语表示正确的是
A.镁原子的结构示意图:B.Cl2的结构式:Cl–Cl
C.NH3的电子式:D.NaClO的名称:氯酸钠
3.(2022高二·江苏南京·学业考试)短周期主族元素X、Y、Z的原子序数依次增大,X与Z位于同一主族,Z的单质在常温下是黄绿色气体,Y原子的最外层只有一个电子。下列说法正确的是
A.X原子易失去电子
B.原子半径:r(Z)>r(Y)>r(X)
C.Y的最高价氧化物的水化物是弱碱
D.Z的简单气态氢化物的热稳定性比X的弱
4.(2022高二上·江苏盐城·学业考试)X、Y、Z、W是周期表中前20号元素,且原子序数依次增大。X的一种核素在考古时常用来鉴定一些文物的年代,Y原子最外层电子数是其内层电子数的3倍,Z元素的最高正化合价与最低化合价代数和为零,W元素原子最外层只有一个电子。下列说法正确的是
A.Z的氧化物是一种重要的半导体材料B.Y跟W只能形成一种氧化物
C.X与Z为同主族元素D.原子半径:
5.(2022高二上·江苏扬州·学业考试)人体中含、、、等元素,它们均为短周期中的主族元素。下列说法正确的是
A.原子半径:
B.非金属性:
C.最高价氧化物的水化物的酸性:
D.碳原子可以形成四对共用电子对,原子间连接方式多样
6.(2022高一下·天津红桥·学业考试)“月壤”中含有He,该原子的中子数是
A.1B.2C.3D.5
7.(2022高二·江苏南通·学业考试)X、Y、Z、W属于1~20号元素且原子序数依次增大。X与Z同主族,Y与W同主族。X原子的最外层电子数是其内层电子数的3倍,Y在同周期主族元素中原子半径最大。下列说法正确的是
A.金属性:Y>WB.原子半径:r(X)>r(Y)>r(Z)
C.简单气态氢化物的热稳定性:Z>XD.W位于周期表第四周期ⅠA族
8.(2021高二上·江苏徐州·学业考试)碘是人体必需的微量元素。碘的一种核素是I,该原子的中子数是
A.74B.53C.127D.180
9.(2024高一下·湖南株洲·学业考试)下列叙述不正确的是
A.锂、钠、钾原子的电子层数依次增多
B.氮、氧、氟元素非金属性依次减弱
C.钠、镁、铝元素最高化合价依次升高
D.磷、硫、氯元素最高价氧化物对应的水化物酸性依次增强
10.(2021高一下·湖北·学业考试)对月球的探索研究发现,月球土壤中含有比较丰富的,该原子符号中的“3”指的是
A.质子数B.中子数C.电子数D.质量数
11.(2023高一下·天津河东·学业考试)下列属于短周期元素的是
A.B.C.D.I
12.(2022高二下·浙江·学业考试)下表是元素周期表的一部分,①~⑥代表6种短周期主族元素,已知③与氢元素能组成日常生活中常见的化合物。
下列说法正确的是
A.①~⑥中原子半径最大的是④B.②的最高化合价为+4
C.④的金属性比⑤的金属性弱D.⑥的最高价氧化物对应水化物是弱酸
13.(2022高二·内蒙古·学业考试)X、Y是常见的短周期主族元素,X的阳离子与Y的阴离子具有相同的电子层结构。关于X、Y的比较中,正确的是
①原子序数:X>Y②原子半径:XY
A.①②B.②③C.①④D.②④
14.(2020高二·辽宁·学业考试)今年是门捷列夫发现周期表150年。短周期元素R、T、Q、W在元素周期表中的相对位置如下所示,其中Q为硅元素。下列关于Q元素的叙述错误的是
A.晶体硅可用于制作光导纤维
B.硅在周期表中位于第三周期第IVA族
C.使用量最大的无机非金属材料—陶瓷、玻璃、水泥,属于硅酸盐产品
D.石英、玛瑙的主要成分是二氧化硅
15.(2019高二上·江苏连云港·学业考试)短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子最外层有2个电子,Z单质晶体是一种重要的半导体材料,W与X位于同一主族。下列说法正确的是( )
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.W的最高价氧化物对应水化物的酸性比Z的强目录
TOC \ "1-2" \h \u \l "_Tc28996" 明晰学考要求 PAGEREF _Tc28996 1
\l "_Tc7075" 基础知识梳理 PAGEREF _Tc7075 1
\l "_Tc9026" 考点精讲精练 PAGEREF _Tc9026 9
\l "_Tc3237" 考点一 原子的构成 PAGEREF _Tc3237 9
\l "_Tc13123" 考点二 核外电子的排布 PAGEREF _Tc13123 10
\l "_Tc4718" 考点三 元素周期表 PAGEREF _Tc4718 12
\l "_Tc26424" 考点四 元素周期律 PAGEREF _Tc26424 14
\l "_Tc27562" 实战能力训练 PAGEREF _Tc27562 15
构成原子
的粒子
原子核
电子
质子
中子
电性和电量
1个质子带1个单位的
不带电显 性
1个电子带1个单位的
电子层序数
1
2
3
4
5
6
7
电子层符号
K
L
M
N
O
P
Q
电子离核距离
由 及
电子能量
由 到
周期分类
短周期
长周期
周期序数
1
2
3
4
5
6
7
元素种类
2
8
8
18
18
32
32
周期序数与原子结构的关系
周期序数=原子电子层数
族
主族
0族
副族
Ⅷ族
构成周期
由长周期元素和短周期元素共同构成
仅由长周期元素构成
列序
1,2,13~17
18
3~7,11,12
8,9,10
族序数
ⅠA,ⅡA,ⅢA,ⅣA,ⅤA,ⅥA,ⅦA
0
ⅢB,ⅣB,ⅤB,ⅥB,ⅦB,ⅠB,ⅡB
Ⅷ
族序数与原
子结构关系
主族序数=
常见族
的别称
第ⅠA族(除氢): 元素;第ⅦA族: 元素;0族:稀有气体元素
周期
ⅡA
ⅢA
2、3
n
n+1
4、5
n
n+11
6、7
n
n+25
Na
Mg
Al
变化规律(同
周期:左→右)
单质与水(或酸)反应
与冷水剧
烈反应,生成H2
与冷水几乎不反应,与沸水 反应,生成H2;与酸反应 ,生成H2
与酸反应 ,生成H2
从水或酸中置换H2能力逐渐减弱
最高价氧化物对应水化物的碱性强弱
NaOH
碱
Mg(OH)2
碱
Al(OH)3
氢
氧化物
最高价氧化物对应水化物的碱性逐渐减弱
Si
P
S
Cl
变化规律(同周
期:左→右)
单质与氢气
反应的条件
较高
温度
加热
光照或
点燃
与H2化合能
力逐渐增强
气态氢化物
的热稳定性
SiH4
PH3
H2S
HCl
氢化物稳定
性逐渐增强
最高价氧化
物对应水化
物的酸性强弱
H2SiO3|
H3PO4
酸
H2SO4
酸
HClO4强
酸(比
H2SO4
)
最高价氧化物
对应的水化物
酸性逐渐增强
内容
同周期从左到右(0族除外)
原子结构
电子层数相同,最外层电子数1个→7个(第一周期除外),原子半径逐渐减小
元素性质
原子得失电子能力
失电子能力 ,得电子能力
金属性和非金属性
金属性 ,非金属性
单质性质
还原性 ,氧化性
离子性质
阳离子氧化性 ,阴离子还原性
主要化合价
最高正价:+1→+7(O、F除外)
最低负价:-4→-1
非金属气态氢化物的形成与性质
生成由难到易, 增强, 减弱
最高价氧化物对应水化物的酸碱性
增强, 减弱
X
M
Y
Z
①
②
③
④
⑤
⑥
①
②
③
④
⑤
⑥
X
Y
Z
W
①
②
③
④
⑤
⑥
S
R
A
T
Q
W
相关试卷
这是一份第18讲 化学实验基础-2025年高中化学学业水平合格性考试总复习(全国通用).zip,文件包含第18讲化学实验基础备战2024年高中学业水平考试化学真题分类汇编新教材通用原卷版docx、第18讲化学实验基础备战2024年高中学业水平考试化学真题分类汇编新教材通用解析版docx等2份试卷配套教学资源,其中试卷共53页, 欢迎下载使用。
这是一份第16讲 乙烯 苯 乙醇 乙酸-2025年高中化学学业水平合格性考试总复习(全国通用).zip,文件包含第16讲乙烯苯乙醇乙酸备战2024年高中学业水平考试化学真题分类汇编新教材通用原卷版docx、第16讲乙烯苯乙醇乙酸备战2024年高中学业水平考试化学真题分类汇编新教材通用解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份第11讲 硫及其化合物 -2025年高中化学学业水平合格性考试总复习(全国通用).zip,文件包含第11讲硫及其化合物原卷版docx、第11讲硫及其化合物解析版docx等2份试卷配套教学资源,其中试卷共38页, 欢迎下载使用。










