
2020-2021学年广东省广州市越秀区九年级(上)期末化学试卷(含答案)
展开
这是一份2020-2021学年广东省广州市越秀区九年级(上)期末化学试卷(含答案),共27页。
A. B.
C. D.
5.(3 分)下列有关实验要求,正确的是()
A.过滤时液面要低于滤纸的边缘B.闻药品气味要将鼻孔凑到容器口C.实验剩余药品要放回原试剂瓶D.实验废液要直接倒入下水道
6.(3 分)下列有关元素的说法,正确的是()
A.地壳中含量最多的是铝元素B.带金字旁的字属于金属元素
C.碳元素和硫元素最根本的区别是它们的相对原子质量不同D.氯元素的化学性质与其原子最外层电子数关系最密切
选或涂改不清的,均不给分)
1.(3 分)空气中的下列物质,常用作保护气的是(
)
A.N2B.O2C.H2O
2.(3 分)下列物质,属于氧化物的是()
D.CO2
A.KClO3B.H2CO3C.干冰
3.(3 分)下列净化水的方法中,净化程度最高的是(
)
D.生铁
A.静置B.吸附C.过滤
D.蒸馏
4.(3 分)如图实验操作,正确的是()
7.(3 分)如图为周期表中钠元素的信息及其粒子的结构示意图,下列说法正确的是()
在周期表中钠元素排在第 23 位
a=12
该粒子带正电,由钠原子失去电子形成D.该粒子的质量约是一个碳原子质量的 23 倍
8.(3 分)维生素 D2(C28H44O)有促进新骨生成和钙化的功能。下列关于维生素 D2 的说法正确的是()
A.维生素 D2 中 C、H、O 三种元素的质量比为 28:44:1
B.1 个维生素 D2 分子由 28 个碳原子、44 个氧原子、1 个氢原子构成
C.维生素 D2 的相对分子质量为 386
D.维生素 D2 中氢元素的质量分数计算式为×100%
9.(3 分)某种火箭在发射时其燃料发生反应 N2O4+2X3N2+4H2O;其中的反应物 X 是()
A.N2OB.N2H4C.NH3D.H2O2
10.(3 分)现将 10g A 和足量 D 混合加热,A 与 D 发生化学反应,10g A 完全反应后生成
8g M 和 4g X,则参加反应的 D 与反应生成的 M 的质量比是()
A.5:1B.1:1C.1:4D.1:2
11.(3 分)如图是某反应前后分子种类变化的微观示意图。下列有关说法正确的是()
丁是天然气的主要成分﹣﹣甲烷
乙是 H2O2,丙是 H2O,乙和丙中都含有 H2 C.甲、丁充分燃烧后的生成物不同
D.反应生成的丙和丁的质量比为 9:16
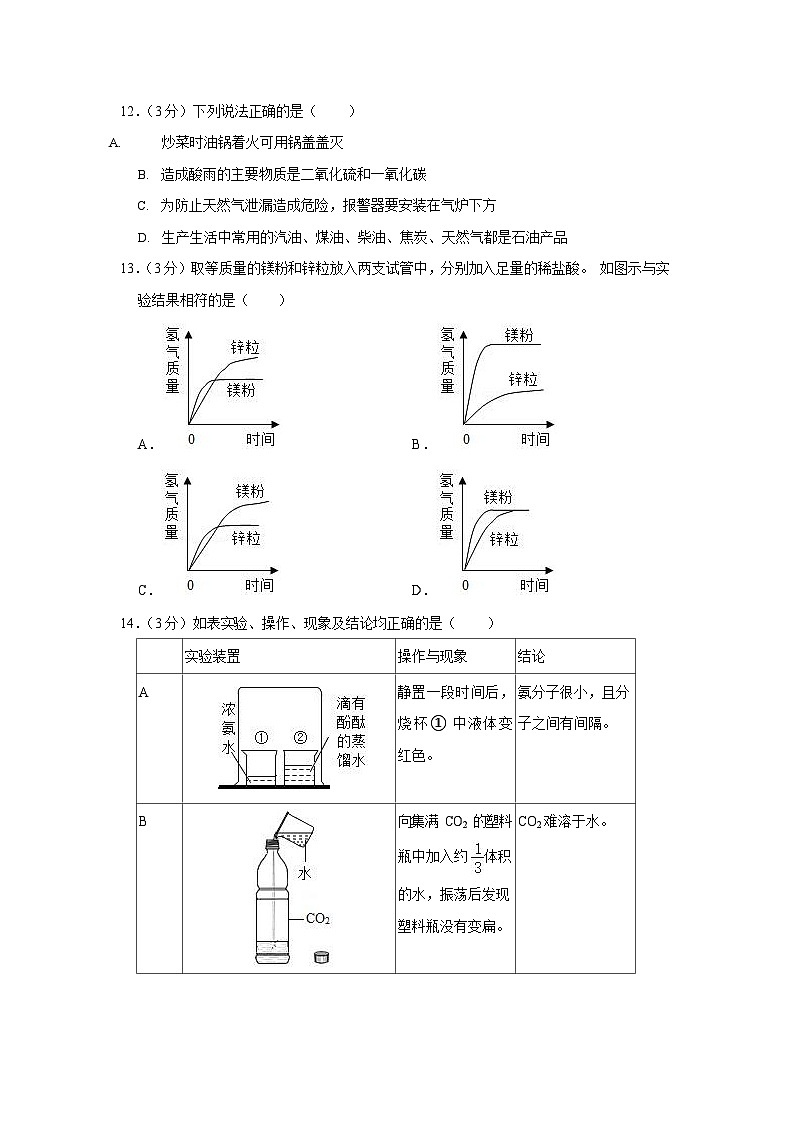
12.(3 分)下列说法正确的是()
炒菜时油锅着火可用锅盖盖灭
造成酸雨的主要物质是二氧化硫和一氧化碳
为防止天然气泄漏造成危险,报警器要安装在气炉下方
生产生活中常用的汽油、煤油、柴油、焦炭、天然气都是石油产品
13.(3 分)取等质量的镁粉和锌粒放入两支试管中,分别加入足量的稀盐酸。 如图示与实验结果相符的是()
A. B.
C. D.
14.(3 分)如表实验、操作、现象及结论均正确的是()
实验装置
操作与现象
结论
A
静置一段时间后, 烧杯① 中液体变红色。
氨分子很小,且分子之间有间隔。
B
向集满 CO2 的塑料
瓶中加入约 体积
的水,振荡后发现塑料瓶没有变扁。
CO2 难溶于水。
A.AB.BC.CD.D
二、本题包括 4 小题,共 39 分。
15.(7 分)氧气是一种宝贵的资源。
氧气由氧分子构成,在化学变化中每个氧分子会分成个氧原子。氧原子最外层有 6 个电子,倾向于 (填“失去”或“得到”)电子形成相对稳定结构,表现出较强的氧化性。
氧气能支持燃烧,在生产生活中有很多用途。
①图一所示的实验中,能证明有其它物质生成的现象是;反应的化学方程式是,反应中硫元素的化合价从价变为价。
②用如图二装置测定空气中氧气的含量时,红磷燃烧的化学方程式是。请仿照“实验后”的图示,画出“实验前”广口瓶中气体组成的微观示意图,水分子无须画出。
16.(9 分)水是生命之源。
C
将红热的细铁丝伸入集气瓶,铁丝剧烈燃烧,火星四射, 瓶内有黑色颗粒状固体。
铁丝能与氧气反应生成氧化铁。
D
用排水法收集一试管氢气,用拇指堵住管口,管口朝下移近酒精灯火焰, 移开拇指点火后,
听到轻微的爆鸣声
收集到的氢气较纯
自然界的水循环如图 1 所示。从分子、原子角度分析,水变为水蒸气时,变化的是,自然界的水可分为硬水和软水。硬水中溶有较多的,遇到肥皂水会产生较多的。
图 2 是某种自热饭盒内部结构的简单示意。使用时,水与生石灰接触就会反应并放出大量的热,发生反应的化学方程式是,要保证反应恰好完成,配料时生石灰与水的质量比应为(填最简整数比)。
按图 3 所示装置进行电解水实验,试管 (填“a”或“b”)中的气体能使燃着的木条燃烧更旺。试管 a、b 中气体的体积比为;密度比为(填最简整数比)。
17 .( 12 分 ) 碳 单 质 及 其 化 合 物 的 变 化 与 我 们 的 生 产 生 活 密 切 相 关 。
金刚石、石墨和 C60 都是碳元素组成的单质。图 1 中表示的是石墨结构。表示 C60 的分子结构。(填编号)
用图 2 装置,按如下步骤进行实验。
步骤一:取一小块铜片,在酒精灯上加热至红热后在空气中自然冷却,铜片表面变黑。步骤二:取少量木炭粉装入试管,将步骤一所得铜片放入试管,使其一半被木炭粉包埋。 步骤三:装好装置,充分预热后,先加热木炭粉包埋铜片的部分,观察到澄清石灰水变浑浊;然后着重加热未包埋部分,观察到铜片表面由黑变红。
步骤四:停止加热。待试管冷却后倒出管内物质,取出铜片用清水冲洗后观察到铜片光 亮如初。
请回答如下问题:
①“步骤一”中用于夹持铜片的仪器名称是,铜片表面变黑的反应的化学方程式是。
②“步骤二”中,装入木炭粉的实验操作是:将试管;用将木炭粉送至试管底部。
③“步骤三“中,木炭粉与氧化铜反应的化学方程式是;澄清石灰水变浑浊是因为有难溶于水的碳酸钙生成,碳酸钙中含有原子团(用化学符号表示)。使未被木炭粉包埋的“铜片”表面由黑变红的物质是 (填化学式),此反应的化学方程式是。
④结合步骤三的变化,从环保和安全角度考虑,原实验装置右半部分应该换成如图 3 装置中的或(填编号)。
18.(11 分)铁、钢在生产生活中的应用由来已久。
制作 USB 数据线要用到铁、铜等材料。这主要是利用了铁、铜的性(填“导电”或“导热”)。
西汉刘安《淮南万毕术》中记载“曾青得铁,则化为铜,外化而内不变”。“曾青” 主要是含铜化合物。以上变化可证明:铁的金属活动性比铜(填“强”或“弱”)。北宋沈括《梦溪笔谈)中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”;此泉“苦”是因为含有硫酸铜。请用化学方程式表示上述记载中发生的置换反应:。
某废弃物只含铜和氧化铜。查阅资料知道,氧化铜能与稀盐酸反应生成氯化铜和水,某生设计了如图实验流程回收金属铜。
请回答下列问题:
①废弃物与稀盐酸混合时,发生反应的化学方程式是。液体 C 中含有 H2O 和
(填化学式)。
②将过量铁粉加到液体 A 中, 能观察到有无色气泡冒出,对应反应的化学方程式是。
③请简述从固体 B 提纯铜粉的实验操作:。
④理论上,这个实验能回收到铜粉g。三、本题包括 2 小题,共 19 分。
19.(11 分)实验室制取气体是化学学习者的必备技能。
实验室里现有高锰酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸,以及如图 1 仪器:
①利用上述仪器和药品制取较干燥的二氧化碳,要选择的仪器是 填编号),药品
是,反应的化学方程式是。
②若补充一种仪器 (填名称),再选择上述仪器中的 (填编号)和药品还可以制取氧气,反应的化学方程式是。要制得 1.6g 氧气,要用托盘天平称取
g 所选药品。
如图 2 是实验室制取某气体的装置图。
①结合装置判断,下列有关说法正确的。
该气体的密度比空气大
该气体可溶于水
该反应在常温下能快速进行D.反应物有两种
②实验前发现装置漏气,下列后续操作正确的是(填编号)。
A.更换胶塞、橡胶管,塞紧胶塞再次检查装置气密性 B.换一套装置,装入药品,塞紧胶塞继续实验
C.装入药品,在玻璃管与胶塞连接处涂上凡士林后继续实验
20.(8 分)实验是化学研究的基础,对比实验有助于辨别变化的影响因素。
如图 1 实验中,紫色纸花会变红的是实验 (填编号),能证明二氧化碳不能使石蕊变红的是实验(填编号)。综合这四个实验能得到的结论是。
由图 2 的实验现象可以推出,燃烧需要的条件之一是,图 3 的实验中,乒乓球碎片先燃烧,滤纸碎片后燃烧,由此可以推出,燃烧需要的另一项条件是。
物质代号
A
D
E
T
熔点/℃
44
3550
﹣117
﹣259
沸点/℃
257
4827
78
﹣253
着火点/℃
40
370
510
580
已知酒精灯火焰的温度约为 500℃。选用表中的可燃物和(填代号)替代图二中的乒乓球碎片和滤纸碎片进行实验,也能达成实验探究目的。
2020-2021 学年广东省广州市越秀区九年级(上)期末化学试卷
参考答案与试题解析
一、选择题(本题包括 14 小题,每小题 3 分。每道题只有一项符合题意。选错、不选、多选或涂改不清的,均不给分)
1.(3 分)空气中的下列物质,常用作保护气的是()
A.N2B.O2C.H2OD.CO2
【分析】根据氮气的性质和用途考虑.
【解答】解:氮气的化学性质稳定,常用作保护气; 故选:A。
【点评】解答本题关键是熟悉空气的组成及其性质和用途.
2.(3 分)下列物质,属于氧化物的是()
A.KClO3B.H2CO3C.干冰D.生铁
【分析】本题考查氧化物的识别,根据氧化物的概念可知氧化物只有两种元素,且必须 有氧元素的化合物。
【解答】解:A、KClO3 中有三种元素,也含氧元素,但不属于氧化物,属于盐,故 A
错误。
B、H2CO3 中有三种元素,其一为氧元素,不属于氧化物,属于酸,故 B 错。
C、干冰中有两种元素,含氧元素,属于氧化物,故 C 正确。
D、生铁中含有铁和碳,属于混合物,不属于氧化物,故 D 错误。故选:C。
【点评】本题较简单,主要从概念上来抓住判断的关键点,两个关键点缺一不可,要同 时具备。
3.(3 分)下列净化水的方法中,净化程度最高的是()
A.静置B.吸附C.过滤D.蒸馏
【分析】根据已有的水的净化的知识进行分析解答,蒸馏得到的水中不含有任何杂质, 是净水程度最高的方法,据此解答.
【解答】解:蒸馏得到的水中不含有任何杂质,是净水程度最高的方法。 故选:D。
【点评】本题考查的是水的净化的知识,完成此题,可以依据已有的知识进行.
4.(3 分)如图实验操作,正确的是()
A. B.
C. D.
【分析】A、根据向试管内的滴加液体的方法分析;
B、根据向量筒中倾倒液体的方法分析分析; C、根据向试管中倾倒液体的方法分析;
D、根据量筒的读数方法分析。
【解答】解:A、使用胶头滴管滴加液体时滴管不能伸入试管内或接触试管壁,否则会污 染药品,应垂直悬空滴加,图中所示操作错误;
B、往量筒内倾倒液体时,标签应向着手心,量筒要略微倾斜,瓶口紧挨着量筒口,避免 液体溅出,图中所示操作正确;
C、往试管内倾倒液体时,取下的瓶塞要倒放,标签应向着手心,试管要略微倾斜,瓶口 紧挨着试管口倾倒,避免液体溅出,而图中瓶塞没有倒放,试管没有略微倾斜,图中所 示操作错误;
D、取用一定量的液体一般用量筒,量筒必须平放,读数时视线与凹液面的最低点保持水 平,图中操作错误。
故选:B。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本 操作的注意事项是解答此类试题的关键。
5.(3 分)下列有关实验要求,正确的是()
A.过滤时液面要低于滤纸的边缘B.闻药品气味要将鼻孔凑到容器口
C.实验剩余药品要放回原试剂瓶D.实验废液要直接倒入下水道
【分析】A、过滤液体时,注意“一贴、二低、三靠”的原则。
B、根据闻气体的气味时的方法(招气入鼻法)进行分析判断。
C、根据实验室剩余药品的处理原则(三不一要),进行分析判断。 D、根据实验废液的处理方法,进行分析判断。
【解答】解:A、过滤液体时,注意“一贴、二低、三靠”的原则,过滤时液面要低于滤 纸的边缘,故选项说法正确。
B、闻气体的气味时,应用手在瓶口轻轻的扇动,使极少量的气体飘进鼻子中,不能将鼻 子凑到集气瓶口去闻气体的气味,故选项说法错误。
C、对化学实验中的剩余药品,既不能放回原瓶,也不可随意丢弃,更不能带出实验室, 应放入指定的容器内,实验剩余药品不能放回原试剂瓶,以防止污染试剂,故选项说法错误。
D、实验废液不能直接倒入下水道,以防止污染下水道,故选项说法错误。 故选:A。
【点评】本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作 的注意事项是解答此类试题的关键.
6.(3 分)下列有关元素的说法,正确的是()
A.地壳中含量最多的是铝元素B.带金字旁的字属于金属元素
C.碳元素和硫元素最根本的区别是它们的相对原子质量不同D.氯元素的化学性质与其原子最外层电子数关系最密切
【分析】A、根据元素在自然界中的分布分析;
B、根据元素名称判断元素分类; C、根据元素的概念判断;
D、根据元素化学性质的决定因素判断。
【解答】解:A、地壳中含量最多的是氧元素,故 A 错误;
B、带金字旁的字不一定属于金属元素,如:锦、错等,故 B 错误; C、碳元素和硫元素最根本的区别是它们的质子数不同,故 C 错误; D、氯元素的化学性质与其原子最外层电子数关系最密切,故 D 正确。
故选:D。
【点评】本题涉及根据元素在自然界中的分布;元素分类;元素的概念以及元素化学性 质的决定因素,难度不大。
7.(3 分)如图为周期表中钠元素的信息及其粒子的结构示意图,下列说法正确的是()
在周期表中钠元素排在第 23 位
a=12
该粒子带正电,由钠原子失去电子形成D.该粒子的质量约是一个碳原子质量的 23 倍
【分析】A、根据图中元素周期表可以获得的信息:左上角的数字表示原子序数,进行分 析判断。
B、根据原子中原子序数=核电荷数=质子数=核外电子数,进行分析判断。
C、该粒子质子数=11,核外电子数=10,质子数>核外电子数,进行分析判断。 D、根据汉字下面的数字表示相对原子质量,进行分析判断。
【解答】解:A、根据图中元素周期表可以获得的信息:左上角的数字表示原子序数,左 上角的数字表示原子序数,该元素的原子序数为 11,在周期表中钠元素排在第 11 位,故选项说法错误。
B、原子中原子序数=核电荷数=质子数=核外电子数,该元素的原子序数为 11,则 a
=11,故选项说法错误。
C、该粒子质子数=11,核外电子数=10,质子数>核外电子数,该粒子带正电,由钠原 子失去电子形成,故选项说法正确。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原
子质量为 23,该粒子的质量约是一个碳原子质量的 23 倍,故选项说法错误. 故选:C。
【点评】本题难度不大,灵活运用元素周期表中元素的信息(原子序数、元素符号、元 素名称、相对原子质量)、粒子结构示意图的含义是正确解答本题的关键.
8.(3 分)维生素 D2(C28H44O)有促进新骨生成和钙化的功能。下列关于维生素 D2 的说法正确的是()
A.维生素 D2 中 C、H、O 三种元素的质量比为 28:44:1
B.1 个维生素 D2 分子由 28 个碳原子、44 个氧原子、1 个氢原子构成
C.维生素 D2 的相对分子质量为 386
D.维生素 D2 中氢元素的质量分数计算式为×100%
【分析】A.根据化合物中元素的质量比来分析;
B.根据物质的结构来分析;
C.根据相对分子质量的计算方法来分析; D.根据化合物中元素的质量分数来分析.
【解答】解:A.维生素 D 中的碳、氢、氧三种元素的质量比为(12×28):(1×44):
16=84:11:4,故错误;
B.1 个维生素 D2 分子由 28 个碳原子、44 个氢原子、1 个氧原子构成,故错误;
C.根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得维生素 D 的相对分子质量为:12×28+1×44+16×1=396,故错误;
D.维生素 D2 中氢元素的质量分数计算式为×100%,故正确。
故选:D。
【点评】本题难度不大,考查同学们结合新信息、灵活运用有机物高分子化合物、化学 式的含义与有关计算进行分析问题、解决问题的能力.
9.(3 分)某种火箭在发射时其燃料发生反应 N2O4+2X3N2+4H2O;其中的反应物 X 是()
A.N2OB.N2H4C.NH3D.H2O2
【分析】由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程 式推断生成物 X 的化学式。
【解答】解:根据反应的化学方程式可知,反应物中氮、氧原子个数分别为 2、4,反应后的生成物中氮、氢、氧原子个数分别为 6、8、4,根据反应前后原子种类、数目不变, 则 2X 分子中含有 4 个氮原子、8 个氢原子,则每个 X 分子由 2 个氮原子和 4 个氢原子构成,则物质 X 的化学式为 N2H4。
故选:B。
【点评】此题难度不大,掌握质量守恒定律的有关知识即可顺利解答此题。
10.(3 分)现将 10g A 和足量 D 混合加热,A 与 D 发生化学反应,10g A 完全反应后生成
8g M 和 4g X,则参加反应的 D 与反应生成的 M 的质量比是()
A.5:1B.1:1C.1:4D.1:2
【分析】由题意可知,反应物是 A 和 D,生成物是 M 和 X,根据质量守恒定律可以求出参加反应的 D 的质量,进而求出参加反应的 D 和 M 的质量比。
【解答】解:10gA 完全反应后生成 8g M 和 4g X,由质量守恒定律可知,参加反应的 D
的质量为 8g+4g﹣10g=2g,故参加反应的 D 和 M 的质量比是 2g:8g=1:4。故选:C。
【点评】本题解题的关键是运用化学中的基本思想:质量守恒思想。
11.(3 分)如图是某反应前后分子种类变化的微观示意图。下列有关说法正确的是()
丁是天然气的主要成分﹣﹣甲烷
乙是 H2O2,丙是 H2O,乙和丙中都含有 H2 C.甲、丁充分燃烧后的生成物不同
D.反应生成的丙和丁的质量比为 9:16
【分析】根据反应前后分子种类变化的微观示意图,分析反应物、生成物及反应条件, 写出方程式。根据方程式的意义、物质的构成等分析判断有关的说法。
【解答】解: 由反应前后分子种类变化的微观示意图可知, 该反应的方程式是:
CH4+H2O2 CH3OH+H2O。
A、丁是甲醇,天然气的主要成分是甲烷,不是甲醇,故 A 说法不正确;
B、乙是 H2O2,丙是 H2O,乙和丙中都含有氢原子,不含有 H2,故 B 说法不正确;
C、甲、丁充分燃烧后都生成了二氧化碳和水,生成物相同,故 C 说法不正确;
D、由方程式的意义可知,反应生成的丙和丁的质量比为 18:32=9:16,故 D 说法正确。故选:D。
【点评】本题考查了化学反应的微观模型的表示,完成此题,可以依据已有的知识结合 图示进行.
12.(3 分)下列说法正确的是()
炒菜时油锅着火可用锅盖盖灭
造成酸雨的主要物质是二氧化硫和一氧化碳
为防止天然气泄漏造成危险,报警器要安装在气炉下方
生产生活中常用的汽油、煤油、柴油、焦炭、天然气都是石油产品
【分析】A、根据灭火原理进行分析。
B、根据氮氧化物、二氧化硫是导致酸雨的重要物质进行分析。 C、根据天然气的主要成分是甲烷,进行分析判断。
D、根据汽油、煤油、柴油等都是石油的产品解答。
【解答】解:A、炒菜时油锅着火后用锅盖盖灭,利用隔绝氧气或空气灭火,说法正确。
B、一氧化碳不是导致酸雨的物质,说法不正确。
C、天然气的主要成分是甲烷,密度比空气的小,为防止天然气泄漏造成危险,报警器应 安装在气炉的上方,说法不正确。
D、焦炭、天然气不是石油产品,说法不正确; 故选:A。
【点评】本题主要考查了灭火的原理,酸雨的产生以及防范爆炸的措施等知识点,难度 不大。
13.(3 分)取等质量的镁粉和锌粒放入两支试管中,分别加入足量的稀盐酸。 如图示与实验结果相符的是()
A. B.
C. D.
【分析】根据等质量的镁粉和锌粒与足量的稀盐酸反应生成氢气的质量,以及反应速率 分析。
【解答】解:等质量的镁粉和锌粒与足量的稀盐酸反应生成氢气的质量:镁粉大于锌粒, 镁粉和稀盐酸接触面积比铁片大,并且镁的活动性大于锌,因此反应速率比锌粒快,反应需要时间短。
故选:B。
【点评】本题是结合数学图象的分析题,注重了学科间的联系,抓住转折点是解答这类 题目的关键。
14.(3 分)如表实验、操作、现象及结论均正确的是()
实验装置
操作与现象
结论
A
静置一段时间后, 烧杯① 中液体变红色。
氨分子很小,且分子之间有间隔。
B
向集满 CO2 的塑料
瓶中加入约 体积
的水,振荡后发现塑料瓶没有变扁。
CO2 难溶于水。
C
将红热的细铁丝伸入集气瓶,铁丝剧烈燃烧,火星四射, 瓶内有黑色颗粒状固体。
铁丝能与氧气反应生成氧化铁。
D
用排水法收集一试管氢气,用拇指堵住管口,管口朝下移近酒精灯火焰, 移开拇指点火后,
听到轻微的爆鸣声
收集到的氢气较纯
A.AB.BC.CD.D
【分析】A、氨分子是不断运动的,运动到酚酞试液中时,和水结合生成氨水,氨水显碱 性,能使酚酞试液变红色;
B、二氧化碳能够溶于水;
C、铁在氧气中燃烧生成四氧化三铁;
D、移开拇指点火后,听到轻微的爆鸣声,说明收集到的氢气较纯。
【解答】解:A、静置一段时间后,烧杯②中液体变红色,是因为氨分子是不断运动的, 运动到酚酞试液中时,和水结合生成氨水,氨水显碱性,能使酚酞试液变红色,该选项说法不正确;
B、二氧化碳能够溶于水,该选项说法不正确;
C、铁在氧气中燃烧生成四氧化三铁,该选项说法不正确;
D、移开拇指点火后,听到轻微的爆鸣声,说明收集到的氢气较纯,该选项说法正确。 故选:D。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进 行分析、判断,从而得出正确的结论。
二、本题包括 4 小题,共 39 分。
15.(7 分)氧气是一种宝贵的资源。
氧气由氧分子构成,在化学变化中每个氧分子会分成 2 个氧原子。氧原子最外层有 6 个电子,倾向于 得到 (填“失去”或“得到”)电子形成相对稳定结构,表现出较强的氧化性。
氧气能支持燃烧,在生产生活中有很多用途。
①图一所示的实验中,能证明有其它物质生成的现象是 生成有刺激性气味的气体 ; 反应的化学方程式是 S+O2SO2 ,反应中硫元素的化合价从 0 价变为 +4
价。
② 用 如 图 二 装 置 测 定 空 气 中 氧 气 的 含 量 时 , 红 磷 燃 烧 的 化 学 方 程 式 是4P+5O22P2O5 。请仿照“实验后”的图示,画出“实验前”广口瓶中气体组成的微观示意图,水分子无须画出。
【分析】(1)根据化学反应的实质、氧原子最外层电子数的特点分析;
(2)①根据硫在氧气中燃烧的反应、现象和化合价原则分析回答。
②根据红磷燃烧的反应和空气中的组成分析回答。
【解答】解:(1)氧气由氧分子构成,在化学变化中每个氧分子会分成 2 个氧原子。氧原子最外层有 6 个电子,大于 4,倾向于得到电子形成相对稳定结构,表现出较强的氧化性。
(2)①图一所示的实验中,能证明有其它物质生成的现象是生成有刺激性气味的气体; 硫在氧气中燃烧生成了二氧化硫,反应的化学方程式是:S+O2 SO2,由化合价原则可知,反应中硫元素的化合价从 0 价变为+4 价。
②用如图二装置测定空气中氧气的含量时,红磷燃烧生成了五二氧化二磷,化学方程式 是:4P+5O22P2O5 。在空气中氮气和氧气的分子个数比是 4:1;“实验前”广口
瓶中气体组成的微观示意图如下:。故答案为:(1)2;得到。
(2)生成有刺激性气味的气体;S+O2 SO2;0;+4。
4P+5O22P2O5 ;
【点评】本题通过硫在氧气的燃烧、测定空气中氧气体积分数的实验考查了化学反应的
实质、氧原子的结构、化合价原则、方程式的书写等知识,难度不大,根据已有的知识 分析解答即可。
16.(9 分)水是生命之源。
自然界的水循环如图 1 所示。从分子、原子角度分析,水变为水蒸气时,变化的是
水分子之间的间隔变大 ,自然界的水可分为硬水和软水。硬水中溶有较多的 可溶性
钙镁化合物 ,遇到肥皂水会产生较多的 浮渣 。
图 2 是某种自热饭盒内部结构的简单示意。使用时,水与生石灰接触就会反应并放出大量的热,发生反应的化学方程式是 CaO+H2O=Ca(OH)2 ,要保证反应恰好完成,配料时生石灰与水的质量比应为 28:9 (填最简整数比)。
按图 3 所示装置进行电解水实验,试管 b (填“a”或“b”)中的气体能使燃着的木条燃烧更旺。试管 a、b 中气体的体积比为 2:1 ;密度比为 1:16 (填最简整数比)。
【分析】根据水的天然循环的知识、硬水和软水的检验方法、化学方程式的书写以及电 解水的知识进行分析解答即可。
【解答】解:(1)水变为水蒸气时,变化的是水分子之间的间隔变大,硬水中溶有较多的可溶性钙镁化合物,遇到肥皂水会产生较多的浮渣,故填:水分子之间的间隔变大; 可溶性钙镁化合物;浮渣;
水与生石灰接触就会反应生成氢氧化钙,发生反应的化学方程式是 CaO+H2O=Ca
(OH)2,要保证反应恰好完成,配料时生石灰与水的质量比应为:56:18=28:9,故 填:CaO+H2O=Ca(OH)2;28:9;
图 3 所示装置进行电解水实验中,试管 b 与电源的正极相连,得到的是氧气,该气体能使燃着的木条燃烧更旺。试管 a、b 中气体的体积比为 2:1;由于产生的氢气和氧气
的质量比为:(2×2):32=1:8,故密度比为=1:16,故填:b;2:1;1:16。
【点评】本题考查的是水的有关知识,完成此题,可以依据已有的知识进行。
17 .( 12 分 ) 碳 单 质 及 其 化 合 物 的 变 化 与 我 们 的 生 产 生 活 密 切 相 关 。
金刚石、石墨和 C60 都是碳元素组成的单质。图 1 中 B表示的是石墨结构。 A
表示 C60 的分子结构。(填编号)
用图 2 装置,按如下步骤进行实验。
步骤一:取一小块铜片,在酒精灯上加热至红热后在空气中自然冷却,铜片表面变黑。步骤二:取少量木炭粉装入试管,将步骤一所得铜片放入试管,使其一半被木炭粉包埋。 步骤三:装好装置,充分预热后,先加热木炭粉包埋铜片的部分,观察到澄清石灰水变浑浊;然后着重加热未包埋部分,观察到铜片表面由黑变红。
步骤四:停止加热。待试管冷却后倒出管内物质,取出铜片用清水冲洗后观察到铜片光 亮如初。
请回答如下问题:
①“步骤一”中用于夹持铜片的仪器名称是 坩埚钳 ,铜片表面变黑的反应的化学方程式是 2Cu+O2 2CuO。
②“步骤二”中,装入木炭粉的实验操作是:将试管 横放 ;用 药匙 将木炭粉
送至试管底部。
③“步骤三“中,木炭粉与氧化铜反应的化学方程式是 2CuO+C 2Cu+CO2
3
↑ ;澄清石灰水变浑浊是因为有难溶于水的碳酸钙生成,碳酸钙中含有原子团 CO 2
- (用化学符号表示)。使未被木炭粉包埋的“铜片”表面由黑变红的物质是 CO (填化学式),此反应的化学方程式是 CuO+COCu+CO2。
④结合步骤三的变化,从环保和安全角度考虑,原实验装置右半部分应该换成如图 3 装
置中的 A或 C(填编号)。
【分析】(1)图 1 中 B 表示的是石墨结构,A 表示 C60 的分子结构。
(2)加热条件下,铜和氧气反应生成氧化铜。
“步骤二”中,装入木炭粉的实验操作是:将试管横放,用药匙将木炭粉送至试管底部。 高温条件下,木炭粉与氧化铜反应生成铜和二氧化碳。
碳酸钙中含有的原子团是碳酸根,可以表示为 CO3。加热条件下一氧化碳和氧化铜反应生成铜和二氧化碳。
氢氧化钙溶液能够检验二氧化碳,一氧化碳有毒,燃烧生成二氧化碳。
【解答】解:(1)图 1 中 B 表示的是石墨结构,A 表示 C60 的分子结构。故填:B;A。
(2)①“步骤一”中用于夹持铜片的仪器名称是坩埚钳,铜片表面变黑,是因为加热 条件下,铜和氧气反应生成氧化铜,反应的化学方程式是:2Cu+O2 2CuO。
故填:坩埚钳;2Cu+O2 2CuO。
②“步骤二”中,装入木炭粉的实验操作是:将试管横放,用药匙将木炭粉送至试管底 部。
故填:横放;药匙。
③“步骤三“中,木炭粉与氧化铜反应生成铜和二氧化碳,反应的化学方程式是:
2CuO+C 2Cu+CO2↑;
3
碳酸钙中含有的原子团是碳酸根,可以表示为 CO 2﹣;使未被木炭粉包埋的“铜片”表面由黑变红的物质是 CO,一氧化碳是由二氧化碳和碳在高温条件下反应生成的,加热条件下一氧化碳和氧化铜反应生成铜和二氧化碳, 此反应的化学方程式是:
CuO+CO Cu+CO2。
故填:2CuO+C2Cu+CO2↑;CO32﹣;CO;CuO+COCu+CO2。
④结合步骤三的变化,从环保和安全角度考虑,原实验装置右半部分应该换成如图 3 装置中的 A(氢氧化钙溶液能够检验二氧化碳,气球能够收集一氧化碳,防止污染环境) 或 C(氢氧化钙溶液能够检验二氧化碳,一氧化碳燃烧生成二氧化碳,能够防止一氧化碳污染环境)。
故填:A;C。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进 行分析、判断,从而得出正确的结论。
18.(11 分)铁、钢在生产生活中的应用由来已久。
制作 USB 数据线要用到铁、铜等材料。这主要是利用了铁、铜的 导电 性(填“导电”或“导热”)。
西汉刘安《淮南万毕术》中记载“曾青得铁,则化为铜,外化而内不变”。“曾青” 主要是含铜化合物。以上变化可证明:铁的金属活动性比铜 强 (填“强”或“弱”)。北宋沈括《梦溪笔谈)中记载:“信州铅山有苦泉,流以为涧,挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”;此泉“苦”是因为含有硫酸铜。请用化学方程式表示上述记载中发生的置换反应: Fe+CuSO4═FeSO4+Cu。
某废弃物只含铜和氧化铜。查阅资料知道,氧化铜能与稀盐酸反应生成氯化铜和水,某生设计了如图实验流程回收金属铜。
请回答下列问题:
①废弃物与稀盐酸混合时,发生反应的化学方程式是 CuO+2HCl═CuCl2+H2O。液体 C 中含有 H2O 和 FeCl2(填化学式)。
②将过量铁粉加到液体 A 中,能观察到有无色气泡冒出,对应反应的化学方程式是
Fe+2HCl═FeCl2+H2↑ 。
③请简述从固体 B 提纯铜粉的实验操作: 向固体 B 中加入足量稀盐酸,成分反应后过
滤,洗涤、干燥 。
④理论上,这个实验能回收到铜粉 8.3g。
【分析】(1)金属具有良好的导电性。
铁和硫酸铜反应生成硫酸亚铁和铜。
氧化铜和稀盐酸反应生成氯化铜和水。铁和稀盐酸反应生成氯化亚铁和氢气。
从固体 B 提纯铜粉的实验操作:向固体 B 中加入足量稀盐酸,成分反应后过滤,洗涤、干燥。
根据提供数据可以进行相关方面的计算。
【解答】解:(1)制作 USB 数据线要用到铁、铜等材料,这主要是利用了铁、铜的导电性。
故填:导电。
曾青得铁,则化为铜,外化而内不变,以上变化可证明:铁的金属活动性比铜强; 发生的置换反应是铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式:Fe+CuSO4═ FeSO4+Cu。
故填:强;Fe+CuSO4═FeSO4+Cu。
①废弃物与稀盐酸混合时,氧化铜和稀盐酸反应生成氯化铜和水,发生反应的化 学方程式是:CuO+2HCl═CuCl2+H2O;
液体 C 中含有 H2O 和反应生成的氯化亚铁。故填:CuO+2HCl═CuCl2+H2O;FeCl2。
②将过量铁粉加到液体 A 中,能观察到有无色气泡冒出,是因为过量的铁和过量的稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式是:Fe+2HCl═FeCl2+H2↑。
故填:Fe+2HCl═FeCl2+H2↑。
③从固体 B 提纯铜粉的实验操作:向固体 B 中加入足量稀盐酸,成分反应后过滤,洗涤、干燥。
故填:向固体 B 中加入足量稀盐酸,成分反应后过滤,洗涤、干燥。
④理论上,这个实验能回收到铜粉足量:1.5g+(10g﹣1.5g)× =8.3g。故填:8.3.
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进 行分析、判断,从而得出正确的结论。
三、本题包括 2 小题,共 19 分。
19.(11 分)实验室制取气体是化学学习者的必备技能。
实验室里现有高锰酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸,以及如图 1 仪器:
①利用上述仪器和药品制取较干燥的二氧化碳,要选择的仪器是 cdeh填编号),药品是 石灰石和稀盐酸 ,反应的化学方程式是 2HCl+CaCO3=CaCl2+H2O+CO2↑ 。
②若补充一种仪器 试管 (填名称),再选择上述仪器中的 abfgh(填编号)和药
品 高 锰 酸 钾 还 可 以 制 取 氧 气 , 反 应 的 化 学 方 程 式 是2KMnO4 K2MnO4+MnO2+O2↑ 。要制得 1.6g 氧气,要用托盘天平称取 15.8 g 所选药品。
如图 2 是实验室制取某气体的装置图。
①结合装置判断,下列有关说法正确的 A。A.该气体的密度比空气大
B.该气体可溶于水
C.该反应在常温下能快速进行D.反应物有两种
②实验前发现装置漏气,下列后续操作正确的是 A(填编号)。A.更换胶塞、橡胶管,塞紧胶塞再次检查装置气密性
B.换一套装置,装入药品,塞紧胶塞继续实验
C.装入药品,在玻璃管与胶塞连接处涂上凡士林后继续实验
【分析】(1)①考查固液不加热装置的组成仪器名称;考查实验室制取二氧化碳的药品 名称;盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,据此书写化学方程式;
②根据固体加热发生装置的组成仪器名称来补充所需仪器;根据题目信息回答此题;高
锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,据此化学方程式;根据化学方
程式计算此题;
(2)①根据装置特点分析回答此题;
②考查装置气密性的检查方法。
【解答】解:(1)①制取二氧化碳选择固液不加热发生装置和向上排空气法收集装置, c 为反应容器,d 加入稀盐酸,e 密封锥形瓶,固定长颈漏斗,并导出气体,h 收集气体, 故选 cdeh;石灰石主要成分为碳酸钙,所以选择石灰石和稀盐酸制取二氧化碳;盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号,所以化学方程式为 2HCl+CaCO3=CaCl2+H2O+CO2↑;
故答案为:cdeh;石灰石和稀盐酸;2HCl+CaCO3=CaCl2+H2O+CO2↑。
②上述药品中高锰酸钾可以用于制取氧气,则反应物为固体,且需要加热,因此需要加热发生装置,a 用于加热,b 固定仪器,f 密封试管及导出气体,g 和 h 组成排水法收集装置,另外需要补充试管,作为加热发生容器;高锰酸钾在加热条件下反应生成锰酸钾、 二氧化锰和氧气, 书写化学方程式注意配平及气体符号, 所以化学方程式为
2KMnO4 K2MnO4+MnO2+O2↑;设此时需要高锰酸钾质量为 m,
2KMnO4 K2MnO4+MnO2+O2↑
31632
m1.6g
m=15.8g;
故答案为:试管;abfgh;高锰酸钾;2KMnO4 K2MnO4+MnO2+O2↑;15.8。
(2)①A、气体是由长口进气集气瓶,可知气体密度比空气大,选项 A 正确;
B、气体可否溶于水,无法判断,选项 B 错误;
C、反应需要酒精灯加热,因此常温下不反应,选项 C 错误;
D、反应物为固液混合物,但是是否是两种反应物,无法判断,选项 D 错误; 故答案为:A。
②装置漏气后,需要更换可能漏气的装置,然后密封后重新检查,故选 A; 故答案为:A。
【点评】在解此类题时,首先要将题中的知识认知透,然后结合学过的知识进行解答。
20.(8 分)实验是化学研究的基础,对比实验有助于辨别变化的影响因素。
如图 1 实验中,紫色纸花会变红的是实验 (Ⅰ)、(Ⅳ) (填编号),能证明二氧化碳不能使石蕊变红的是实验 (Ⅲ) (填编号)。综合这四个实验能得到的结论是 二氧化碳与水反应生成酸性物质 。
由图 2 的实验现象可以推出,燃烧需要的条件之一是 与氧气接触 ,图 3 的实验中,乒乓球碎片先燃烧,滤纸碎片后燃烧,由此可以推出,燃烧需要的另一项条件是 温度达到可燃物的着火点 。
物质代号
A
D
E
T
熔点/℃
44
3550
﹣117
﹣259
沸点/℃
257
4827
78
﹣253
着火点/℃
40
370
510
580
已知酒精灯火焰的温度约为 500℃。选用表中的可燃物 A 和 D (填代号)替代图二中的乒乓球碎片和滤纸碎片进行实验,也能达成实验探究目的。
【分析】(1)根据石蕊的变色情况、二氧化碳的性质以及实验对比的方法来分析;
(2)根据实验现象以及燃烧的条件来分析。
【解答】解:(1)稀醋酸显酸性,能使紫色的石蕊纸花变红色,水不能使紫色的石蕊纸花变红色,干燥的二氧化碳也不能使紫色的石蕊纸花变红色,喷水后,二氧化碳与水反 应生成酸性物质,酸性物质能使紫色的石蕊纸花变红色。综合这四个实验能得到的结论 是二氧化碳与水反应生成碳酸;故填:(Ⅰ)、(Ⅳ);(Ⅲ);二氧化碳与水反应生成酸性
物质;
(2)图 2 实验中,铜片上的白磷燃烧,而热水中的白磷没有燃烧,对比可知,燃烧需要
与氧气接触;图 3 的实验中,乒乓球碎片先燃烧,滤纸碎片后燃烧,由此可以推出,燃烧需要的另一项条件是温度达到可燃物的着火点;已知酒精灯火焰的温度约为 500℃。选用表中的可燃物 A 和 D 替代图二中的乒乓球碎片和滤纸碎片进行实验,也能达成实验探究目的;故填:与氧气接触;温度达到可燃物的着火点;A;D。
【点评】合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因 此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.
相关试卷
这是一份2021-2022学年广东省广州市越秀区九年级(上)期末化学试卷(含答案),共26页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2020-2021学年广东省广州市增城区九年级(上)期末化学试卷(含答案),共26页。试卷主要包含了选择题注意,解答题等内容,欢迎下载使用。
这是一份2020-2021学年广东省广州市天河区九年级(上)期末化学试卷(含答案),共29页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。









