

所属成套资源:【备战2025】2025年高考化学二轮复习易错重难点提升【新高考】(含解析)
专题02 常用化学计量与应用(讲练)—2025届高考化学二轮复习易错重难提升【新高考】(含解析)
展开
这是一份专题02 常用化学计量与应用(讲练)—2025届高考化学二轮复习易错重难提升【新高考】(含解析),共14页。试卷主要包含了易错点分析,化学计算常用方法等内容,欢迎下载使用。
考点一 阿伏加德罗常数及其应用
一、有关NA判断需要注意的“六大”问题
1.气体若题中出现物质的体积,先考虑该物质是不是气体,如果是气体需再考虑条件是不是标准状况;熟悉在标准状况下不是气体的物质,如H2O、HF、SO3、Br2、CHCl3、CCl4、己烷、苯、乙醇等摩尔体积的适用条件;
2.物质的微观结构
①某些物质分子中的原子个数,如Ne、O3、P4等;②特殊物质的摩尔质量或分子中的中子数,如D2O、T2O、18O2、H37Cl等;③一些物质中的化学键数目,如SiO2、Si、CH4、P4、CO2、C60、烃等物质中的化学键数目;④FeCl3溶液转化为Fe(OH)3胶体,因为胶体粒子是“Fe(OH)3分子”的集合体,所以胶体粒子的数目小于原溶液中Fe3+的数目 ;
3.氧化还原反应中的电子转移
如Na2O2、NO2与H2O反应,Fe、Cu与S反应,Cl2与H2O、NaOH溶液反应,Fe与稀硝酸反应等;
4.隐含的可逆反应
①可逆反应不能进行到底。如NO2与N2O4,合成氨反应,二氧化硫的催化氧化等;
②电解质的电离与离子的水解。弱电解质的电离及某些离子的水解,如1 ml CH3COOH或1 ml FeCl3溶于水时,溶液中CH3COO-或Fe3+的物质的量均小于1 ml。
5.具有特殊关系的物质
等质量的最简式相同的有机物(如烯烃)、同素异形体、N2与CO、NO2与N2O4等具有的原子、分子数目
6.缺少条件
①缺少体积,如常温下,pH=2的H2SO4溶液中含有的H+数目不一定为0.01NA(设NA代表阿伏加德罗常数的值,下同);
②缺少温度、压强,如由H2O2制得2.24 L O2,转移的电子数目不一定为0.2NA;
③没有具体反应,如1 ml Cl2参加反应,转移电子数不一定为2NA
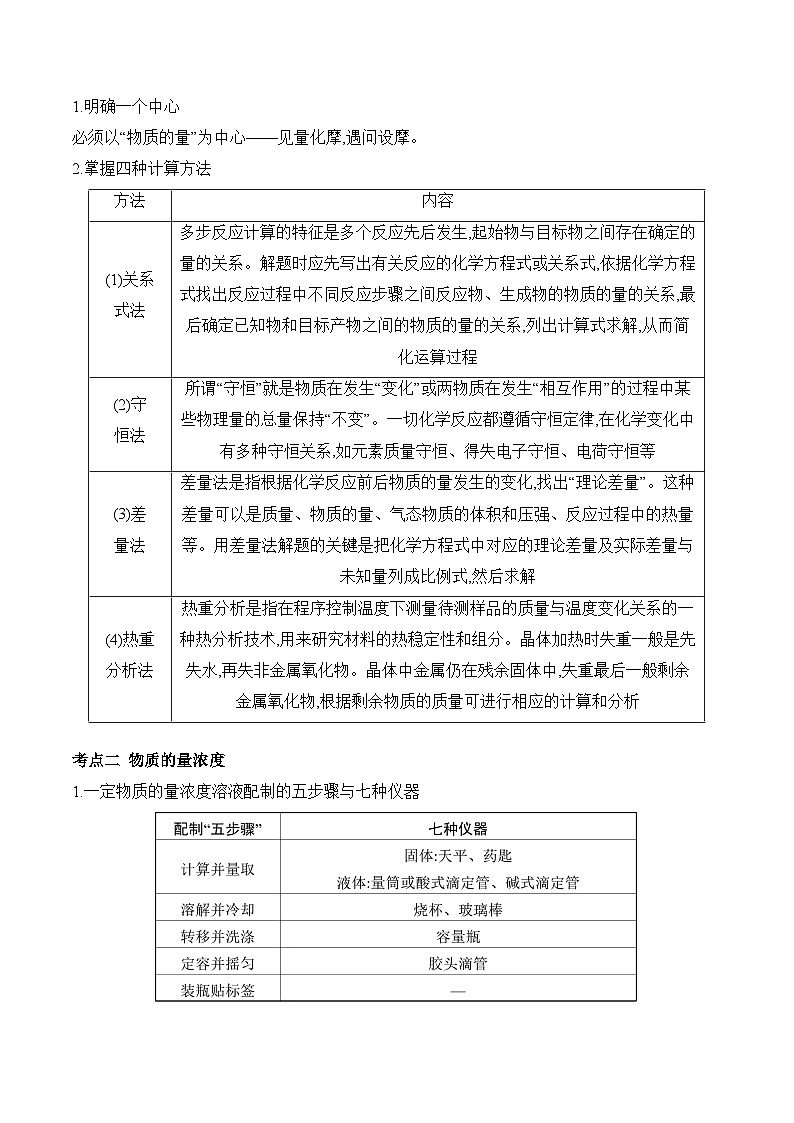
二、化学计算常用方法
1.明确一个中心
必须以“物质的量”为中心——见量化摩,遇问设摩。
2.掌握四种计算方法
考点二 物质的量浓度
1.一定物质的量浓度溶液配制的五步骤与七种仪器
PS:(1)容量瓶有特定“规格”,选择应遵循“大而近”原则。
(2)定容分两个环节,当液面离刻度线1~2 cm时,改用胶头滴管。
(3)NaOH固体需放在烧杯等玻璃器皿中称量。
2.误差分析
(1)根据表达式进行误差分析。
(2)视线引起误差的分析方法。
①仰视容量瓶刻度线(图1),导致溶液体积偏大,所配制溶液的物质的量浓度偏低。
②俯视容量瓶刻度线(图2),导致溶液体积偏小,所配制溶液的物质的量浓度偏高。
二、易错训练
1.煅烧硫酸铝铵晶体,发生的主要反应为,设为阿伏加德罗常数的值。下列说法不正确的是( )
A.0.1 ml硫酸铝铵晶体中含有的个数为
B.工业上采用电解熔融的方法制备金属Al
C.生成物和在标准状况下的体积之比为5:3
D.用和合成1 ml氨气时共转移3 ml电子
2.已知:,是阿伏加德罗常数的值。当在标准状况下生成时,下列说法错误的是( )
A.转移电子数为
B.产物经充分过滤、洗涤、干燥后,理论上剩余固体质量为0.174 g
C.消耗的含孤电子对数为
D.若反应物无剩余,将生成物过滤后配成2 L溶液,常温下溶液pH=11
3.设为阿伏加德罗常数的值,下列说法正确的是( )
A.与反应,固体增重2.8 g时,转移电子数为
B.中含质子数为
C.24 g金刚石中含个共价键
D.溶液中,的数目之和为
4.设为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L庚烷中含有的共价键数目为
B.溶液中的数目为0.2
C.晶体中的离子数目为0.4
D.71 g氯气与足量的铁完全反应,转移的电子数目为2
5.设为阿伏加德罗常数的值。下列说法正确的是( )
A.100 g 98%的浓硫酸含有的数目是2
B.含有σ键的数目是21
g明矾水解形成胶体粒子数是0.01
D.已知,当反应放出46.2 kJ热量时,转移电子数目为6
6.设为阿伏加德罗常数的值,下列说法正确的是( )
A.时,1 L pH=1的纯水中含有的数目为0.1
B.标准状况下,30 g NO与足量氧气反应,可制得的数目为
C.标准状况下,与足量反应,可制得的体积为22.4 L
D.1 ml乙烷分子含共价键的数目为8
7.我国“长征二号”F型运载火箭使用偏二甲肼作为主要燃料。偏二甲肼是一种高比冲液体火箭燃料,优点在于有高比冲值,与氧化剂接触即自动着火,反应的化学方程式为。设为阿伏加德罗常数的值,下列说法正确的是( )
A.含σ键的数目为
B.中含π键的数目为0.5
C.含孤电子对的数目为2
D.每生成转移电子的数目为1.6
8.设为阿伏加德罗常数的值,下列说法正确的是( )
A.2.8 g乙烯中含有σ键的个数为0.5
B.与足量发生反应,生成分子的个数为
C.标准状况下,中含原子数为6
D.溶液中的个数为0.2
9.为阿伏加德罗常数的值。下列叙述正确的是( )
A.中所含σ键最多为10
B.标准状况下,气体中的数目为
C.常温下,pH为5的溶液中水电离的为
D.16 g甲醇中所含孤电子对的数目为2
10.设为阿伏加德罗常数的值,下列说法正确的是( )
A.溶液中的数目小于
B.足量锌和硫酸充分反应,生成的气体分子数为0.92
C.标准状况下,和完全反应,生成的气体体积为2.24 L
D.和混合物中含有的阴离子数目为0.1
11.为阿伏加德罗常数的值,下列叙述正确的是( )
A.精炼铜过程中,阳极生成个时阴极增重64 g
B.标准状况下,22.4 L HF中所含氢键数目为
C.常温下,pH=13的溶液中含数目为0.2
D.和的混合物中所含阴离子数目为
12.氯气溶于水可以发生反应。设为阿伏加德罗常数的值,下列说法正确的是( )
A.含有个Cl原子
B.0.1 ml HClO溶于水,溶液中含有个
C.若反应消耗,则转移个电子
D.若所得溶液pH=3,则溶液中含有个
13.把VL含有和的混合溶液分成两等份,一份加入含amlNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含bml的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为( )
A.B.
C.D.
14.向200mL和的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量关系如图所示。忽略溶液体积的变化,下列说法错误的是( )
A.a点时溶液中的阳离子为和
B.b点时溶液中发生的反应为:
C.c点时溶液中溶质的物质的量浓度为
D.原溶液中和的物质的量浓度之比为1:1
15.新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、、NaClO等对病毒均具有很好的消毒杀菌作用。已知某“84消毒液”瓶体部分标签如图所示。
完成以下问题:
(1)该“84消毒液”的物质的量浓度为_______ml/L
(2)取用任意体积的该“84消毒液”溶液时,下列物理量中不随所取体积的多少而变化的是___________(填正确答案标号)。
A.溶液中NaClO的物质的量
B.溶液的浓度
C.溶液中的数目
D.溶液的密度
(3)某学生现需450mL物质的量浓度为6ml/L的NaClO溶液。该学生需要用量筒量取___________mL上述“84消毒液”进行配制;
(4)在配制过程中,下列实验操作对所配制的NaClO溶液的物质的量浓度有何影响?(填“偏高”“偏低”或“无影响”)
①配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果___________;
②定容时仰视容量瓶的刻度线___________。
16.铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)某补铁口服液中含有,为检验其是否被氧化变质,可取少量该口服液,向其中滴加___________,若变为红色,则说明其已变质。
(2)工业盐的主要成分是,曾多次发生过因误食而中毒的事件,其原因是把人体内的转化为而失去与结合的能力。以上事实说明具有___________。下列不能实现转化为的物质是___________(填字母)。
A.B.C.D.
(3)常用作杀菌消毒剂,生产的反应原理是:(未配平),则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)从制造印刷电路板的废液中回收铜,并重新获得溶液的工艺流程如下,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得溶液,准备采用下列步骤:
请写出上述流程中加入物质④的化学式:___________。请写出通入⑥反应的离子方程式___________。
(5)实验室由固体配制溶液。
①如下图所示的仪器中配制溶液不需使用的是___________(填字母),还缺少的玻璃仪器是___________(填写仪器名称)。
②若实验遇下列情况,导致所配溶液的物质的量浓度偏低的是___________(填字母)。
A.定容时仰视刻度线B.固体失去部分结晶水
C.移液前,容量瓶内有蒸馏水D.未冷却至室温就转移定容
答案以及解析
1.答案:C
解析:1 ml硫酸铝铵晶体中含有,0.1 ml硫酸铝铵晶体中含有的个数为,A说法正确;金属Al是活泼金属,工业上常采用电解熔融的方法制备金属Al,B说法正确;标准状况下,不是气体,是气体,无法计算二者的体积之比,C说法错误;用和合成氨气时,氮元素由0价降为-3价,每生成1 ml氨气时共转移3 ml电子,D说法正确。
2.答案:A
解析:当反应在标准状况下产生时,。反应中,Mn从+7价变为+4价,O从-1价升高到0价,故当有产生时,转移的电子数为,A说法错误;产物经充分过滤、洗涤、干燥后,理论上剩余固体为,根据化学方程式可知,产生的物质的量为,即质量为,B说法正确;根据化学方程式计算可知,消耗的物质的量为,每个分子中含有的孤电子对数为4,即反应消耗的含有的孤电子对数为,C说法正确;反应产生的物质的量为,将生成物配成2 L溶液,溶液中,则常温下溶液pH=11,D说法正确。
3.答案:A
解析:与反应的化学方程式为,反应中固体每增重56 g,转移2 ml电子,则固体增重2.8 g时,转移0.1 ml电子,即转移电子数为,A正确;选项中未给出气体所处的温度和压强,无法计算气体的物质的量,B错误;金刚石中,每个碳原子平均形成2个共价键,则24 g(2 ml)金刚石含有的共价键数为,C错误;溶液中,存在电荷守恒关系:不发生水解,则溶液中,则的数目之和大于,D错误。
4.答案:D
解析:标准状况下,庚烷为液体,无法计算11.2 L庚烷中含有的共价键数目,A错误;未指出溶液体积,无法计算的物质的量,故无法计算数目,B错误;晶体中含有和晶体中含有和,离子数目为,C错误;氯气少量,转移电子数按氯气计算,71 g氯气的物质的量为1 ml,反应中Cl从0价变为-1价,转移2 ml电子,转移的电子数目为,D正确。
5.答案:B
解析:浓硫酸含水量较少,硫酸几乎不电离,因此无法计算浓硫酸含有的数目,A错误;含有配位键、配位键,分子中含有键,因此一共有键,B正确;4.74 g明矾的物质的量为0.01 ml,明矾溶于水电离产生水解生成氢氧化铝胶体,胶体具有吸附性,多个分子会形成一个胶体粒子,因此胶体粒子数小于,C错误;当反应放出46.2 kJ热量时,参与反应的的物质的量是0.5 ml,因此转移电子数是,D错误。
6.答案:A
解析:已知纯水的pH与体积,可计算出氢氧根离子的数目为,A正确;30 g NO即1 ml NO,1 ml NO与足量氧气完全反应生成,但会发生可逆反应生成,因此可制得的数目小于,B错误;首先,与生成的反应为可逆反应,不能完全生成与等物质的量的,其次,标准状况下,是非气体,C错误;根据乙烷分子的结构简式可知,1 ml乙烷分子含共价键的数目为,D错误。
7.答案:D
解析:1个分子含2个σ键,为0.25 ml,故含σ键的数目为,A错误;未标明气体是否在标准状况下,无法计算氧气的物质的量,故无法计算π键的数目,B错误;中每个N原子含1个孤电子对,故含孤电子对的数目为,C错误;的物质的量为0.1 ml,由题给反应的化学方程式可知,每生成转移16 ml电子,则生成转移电子的数目为,D正确。
8.答案:A
解析:每个乙烯分子中含5个σ键,2.8 g(0.1 ml)乙烯中含有σ键的个数为,A正确;的物质的量为1 ml,与的反应为可逆反应,生成的个数小于,故无法计算生成分子的个数,B错误;标准状况下,为液体,无法计算其物质的量,C错误;溶液体积未知,无法计算出所含的个数,D错误。
9.答案:A
解析:的不饱和度为1,为环状结构时含有的σ键数目最多,所以58 g(即1 ml)中所含σ键最多为,A正确;气体中不存在,B错误;在水中电离出的会抑制水的电离,pH为5的溶液中为,水电离的溶液中的,C错误;1个甲醇分子中只有氧原子上有2个孤电子对,16 g即(0.5 ml)甲醇所含孤电子对的数目为,D错误。
10.答案:D
解析:溶液体积未知,无法求出溶液中的数目,A错误;开始时,Zn与浓硫酸发生反应(浓),随着反应进行,硫酸浓度变低,Zn与稀硫酸发生反应,的硫酸含,和足量锌充分反应,生成气体的物质的量大于0.92 ml,B错误;标准状况下,和完全反应生成0.1 ml HF,HF在标准状况下是液体,C错误;和的摩尔质量均为,阴、阳离子数目比均为1:2,故和混合物总物质的量为0.1 ml,含有的阴离子数目为,D正确。
11.答案:D
解析:精炼铜过程中,阳极溶解的不完全是铜,还有比铜活泼的金属,如铁、锌等,故阳极生成个时阴极增重大于64 g,A错误;1 ml HF中含有1 ml氢键,但标准状况下,HF是液体,则22.4 L HF的物质的量大于1 ml,B错误;溶液的体积未知,无法求出的数目,C错误;和的摩尔质量均为,二者晶体中阴阳离子数之比均为1:2,故78 g二者的混合物中所含阴离子数目为,D正确。
12.答案:C
解析:没有说明氯气所处的状态,不能计算出中含有的Cl原子数目,A错误;HClO属于弱电解质,不能完全电离,B错误;根据反应原理,可以得出每消耗,反应转移个电子,C正确;没有给出具体的溶液体积,溶液中个数难以得出,D错误。
13.答案:C
解析:一份加入含amlNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁,那么就有,硫酸镁也就是。另一份加入含的溶液,恰好使硫酸根离子完全沉淀为硫酸钡,那么硫酸根离子有bml。所以硫酸钾有,钾离子就有。浓度就是,即,C项符合题意;
故选C。
14.答案:D
解析:A.0~0.56gFe发生反应,a点时溶液中阳离子为和,A正确;
B.由图可知加入铁粉0.56g~1.68g时,,剩余物为铜1.28g,即1.28gCu的物质的量为,此时发生反应,B正确;
C.0~0.56gFe时,发生反应,消耗铁0.01ml,原溶液中为0.02ml,即为0.01ml,,0.56g~1.68gFe时,发生反应,消耗铁1.12g即0.02ml,原溶液中为0.02ml,即为0.02ml,,当加入铁粉为从1.68g~2.24g(即加入0.56gFe)时,固体增加,溶液中不含,溶液中溶质为,,依据硫酸根离子守恒有,所以c点溶液中溶质的物质的量浓度为,C正确;
D.由上述分析可知原溶液中为0.01ml,为0.02ml,所以原溶液中和的物质的量浓度之比等于物质的量之比,为1:2,D错误;
答案选D。
15.答案:(1)20
(2)BD
(3)150.0
(4)偏低;偏低
解析:(1)根据物质的量浓度与密度、质量分数的换算公式可知,该“84消毒液”的物质的量浓度为=20ml/L,故答案为:20;
(2)A.溶液中NaClO的物质的量等于物质的量浓度乘以溶液体积,即溶质的物质的量与溶液体积有关,A不合题意;
B.由于溶液是均一稳定的,则溶液的浓度与溶液体积无关,B符合题意;
C.溶液中的数目等于物质的量浓度乘以溶液体积在乘以阿伏加德罗常数,即其数目与溶液体积有关,C不合题意;
D.由于溶液是均一稳定的,溶液的密度与溶液体积无关,D符合题意;
故答案为:BD;
(3)某学生现需450mL物质的量浓度为6ml/L的NaClO溶液,则需要用500mL容量瓶来配制溶液,则该学生需要用量筒量取=150.0mL上述“84消毒液”进行配制,故答案为:150.0;
(4)①配制过程中,未用蒸馏水洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,故可能导致结果偏低,故答案为:偏低;
②定容时仰视容量瓶的刻度线,将导致溶液的体积偏大,导致结果偏低,故答案为:偏低。
16.答案:(1)KSCN溶液
(2)氧化性;C
(3)3:2
(4)HCl;
(5)DE;250mL容量瓶、玻璃棒;A
解析:(1)氧化变质会生成,检验三价铁离子的试剂为硫氰化钾溶液,现象为溶液变为红色;
(2)可以把亚铁离子氧化为三价铁离子,说明具有氧化性;具有氧化性,可以把亚铁离子氧化为三价铁离子,自身被还原为氯离子,A正确;
氧气也可以氧化亚铁离子,B正确;
氯化铁虽然具有氧化性,但是与亚铁离子不反应,C错误;
酸性高锰酸钾具有强氧化性,可以将亚铁离子氧化为三价铁离子,D正确,故选C。
(3),Fe元素化合价由+3价升高为+6价,因此是还原剂,氯元素化合价由+1价降低为-1价,KClO是氧化剂,根据得失电子守恒,则该反应中氧化剂与还原剂的物质的量之比为3:2;
(4)加入过量的铁粉,把氯化铁还原为氯化亚铁,铁置换出氯化铜中的Cu,所以①是Fe;滤渣③中含有Fe、Cu,滤渣③加入过量的盐酸溶解铁,④是HCl;通入⑥是氯化亚铁溶液中通入氯气生成氯化铁,反应的离子方程式为。
(5)①无240mL规格的容量瓶,按照“大而近”原则,需选择250mL容量瓶。配制的溶液需用到的仪器有250mL容量瓶、烧杯、量筒、玻璃棒、托盘天平、胶头滴管等,因此不需要漏斗、圆底烧瓶,故选DE,还缺少玻璃仪器为250mL容量瓶和玻璃棒;
②A.定容时仰视读数,加蒸馏水过多,会导致溶液体积偏大,浓度偏低,故A正确;
B.固体失去部分结晶水,在称量得的相同质量固体中含有的质量会变大,溶质物质的量变大,导致配得溶液浓度偏高,故B错误;
C.移液前,容量瓶内有蒸馏水,定容时不影响溶液的总体积,溶液浓度不变,故C错误;
D.未冷却至室温就转移定容,加蒸馏水过少,会导致溶液体积偏小,浓度偏高,故D错误;
故选A。
方法
内容
(1)关系
式法
多步反应计算的特征是多个反应先后发生,起始物与目标物之间存在确定的量的关系。解题时应先写出有关反应的化学方程式或关系式,依据化学方程式找出反应过程中不同反应步骤之间反应物、生成物的物质的量的关系,最后确定已知物和目标产物之间的物质的量的关系,列出计算式求解,从而简化运算过程
(2)守
恒法
所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中某些物理量的总量保持“不变”。一切化学反应都遵循守恒定律,在化学变化中有多种守恒关系,如元素质量守恒、得失电子守恒、电荷守恒等
(3)差
量法
差量法是指根据化学反应前后物质的量发生的变化,找出“理论差量”。这种差量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。用差量法解题的关键是把化学方程式中对应的理论差量及实际差量与未知量列成比例式,然后求解
(4)热重
分析法
热重分析是指在程序控制温度下测量待测样品的质量与温度变化关系的一种热分析技术,用来研究材料的热稳定性和组分。晶体加热时失重一般是先失水,再失非金属氧化物。晶体中金属仍在残余固体中,失重最后一般剩余金属氧化物,根据剩余物质的质量可进行相应的计算和分析
84消毒液
有效成分:NaClO
规格:1000mL
质量分数:74.5%
密度:2
相关试卷
这是一份专题02 化学计量及其应用(练习)-2024年高考化学二轮复习讲练测(新教材新高考),共19页。试卷主要包含了NA表示阿伏加德罗常数的值,设NA为阿伏加德罗常数的值,设NA表示阿伏加德罗常数的值,NA代表阿伏加德罗常数的值等内容,欢迎下载使用。
这是一份专题02 化学计量及其应用(测试)-2024年高考化学二轮复习讲与练(新教材新高考),文件包含专题02化学计量及其应用测试原卷版docx、专题02化学计量及其应用测试解析版docx等2份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份专题02 化学计量及其应用(讲义)-2024年高考化学二轮复习讲与练(新教材新高考),文件包含专题02化学计量及其应用讲义原卷版docx、专题02化学计量及其应用讲义解析版docx等2份试卷配套教学资源,其中试卷共49页, 欢迎下载使用。










