




所属成套资源:人教版化学必修第二册PPT课件+教案+分层练习+导学案(原卷+解析卷)整册(含单元复习资料)
人教版(2019)高中化学必修二第五章 化工生产中的重要非金属元素 单元复习课件
展开
这是一份人教版(2019)高中化学必修二第五章 化工生产中的重要非金属元素 单元复习课件,共54页。
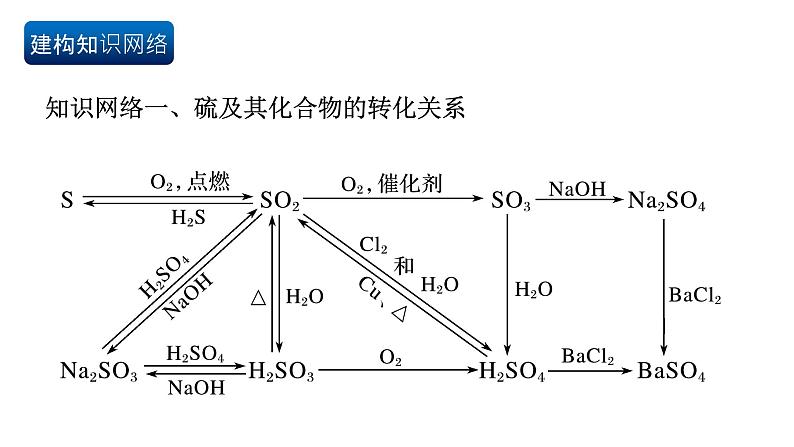
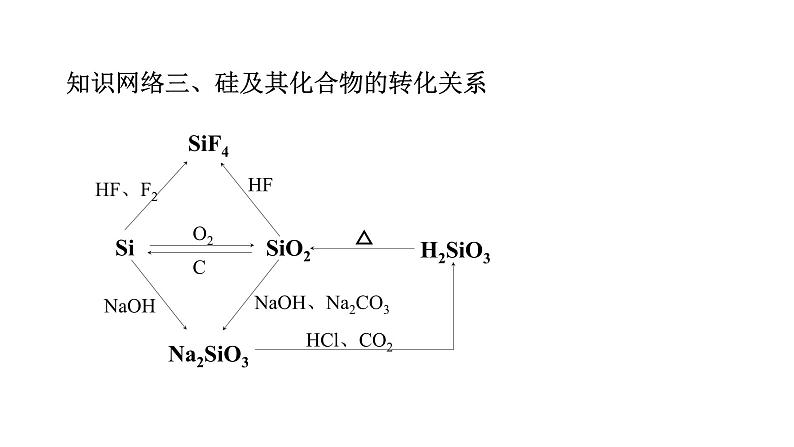
第五章 化工生产中的重要非金属元素目录第一部分建构知识网络知识网络一、硫及其化合物的转化关系知识网络二、氮及其化合物的转化关系知识网络三、硅及其化合物的转化关系突破重、难点知识【知识点1】硫及硫的氧化物【温馨提示】①空气中产生微弱的淡蓝色火焰,氧气中产生明亮的蓝紫色火焰。②硫在空气中燃烧只能生成SO2,不能生成SO3。1.硫单质:硫单质既表现氧化性,又表现还原性2.二氧化硫:具有酸性氧化通性、氧化性、还原性、漂白性(2)与碱性溶液反应:少量SO2生成亚硫酸盐,过量SO2生成亚硫酸氢盐 少量SO2:2NaOH+SO2==Na2SO3+H2O、过量SO2:NaOH+SO2==NaHSO3(3)氧化性(如与H2S溶液反应):SO2+2H2S==3S↓+2H2O(生成黄色物质)(4)还原性:能被O2、I2(H2O)、MnO4-(H+)、Fe3+、H2O2、NO3-(H+) 等氧化剂氧化。如:SO2+Br2+2H2O==2HBr+H2SO4(检验或除去SO2) 2MnO4-+5SO2+2H2O ==2Mn2++5SO42-+4H+, (检验或除去SO2) 2Fe3++SO2+2H2O==2Fe2++4H++SO42-,(溶液由棕黄色变成浅绿色)(5)漂白性:SO2可使品红溶液褪色,加热后,溶液由无色变为红色。2.二氧化硫:具有酸性氧化通性、氧化性、还原性、漂白性【温馨提示】①SO2和氧化性盐溶液的反应: a.向BaCl2溶液中通入SO2,没有现象; 而向Ba(NO3)2溶液中通入SO2,则会产 生白色的BaSO4沉淀。 b.向Ca(ClO)2溶液中通入CO2,会产生白色的CaCO3沉淀;而向Ca(ClO)2溶液中通 入SO2,则会产生白色的CaSO4沉淀。②SO2或亚硫酸的漂白性原理:a.二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色
物质,加热又恢复为原来的颜色。利用品红溶液可检验二氧化硫气体。b.SO2有漂白性,使品红褪色,不能漂白酸碱指示剂,只能使紫色石蕊溶液变红。c.SO2的漂白作用与次氯酸的漂白作用相不相同;SO2的漂白作用不稳定。d.次氯酸的漂白过程是发生了氧化还原反应,其漂白作用是永久性的。
③常见的漂白剂SO2、HClO、NaClO、 H2O2、 活性炭比较与有色物质结合生成无色物质将有色物质氧化为无色物质吸附有色物质化学变化化学变化物理变化可逆,加热或久置后恢复原来的颜色不可逆,加热或久置后不恢复原来颜色有色的有机物,不能漂白指示剂有色的有机物和指示剂有机色质【典例】类推思想在化学学习与研究中经常被采用,但类推出的结论是 否正确最终要经过实验的验证。以下类推的结论中正确的是( ) A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气 C.铁与Cl2反应生成FeCl3 ,故铁与I2反应生成FeI3 D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化D【解析】SO2能使酸性KMnO4溶液褪色,是因为其具有还原性,二氧化碳没有还原性,不能与KMnO4反应,故A错误;硝酸具有强氧化性,与活泼金属反应得不到氢气,故B错误;氯气的氧化性强于Fe3+,所以铁与氯气反应可生成FeCl3,而I2的氧化性弱于Fe3+,所以铁与I2反应生成的是FeI2,故C错误;浓硫酸与浓硝酸都具有强氧化性,室温下,都能使铁和铝发生钝化,故D正确。【知识点2】硫酸 硫酸根离子的检验1.硫酸的工业制备(1)制备流程:(2)制备原理:2.浓H2SO4的三大特性:吸水性、脱水性、强氧化性。③常温,铁、铝遇浓H2SO4发生钝化,可用铝槽车运输浓H2SO4,体现了浓硫酸的强氧化性。①吸水性和脱水性二者的本质区别是物质中有没有现成的水分子。吸水性是物理变化,但结晶水合物失去结晶水属于浓硫酸的吸水性,属于化学变化。②根据吸水性浓硫酸常用作干燥剂,但是它不能用来干燥碱性气体(如NH3)和强还原性气体(如HBr、HI、H2S)。2.浓H2SO4的三大特性:吸水性、脱水性、强氧化性。⑦由“量变”引起的“质变”:金属(如Cu、Zn等)与浓H2SO4反应时,要注意H2SO4浓度对反应产物的影响。⑥可用浓H2SO4的高沸点难挥发性制备易挥发性酸,如制HCl↑。⑤浓硫酸与金属反应时,既表现酸性又表现强氧化性,而与非金属反应时,只表现强氧化性。3.SO42-的检验(4)排除干扰:用盐酸酸化可排除Ag+、CO32-、SO32-、PO43-的干扰。 不能用稀硝酸酸化,因在酸性条件下,SO32-、HSO3-等会被溶液中的NO3-氧化为 SO42-,从而干扰检验结果。(1)原理:Ba2++SO42-==BaSO4↓(白色),BaS04不溶于稀盐酸、稀硝酸的特性来检验硫酸根离子。(2)试剂:可溶性钡盐(BaCl2)、稀盐酸。【典例】关于非金属含氧酸及其盐的性质,下列说法正确的是( ) A.浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化 B.NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强 C.加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强 D.浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,故稀 HNO3氧化性更强B【知识点3】硫及其化合物的相互转化及应用1.硫元素的化合价与氧化性、还原性之间的关系SO2SH2SO4H2SSO3H2SO3Na2SO4Na2SO3Na2SH2S2.硫元素的价类二维图只具氧化性只具还原性既有氧化性又有还原性逐档上升,逐档下降只靠近、不交叉3.硫及其化合物之间的转化规律(1)相同价态硫的转化是通过酸、碱反应实现的。如:(2)不同价态硫的转化是通过氧化还原反应实现的。当硫元素的化合价升高或 降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用下图表示:【温馨提示】①同种元素相邻价态的粒子间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸之间不发生氧化还原反应。②当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
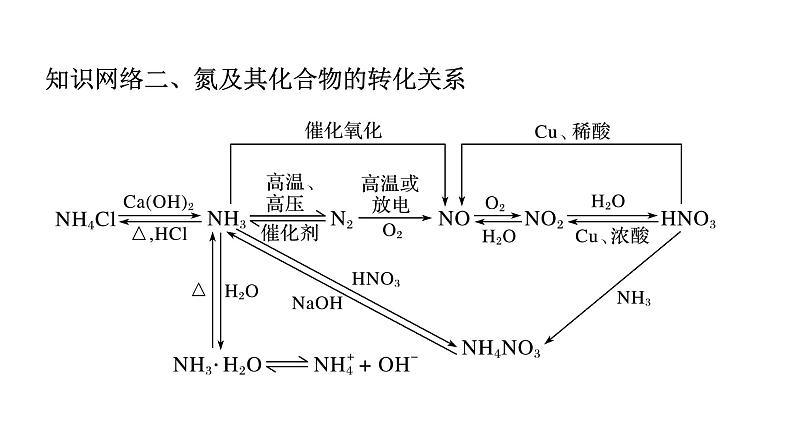
【典例】学习硫及其化合物,可运用物质类别和元素价态二维视角摸型 对硫及其化合物的性质进行推测验证。以下说法中不正确的是( ) A.因b有强还原性,所以不能用d的浓溶液干燥 B.常温下,Fe在d的浓溶液中钝化 C.a和b可发生反应生成单质硫 D.工业生产中,b转化为c的反应在接触室中进行A【解析】由图可知,a为H2S,氧化物b为SO2,c为SO3,e为H2SO3,d为H2SO4。A.b为SO2,浓H2SO4具有吸水性,二者之间不发生反应,故浓硫酸可以干燥二氧化硫,故A错误;B.d为H2SO4,常温下,Fe在d的浓溶液中钝化,故B正确;C.a和b可发生反应,即H2S能与SO2反应生成硫,故C正确;D.b为SO2,c为SO3,工业生产中,b转化为c的反应在接触室中进行,故D正确。硫元素:碳元素:钠元素:知识点4、氮及氮的氧化物1.氮的存在及氮的固定(1)自然固氮:①雷电固氮(将N2转化NO);②根瘤菌固氮(将N2转化NH4+)(2)人工固氮:合成氨工业2.氮气的化学性质3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N2O、 NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是N2O3、N2O5,分别 是硝酸、亚硝酸(HNO2)的酸酐。(2)NO和NO2的比较无色、无味、气体红棕色、刺激性气味、气体密度略大于空气密度比空气大很低低,易液化不溶易溶3.氮的氧化物有毒有毒不反应不反应2NO2+2KI=I2+2KNO23NO2+H2O=2HNO3+NONO2既是氧化剂,又是还原剂2NO2+2NaOH=NaNO3+NaNO2+H2ONO+NO2+2NaOH=2NaNO2+H2O3.氮的氧化物4NO+3O2+2H2O=4HNO34NO2+O2+2H2O=4HNO33Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O 排水法向上排空气法【典例】关于N2及其化合物性质的叙述,正确的是( ) A.N2与O2在放电条件下可发生反应,生成无色的NO2气体 B.湿润的紫色石蕊试纸遇到NO2会变成红色 C.稀硝酸与铜发生反应的化学方程式为:Cu+2HNO3=Cu(NO3)2+H2↑ D.NO、NO2气体不会污染空气,可以大量排放
【解析】A.N2与O2在放电条件下可发生反应,生成无色的NO气体,故A错误; B.NO2遇水能生成硝酸,湿润的紫色石蕊试纸遇到NO2会变成红色,故B正确;C.稀硝酸与铜发生反应的化学方程式为:3Cu+8HNO3==3Cu(NO3)2+2NO↑+4H2O,故C错误;D.NO、NO2气体是有毒气体,会污染空气,不能直接大量排放到空气中,故D错误;故答案为B。B知识点5、氨、铵盐1.氨的分子结构2.氨的物理性质(1)通常状况下,氨是一种无色、有刺激性气味的气体,密度比空气小,极易溶 于水(常温常压下,体积比为1∶700),氨的水溶液称为氨水(喷泉实验)。(2)氨在加压下容易液化,液氨气化时吸收大量的热,使周围环境温度急剧降低, 工业上可使用液氨作制冷剂。三角锥形3.喷泉实验(1)实验成功的关键:a.装置的气密性要好;b.烧瓶要干燥;c.氨气要充满。(2)若无胶头滴管引发喷泉,可采用热敷法或冷敷法引发喷泉。4.氨的化学性质【温馨提示】常见的能形成喷泉实验的气体和吸收剂如表: ②氨气溶于水得氨水,显碱性,氨水中含有的粒子有:NH3·H2O、H2O、NH3、 NH4+、OH-、H+。【温馨提示】①NH3是中学化学中唯一的碱性气体,能使湿润的红色石蕊试纸变蓝, 在推断题中作为解题突破口。 ②氨水呈碱性,NH3·H2O属于一元弱碱,计算氨水的浓度时,溶质按NH3进行计算。
(2)氨气与酸的反应: HCl+NH3==NH4Cl、NH3+HNO3==NH4NO3。(3)氨气的还原性:5.铵盐的性质(1)物理性质:铵盐都是白色固体,均易溶于水。 (2)化学性质:6.氨的实验室制法(2)净化:用碱石灰吸水(3)尾气处理:棉花用稀硫酸浸湿,注意防倒吸(4)氨气的其它实验室制法NaOH溶于水放热,促使氨水分解。且OH-浓度的增大有利于NH3的生成CaO与水反应,使溶剂(水)减少;反应放热,促使氨水分解。化学方程式为NH3·H2O+CaO===NH3↑+Ca(OH)2【典例】实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )A.①是氨气发生装置 B.②是氨气吸收装置C.③是氨气发生装置 D.④是氨气收集、检验装置
C【解析】A.①装置NH4Cl加热分解生成HCl和NH3,在试管口处NH3和HCl气体遇冷会再反应生成NH4Cl,收集不到NH3,A错误;B.NH3极易溶于水,NH3溶解导致导气管中气体压强减小而引发倒吸现象,因此②不能用于NH3的吸收,②装置,防倒吸装置中漏斗口与液面应接触,但插入液面之下不能防止倒吸,B错误;C.③装置用浓氨水加热可分解制得NH3,C正确;D.由于NH3的密度比空气小,因此收集NH3可以采用向下排空气法,为防止空气对流应在试管口塞一团棉花,D错误;故合理选项是C。知识点6、硝酸 1.硝酸的化学性质(1)硝酸具有酸的通性:①金属反应一般不生成氢气;②与碱性氧化物反应:如 CuO、Na2O、Fe2O3等;③与碱反应:Cu(OH)2、NaOH等;④与盐反应:NaHCO3、 Na2CO3等;⑤与指示剂反应:浓硝酸可使石蕊先变红后褪色【特别提醒】在利用HNO3的酸性时,要注意考虑它的强氧化性。如FeO与稀硝 酸反应时的方程式应是:3FeO+10HNO3(稀)==3Fe(NO3)3+NO↑+5H2O,而不是 FeO+2HNO3 (稀)==Fe(NO3)2+H2O。③金属与HNO3反应一般不生成H2,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO,极稀HNO3可被还原成NH3,生成NH4NO3等。 3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O Cu+4HNO3(稀)==Cu(NO3)2+2NO2↑+2H2O。【温馨提示】①硝酸的强氧化性规律是温度越高,硝酸越浓,其氧化性越强;硝酸 无论浓、稀都有强氧化性;与硝酸反应时,还原剂一般被氧化成最高价态。 ②常温下,浓硝酸能使铁、铝钝化。④与还原性化合物反应:硝酸可氧化H2S、SO2、Na2SO3、HI、Fe2+等还原性物质。稀硝酸与FeSO4溶液反应的离子方程式:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O。
③硝酸几乎能与绝大多数金属(除Au、Pt外)反应,生成高价态金属的硝酸盐,本身一般被还原为NO2或NO。④质量分数达98%以上的浓硝酸称为“发烟硝酸”,“烟”实为雾(硝酸小液滴),体现了HNO3的挥发性。⑤浓硝酸能使紫色石蕊溶液变红,加热褪色。在这一反应过程中浓硝酸表现出强酸性和强氧化性,可将红色物质氧化成无色物质。⑥王水:浓HNO3和浓盐酸按体积比为1:3混合即为王水,它的氧化性更强,能溶解Pt、Au等金属。⑦NO3-在酸性条件下具有强氧化性,常作隐含条件出现在试题中,解题中往往被忽视而形成易错点。如离子共存、SO42-的检验、向含Fe3+溶液中加入非氧化性酸。【典例】某化学兴趣小组进行了有关Cu、稀硝酸、稀硫酸化学性质的实 验,实验过程如图所示。下列有关说法正确的是( ) A.实验①中溶液呈蓝色,试管口有红棕色 气体产生, 说明HNO3被 Cu 还原为NO2 B.实验③中滴加稀硫酸,铜片继续溶解, 说明稀硫酸的氧化性比稀硝酸的强 C.实验③发生反应的离子方程式为: 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O D.Cu 在常温下可以和稀硝酸反应,不可以和稀硫酸反应CD【解析】铜与稀硝酸反应,HNO3被Cu还原为NO,试管口有红棕色气体产生,是因为NO在试管口被氧气氧化为NO2,故A错误;稀硫酸的氧化性比稀硝酸的弱,实验③中滴加稀硫酸,铜片继续溶解,发生反应3Cu+8H++2NO3-===3Cu2++4H2O+2NO↑ ,故B错误、C正确;常温下,Cu不能和稀硫酸反应,故D正确。知识点7、酸雨及防治 1.空气中SO2和NO2的主要来源(1)煤、石油和某些金属矿物中含有硫或含硫化合物;(2)汽车尾气中除含有氮氧化物外,还含有一氧化碳、未燃烧的碳氢化合物、含 铅化合物和颗粒等,严重污染大气,破坏环境。 2.危害(1)SO2和NO2是主要的大气污染物,它们能直接危害人体健康,引起呼吸道疾病;(2)溶于水形成酸雨; (3)氮氧化物的危害:光化学烟雾、酸雨、破坏臭氧层、NO与血红蛋白结合使 人中毒等 3.酸雨的危害及防治措施(1)酸雨是指pH






