
人教版(2024)九年级上册(2024)课题3 元素当堂检测题
展开
这是一份人教版(2024)九年级上册(2024)课题3 元素当堂检测题,共20页。试卷主要包含了元素,元素符号,元素周期表等内容,欢迎下载使用。
板块导航
01/学习目标 明确内容要求,落实学习任务
02/思维导图 构建知识体系,加强学习记忆
03/知识导学 梳理教材内容,掌握基础知识
04/效果检测 课堂自我检测,发现知识盲点
05/问题探究 探究重点难点,突破学习任务
06/分层训练 课后训练巩固,提升能力素养
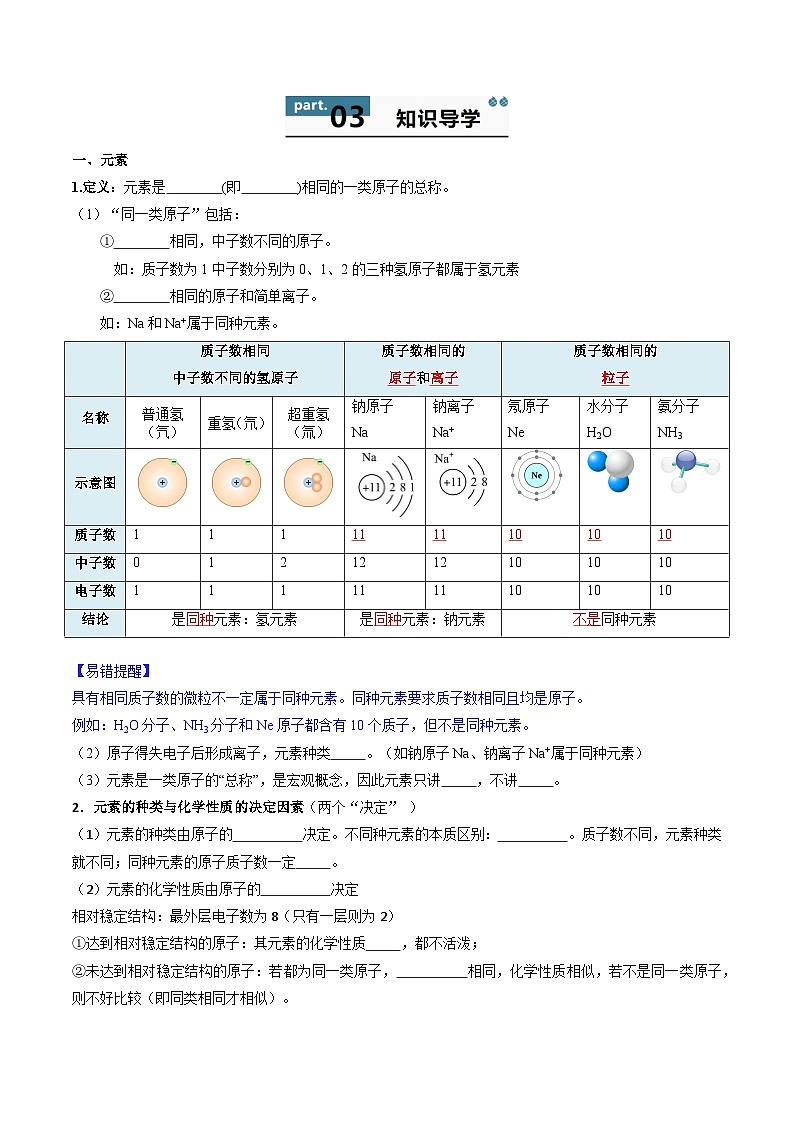
一、元素
1.定义:元素是 (即 )相同的一类原子的总称。
(1)“同一类原子”包括:
= 1 \* GB3 ① 相同,中子数不同的原子。
如:质子数为1中子数分别为0、1、2的三种氢原子都属于氢元素
= 2 \* GB3 ② 相同的原子和简单离子。
如:Na和Na+属于同种元素。
【易错提醒】
具有相同质子数的微粒不一定属于同种元素。同种元素要求质子数相同且均是原子。
例如:H2O分子、NH3分子和Ne原子都含有10个质子,但不是同种元素。
(2)原子得失电子后形成离子,元素种类 。(如钠原子Na、钠离子Na+属于同种元素)
(3)元素是一类原子的“总称”,是宏观概念,因此元素只讲 ,不讲 。
2.元素的种类与化学性质的决定因素(两个“决定” )
(1)元素的种类由原子的 决定。不同种元素的本质区别: 。质子数不同,元素种类就不同;同种元素的原子质子数一定 。
(2)元素的化学性质由原子的 决定
相对稳定结构:最外层电子数为8(只有一层则为2)
= 1 \* GB3 ①达到相对稳定结构的原子:其元素的化学性质 ,都不活泼;
= 2 \* GB3 ②未达到相对稳定结构的原子:若都为同一类原子, 相同,化学性质相似,若不是同一类原子,则不好比较(即同类相同才相似)。
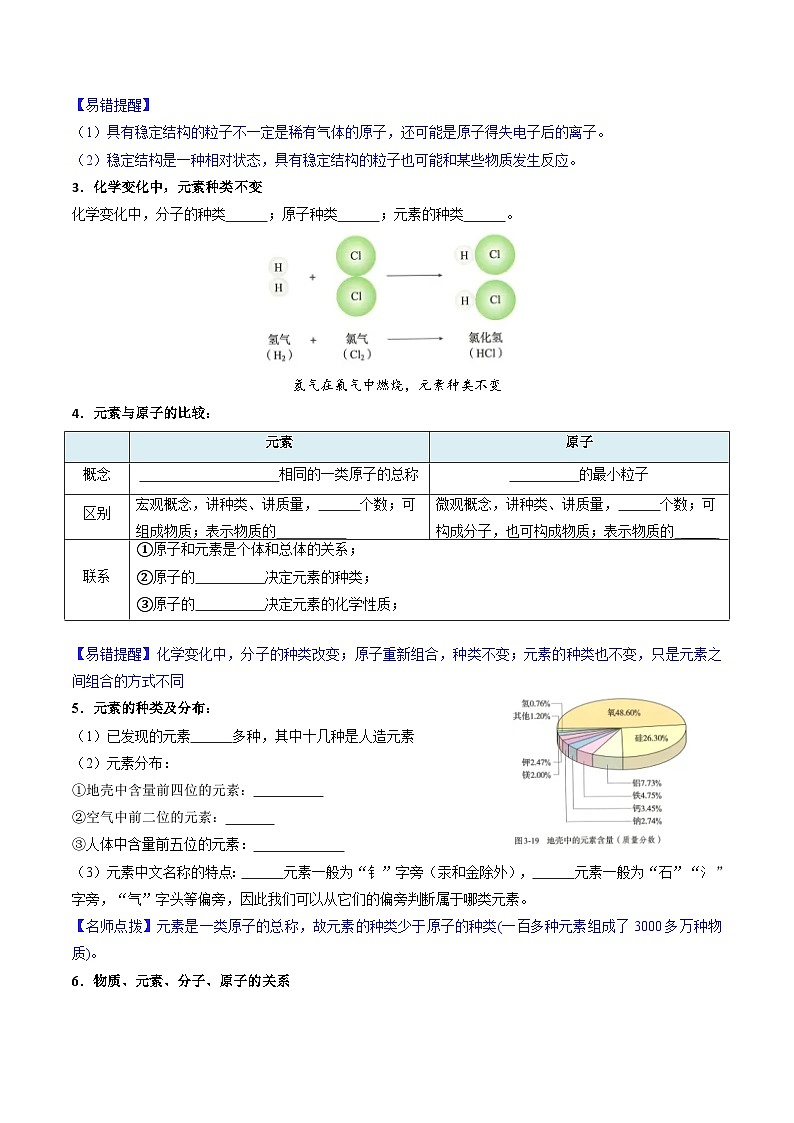
【易错提醒】
(1)具有稳定结构的粒子不一定是稀有气体的原子,还可能是原子得失电子后的离子。
(2)稳定结构是一种相对状态,具有稳定结构的粒子也可能和某些物质发生反应。
3.化学变化中,元素种类不变
化学变化中,分子的种类 ;原子种类 ;元素的种类 。
氢气在氯气中燃烧,元素种类不变
4.元素与原子的比较:
【易错提醒】化学变化中,分子的种类改变;原子重新组合,种类不变;元素的种类也不变,只是元素之间组合的方式不同
5.元素的种类及分布:
(1)已发现的元素 多种,其中十几种是人造元素
(2)元素分布:
①地壳中含量前四位的元素:
②空气中前二位的元素:
= 3 \* GB3 ③人体中含量前五位的元素:
(3)元素中文名称的特点: 元素一般为“钅”字旁(汞和金除外), 元素一般为“石”“氵”字旁,“气”字头等偏旁,因此我们可以从它们的偏旁判断属于哪类元素。
【名师点拨】元素是一类原子的总称,故元素的种类少于原子的种类(一百多种元素组成了3000多万种物质)。
6.物质、元素、分子、原子的关系
7.物质的组成(宏观上)、构成(微观上)的描述
(1)在描述时“元素”与“组成”相匹配:某物质由某 组成;
(2)物质的组成:物质元素组成 。例:水由 和 组成
(3)物质的构成:物质由分子(或原子、离子)构成。例:水由 构成;铁由 构成;氯化钠由 和 构成
(4)分子的构成:分子由原子构成(分子一定由原子构成);每个分子由几个原子构成。
例:水分子由 和 构成;每个水分子由 和 构成。
二、元素符号
1.表示方法:拉丁文名称的第一个字母(第一个字母相同,附加一个小写字母)。书写原则:一大二小。
2.元素符号的意义:
(1)表示意义:
①宏观意义:表示
②微观意义:表示
= 3 \* GB3 ③特殊的:还表示 ( 意义)
例如:“O”表示:①宏观:氧元素、②微观:一个氧原子。
“Fe”表示:①宏观:铁元素、②微观:一个铁原子、 = 3 \* GB3 ③宏观:铁这种物质。
(2)能表示物质的元素符号有:
:如Fe、Cu、Mg、Zn、Na、Al……
稀有气体:如He、Ne、Ar
固态 :S、P、C、Si
(3)元素符号前面加数字:只有 意义,表示该 ,不能表示该元素。
例如:“ H”既表示 又能表示 ;
“2H”表示: ; “3Fe”表示: ;
“5个镁原子”: “ 7个氯原子”:
3.元素符号周围数字的含义
①元素符号前面的数字:表示 。例如: “6N”6表示6个氮原子。
②元素符号右上角的数字:表示 。例如:“O2-”表示氧离子带两个单位的正电荷。
③元素符号右下角的数字:表示 。例如:“H2O”表示每个水分子中含有两个氢原子。
三、元素周期表
1.编制者:俄国科学家
2.结构:共一百多种元素, 个周期16个族(7个横行18个纵行)
①横行:每一横行是 ,共有 个周期。
②纵行:周期表的18个纵行中,除第8、9、10三个纵行共同组成一个族外,其余15个纵行,每一个纵行叫做一个族,共有16个族。
③每格信息:
右图所示是 元素,其原子内质子数为 、元素符号 、相对原子质量为 等。
= 4 \* GB3 ④分区:在周期表中,用不同的颜色对金属元素、非金属元素做了区分。
【易错提醒】
1.根据元素周期表中的某一格图片可知:原子序数、质子数、核电荷数、元素符号、元素名称、是否金属元素、相对原子质量等
2.相对原子质量的精确度一定要与图片提供的信息相同。
3.排列规律
(1)原子序数 = = ;周期数 = ;
(2)横行:
= 1 \* GB3 ①每周期一般以 开头,过渡到 ,以 结尾;
= 2 \* GB3 ②每周期元素的原子 相同;
= 3 \* GB3 ③每周期元素的原子,从左向右 从1依次递增至8。
(3)纵行:
= 1 \* GB3 ①从上到下,元素的原子 相同;
= 2 \* GB3 ②从上到下,元素的原子核外 依次递增。
= 3 \* GB3 ③1~18号元素中, = 主族序数
4.意义:学习和研究化学的重要工具
①为寻找新元素提供了理论依据。
②由于在周期表中位置越靠近的元素性质越相似,可启发人们在元素周期表一定的区域寻找新物质所需的元素,(如农药、催化剂、半导体材料等。)
1.判断题
(1)元素属于宏观概念,只讲种类,不讲个数( )
(2)青少年缺钙会影响生长发育,可通过食物和钙剂结合来进行补钙。这里的“钙”是指元素。( )
(3)钠元素与镁元素的本质区别是质子数不同( )
(4)镁原子(Mg)和镁离子(Mg2+)都属于镁元素,它们具有相同的化学性质( )
(5)电子数相同的粒子一定是同种元素。( )
(6)硒的相对原子质量是78.96g。( )
(7)属于同一元素的原子,它们一定相同的是原子核构成( )
(8)《物质构成的奥秘》告诉我们:元素的种类、化学性质分别与质子数、中子数密切相关。( )
(9)地壳中最多的金属元素是氧元素。( )
(10)N可以表示氮元素、一个氮原子、氮气。( )
(11)Na既可以表示钠元素、一个钠原子,也可以表示单质钠。( )
(12)一般情况下,元素周期表中每一周期的元素以金属元素开头,过渡到非金属元素,以稀有气体元素结尾,周期表呈现周期性的变化规律。( )
(13)粒子的结构示意图为2层,说明对应的元素可能处于第二周期( )
(14)原子的种类由最外层电子数决定。( )
(15)元素周期表中有7个横行,为7个周期,同周期的元素,原子核外电子层数相同,18个纵行,为18个族。( )
(16)氧是地壳中含量最高的非金属元素,铝是地壳中含量最高的金属元素( )
(17)氟,钙,硒,碘属于人体必需元素,属于金属元素的是钙( )
(18)原子序数为7的元素,元素符号为O( )
(19)不同的原子,质子数不同,所以质子数决定原子种类。( )
(20)Au既可以表示一个原子,又可以表示一种元素,还可以表示一种物质( )
(21)CO2、H2O2、SO2三种物质中都含有氧元素( )
(22)一种放射性元素为碳14,该原子核内有6个质子和8个中子,碳12原子和碳14原子是同种元素的不同原子( )
(23)原子序数为7的元素,属于金属元素( )
(24)元素周期表中,每一横行表示一个周期,从左到右,元素的核电荷数逐渐变大,电子层数不变;每一竖列表示一个族,从上到下,元素的电子层数逐渐增多,同一族中的元素化学性质相似。( )
2.指出下列符号的意义:
(1)F 、 ;
(2)3S ;
(3)Na 、 、 ;
(4)5P 。
3.根据下图回答下列问题。
(1)钠的相对原子质量为 。
(2)两种元素中属于非金属元素的是 。
(3)钠元素与氯元素的本质区别是 不同。
4.硒是人体所需的微量元素,湘西地区土壤中硒的含量较高。据图回答:
(1)硒元素的相对原子质量是 ;
(2)图D表示的微粒在化学反应中容易 (填“得到”或“失去”)电子;
(3)A、B、C、D中表示金属元素的是________(填序号)。
A. B.C.D.
5.下表为元素周期表的部分元素的相关信息,利用下表回答相关问题。
(1)最早提出现代元素周期律的俄国化学家是 。
(2)请画出16号元素原子结构示意图 ,化学反应中该原子比较容易 (填“得到”或“失去”)电子变成离子;
(3)表示的是 (填离子符号);
(4)上表中第二、三周期元素最外层电子数的变化规律是 。
►问题一 元素的概念
【典例1】决定元素种类的是
A.中子数B.质子数C.核外电子数D.最外层电子数
【解题必备】
(1)不同元素之间的本质区别是:质子数不同;
(2)元素是质子数相同的一类原子的总称,故元素的种类少于原子的种类;
(3)元素的种类由质子数决定;元素的化学性质由最外层电子数决定;
(4)食品、药品中的“钙”、“铁”“锌”等均为元素,不是物质或原子。
【变式1-1】在食盐中加入碘酸钾(KIO3)得到加碘盐。加碘盐中的“碘”指的是
A.碘分子B.碘原子C.碘离子D.碘元素
【变式1-2】重氢可应用于光导纤维制备。重氢和氢都属于氢元素,是因为它们的原子具有相同的
A.质子数B.中子数C.体积D.相对原子质量
►问题二 元素符号
【典例2】下列各组元素符号的第一个字母相同的是
A.氦、氖、氩B.镁、银、汞C.锂、铁、铝D.铜、钙、氯
【解题必备】
元素符号书写原则:第一个字母大写,第二个字母小写;
元素符号表示的含义:表示一种元素;表示一个原子;有的还表示一种物质;
若元素符号前面有数字,则只具有微观意义,表示几个原子。
【变式2-1】下列符号中,表示两个铁原子的是
A.B.C.D.
【变式2-2】化学元素与人体健康紧密相关。人体中含量最多的金属元素是
A.OB.AlC.CaD.Na
►问题三 元素周期表
【典例3】硒有防癌作用。硒在元素周期表中的部分信息如图所示。以下信息正确的
A.硒元素属于金属元素B.硒原子的质子数为34
C.硒原子的中子数为34D.硒元素相对原子质量为
【解题必备】
(1)元素周期表有七个周期16个族;
(2)每格提供的信息有:原子序数(等于核电荷数、质子数)、元素符号、元素名称、相对原子质量;从元素名称的偏旁部首还可推知该元素属于金属元素还是非金属元素;
(3)每一周期从左向右,以金属元素开头,过渡到非金属元素,以稀有气体元素结尾;
【变式3-1】如图是元素周期表的一部分,下列说法错误的是
A.甲元素的符号是HeB.氖原子的结构示意图
C.氮元素的相对原子质量是14.01D.原子序数:乙>丙>甲
【变式3-2】元素周期表是学习化学的重要工具。下表是元素周期表中的一部分,请回答下列问题:
(1)上表中①所示元素的名称是 ,地壳中含量最多的金属元素的原子序数是 。
(2)X2-与Ar的核外电子排布相同,则X的元素符号是 ,它在元素周期表中位于第 周期。
(3)元素周期表中同族和同周期元素具有一定的相似性和变化规律,同族元素化学性质相似的原因是 相同。
►问题四 元素周期表信息与结构示意图综合考查
【典例5】元素周期表是研究化学的重要化学工具,下图是几种元素在元素周期表中的相对位置以及部分信息。请回答下列问题:
(1)下列说法不正确的是 (填写字母标号)。
A.氯原子的核外电子数为17,最外层电子数为7
B.磷的相对原子质量为15
C.根据X元素的位置推出其质子数为16
D.保持氧气化学性质的最小粒子是O原子
(2)图2所示粒子共表示 种元素。X元素的化学性质与图2中 的化学性质相似(填写字母标号)。
(3)氯化镁是由 (填具体粒子的化学符号)构成的,写出镁与氯气点燃生成氯化镁的方程式 。
(4)稀有气体氩原子序数是18,其化学性质很不活泼的原因是 。
【解题必备】
(1)相同横行(周期)元素的原子电子层数相同;从左向右最外层电子数从1依次递增至8。
(2)相同纵列元素的原子最外层电子数相同;从上到下电子层数依次递增。
(3)一般地,相同纵列的元素有相似化学性质(氢、氦除外)
【变式5-1】元素周期表中部分元素的相关信息如下图所示,回答下列问题。
(1)12号元素属于 (填“金属”或“非金属”)元素,它的离子符号是 。
(2)16号元素符号是 ,请画出16号元素原子结构示意图 ,最外层电子数为 。
(3)在第三周期中,各元素的原子从左到右由易 (填“得到”或“失去”,下同)电子到易 电子,最后是稳定结构。
(4)元素周期表同一横行元素的排列规律是:从左到右 (写一点)。
(5)不同元素最本质的区别是 ;科学家宣布已人工合成了第116号元素,则此元素的核电荷数是 。
(6)锂元素和钠元素的化学性质相似,是因为锂原子和钠原子的 。
(7)地壳中含量最多的元素名称是 ,含量最多的金属元素是 。
【变式5-2】元素周期表是能从微观结构角度分析宏观元素及对应物质性质的重要工具。请分析信息并回答问题:
(1)地壳中含量最多的金属元素的原子序数是
(2)H+核外电子数为 ;9号元素的原子在化学反应中易 (填“得到”或“失去”)电子形成 (用微粒符号表示)。
(3)从表中我们可以知道同一周期元素原子结构有什么规律? 。
(4)碘原子的结构示意图如图所示,试推断碘元素在周期表的第 周期。碘元素与 元素具有相似的化学性质,原因是 。有人认为He和Mg化学性质也相似,这种说法是否正确,为什么?
1.地壳中含量最多的金属元素是
A.氧B.硅C.铝D.铁
2.如图为某品牌矿泉水标签的部分内容。下列说法正确的是
A.“钾”指的是元素B.“硅”是金属元素
C.“钠”指的是分子D.该矿泉水是纯净物
3.水是由氢、氧两种元素组成,这两种元素的本质区别是
A.质子数不同B.中子数不同
C.电子数不同D.最外层电子数不同
4.下列属于同种元素的是
A.②③B.①④C.①②③④D.①②③
5.下列符号能表示两个氢原子的是
A.B.C.D.
6.下图是四种微粒的结构示意图。下列有关说法错误的是
A.②③属于不同种元素B.当X的数值为10时,①表示一种原子
C.②属于金属元素D.④在化学反应中易得电子形成阳离子
7.磷酸亚铁锂是一种锂离子电池电极材料。下图是元素周期表中锂、磷两种元素的相关信息。下列说法中错误的是
A.锂和磷都属于金属元素B.锂原子的质子数为3
C.磷原子的核外电子数为15D.磷的相对原子质量为30.97
8.2022年2月第24届冬奥会在北京完美落幕。其中碲化镉发电玻璃成为绿色和科技办奥交汇的创新点。如图是碲在元素周期表中的部分信息和原子结构示意图,有关说法正确的是
A.碲是金属元素B.X=73
C.碲的相对原子质量为127.6gD.碲原子在化学反应中容易得到电子,Y=6
9.元素周期表是学习化学的重要工具。如下图是元素周期表的一部分,请回答下列问题:
(1)氟原子的相对原子质量为 。
(2)原子序数为13的元素的原子结构示意图为 。
(3)表中同一周期元素的原子 相同。
(4)在下图微粒结构示意图中:
①A~G共有 种元素;
②表示阳离子的微粒有 (填字母序号);
③化学性质相似的微粒组合有 (填字母序号)。
10.如图A~D是某些原子的结构示意图,F为元素周期表中的一部分,请回答下列问题。
(1)A~D粒子在化学反应中容易得到电子的是 (填字母)。
(2)若E中x=12,则该粒子的符号为 。
(3)X、Y、Z代表三种不同元素,其中X、Y属于同一 (填“周期”或“族”)。
(4)Y、Z两种原子具有相同的 数。
11.建立宏观、微观、符号三者之间的联系是化学学科重要的思维方式。图1为元素周期表中的一部分,图2中A、B、C表示三种粒子的结构示意图。请回答下列问题。
(1)图1,氮元素的符号是 ,氧和硫属于同 (选填“周期”或“族”)元素。
(2)图2,A、B、C三种粒子属于相对稳定结构的是 (填字母)。
(3)结合图1分析,图2中微粒B的名称是 。若C为带两个单位负电荷的某离子结构示意图,其离子符号为 。
12.元素周期表是学习和研究化学的重要工具,它的内容十分丰富。下图是元素周期表的部分内容,请认真分析并回答后面的问题:
(1)请从上表中查出地壳中含量最多的金属元素的相对原子质量为 。
(2)表中不同种元素最本质的区别是_______(填序号)。
A.相对原子质量不同B.质子数不同C.中子数不同
(3)元素周期表中每一个横行叫做一个周期,通过分析,同一周期元素之间的排列有一定的规律,如:_______(填序号)。
A.从左到右,各元素原子的电子层数相同
B.从左到右,各元素原子的原子序数依次增加
C.从左到右,各元素原子的最外层电子数相同
(4)元素周期表中,原子序数为17的氯元素的原子结构示意图如图,该原子在化学反应中易 (填“得到”或“失去”)电子。说明元素的化学性质与原子的 关系密切。
1.1932年,美国化学家H.C.尤里等发现了一种质子数与氢原子相同,但中子数比氢原子多一个的新原子,关于这种原子的说法中,正确的是。
A.是与氢原子相同的原子B.是氢元素的另一种原子
C.是一种新元素D.是与氢元素不同类的原子
2.如图是元素周期表的一部分,以下表述正确的是
A.氟原子核内的中子数为9B.氟、硫、氯的原子都容易得电子
C.氯原子的相对原子质量是35.45gD.氟和氯位于元素周期表同一周期
3.碘元素是人体合成甲状腺激素的必要成分。碘元素在元素周期表中的部分信息及碘原子、氯原子的原子结构示意图如图所示。下列说法不正确的是
A.碘的相对原子质量为126.9gB.碘原子在化学反应中易得电子
C.碘元素和氯元素化学性质相似D.碘元素和氯元素的本质区别是原子的质子数不同
4.元素周期表是学习和研究化学的重要工具。图甲是元素周期表的部分内容,图乙是某些粒子的结构示意图。下列说法不正确的是
A.X的核电荷数为17
B.两图共涉及五种元素
C.图乙中,a易得到2个电子形成阴离子
D.图乙中,b和d是具有相对稳定结构的原子
5.元素周期表前18号元素按原子序数递增的顺序排成图1所示的图形,图中数字为元素的原子序数。图2为三种微粒的结构示意图。下列有关说法错误的是
A.图1中3号至10号元素的原子核外电子都有两层
B.B的化学符号为F-
C.若A表示某原子,则x=8
D.C元素位置应与11~18号元素中Na紧挨
6.资料显示,原子半径主要受原子核外电子层数和核电荷数影响。一般来说,电子层数越多,原子半径越大; 当电子层数相同时,核电荷数越多,半径越小。根据这一规律,下列说法不正确的是
A.原子半径: r(S)>r(O)
B.半径: r(Mg)>r(Mg2+)
C.半径: r(Al3+)>r(F-)
D.元素周期表中第三周期元素中原子半径最大的是钠
7.1998年7月8日,全国科学技术名称审定委员会公布了101-109号元素的中文定名.而早在1996年2月,德国达姆施塔特重离子研究所就合成出当时最重的人造元素,它是由7030Zn撞入一个20882Pb的原子核,并立即释放一个中子而产生的一种新元素的原子.该元素的原子序数是( )
A.111B.112C.113D.114
8.如图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图.请你回答:
(1)钙元素的相对原子质量为 ,氟元素属于第 周期的元素;
(2)X= ;
(3)A、B、C、D属于同种元素的粒子是 (填序号);
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似 (填序号)。
9.元素周期表是学习和研究化学的重要工具。下图是元素周期表的一部分,根据下表回答问题。
(1)空气中含量最多的元素是 (填写元素符号)。
(2)元素所在的周期数和它的原子结构中 相等。
(3)S2-的核外电子数为 ,一个OH-含有 个电子。
(4)He和Mg化学性质 (填写“相似”,“不相似”),理由是 。
10.图一是硅原子及A、B、C、D四种粒子的结构示意图,图二是部分元素周期表,请回答下列问题:
(1)硅单质的构成微粒与金属单质相同,则构成硅单质的微粒是 ;图一中x的值是 ;A B、C、D四种粒子共表示 种元素。
(2)图一A、B、C、D中与硅元素化学性质相似的是 (填字母序号),达到稳定结构的是 (填字母序号)。
(3)图二①、②、④三处元素中,与③处元素属于同一周期的是 (填序号,下同),与③处元素属于同一族的是 。
11.图a 是铯元素在元素周期表中的信息,图b 是铝原子结构示意图,图C 为元素周期表的一部分,X、Y、Z 代表三种不同元素。
(1)由图a 可知,铯元素属于 (“金属”或“非金属”)元素;其核外有 个电子;
(2)图b 方框内的数字是 ;该原子在化学反应中容易 (填“失去”或“得到”)电子,形成稳定结构,其离子符号为 ;
(3)有关图C 的说法,正确的是 (填序号)。
A.原子序数:Z>Y B.核外电子数:X=Y C.Y 和Z 同处于第二周期
12.元素周期表是学习化学的重要工具,下表为元素周期表中部分元素的相关信息,利用下表回答相关问题。
(1)C、N、O排在同一周期是因为 (填“质子数”“电子层数”或“最外层电子数”)相同。
(2)He和Mg的化学性质 (填 “相似”或“不相似”)。
(3)钠离子核外电子排布与 (填元素符号)原子核外电子排布相同。
(4)一个含有 个电子。
(5)一般地说,电子层数相同的原子,原子的半径随原子序数的递增而减小(稀有气体除外);最外层电子数相同的原子,原子的半径随电子层数的增加而增大。
请比较:氮原子半径 (填“>”或“<”,后同)磷原子半径;钠原子半径 铝原子半径。
13.核电荷数为1—18的元素的原子结构示意图等信息如下图所示,回答下列问题。
(1)图中3至10号元素位于第二周期,11至18号元素位于第三周期,分析其规律可知,每一周期元素原子的 相同;在同一周期中,各原子核外电子排布的规律是 。
(2)图中9号和17号元素原子最外层电子数相同,都易 (填“得到”或”失去”)电子。
(3)在第三周期中,元素类型的变化情况是:从左到右,由 元素过渡到 元素,并以稀有气体元素结尾。(均填“金属”或“非金属”)
(4)2号和12号元素原子最外层电子数相同,所以,它们的化学性质也相同,这个观点对吗?如果不对,请解释原因 。
(5)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个阳离子: ,阴离子: 。
(6)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列元素序号表示具有相似化学性质的是 (填字母序号)。
a、6和10 b、4和12 c、13和14 d、9和17
(7)碳12原子的质量为1.993×10-26kg,一种铁原子的质量为9.288×10-26kg,计算该铁原子的相对原子质量(保留小数点后一位)。了解元素的概念,认识物质是由元素组成的,知道元素在地壳中的含量。
能够正确书写常见元素的名称和符号,了解元素符号的意义。
认识元素周期表,了解元素周期表每格的信息和元素在周期表中的排列规律。
重点:
元素的概念
难点:
对元素的概念的理解
质子数相同
中子数不同的氢原子
质子数相同的
原子和离子
质子数相同的
粒子
名称
普通氢(氕)
重氢(氘)
超重氢(氚)
钠原子
Na
钠离子
Na+
氖原子
Ne
水分子
H2O
氨分子
NH3
示意图
质子数
1
1
1
11
11
10
10
10
中子数
0
1
2
12
12
10
10
10
电子数
1
1
1
11
11
10
10
10
结论
是同种元素:氢元素
是同种元素:钠元素
不是同种元素
元素
原子
概念
相同的一类原子的总称
的最小粒子
区别
宏观概念,讲种类、讲质量, 个数;可组成物质;表示物质的
微观概念,讲种类、讲质量, 个数;可构成分子,也可构成物质;表示物质的 _____
联系
①原子和元素是个体和总体的关系;
②原子的 决定元素的种类;
③原子的 决定元素的化学性质;
④化学变化中原子和元素的种类均不发生变化。
主要成分含量(mg/L)
锶………………0.1~1.8
偏硅酸…………25~60
钾………………2~8
钠………………8~40
1 H
氢
1.008
IIA
IIIA
IVA
VA
VIA
VIIA
2
氦
4.003
3
锂
6.941
4
铍
9.012
5 B
硼
10.81
6 C
碳
12.01
7 N
氮
14.01
8 O
氧
16.00
9 F
氟
19.00
10
氖
20.18
11
钠
22.99
12
镁
24.31
13
铝
26.98
14
硅
28.09
15 P
磷
30.97
16 S
硫
32.06
17
氯
35.45
18
氩
39.95
相关试卷
这是一份初中化学人教版(2024)九年级上册课题3 元素同步达标检测题,共47页。
这是一份人教版九年级化学上册同步考点解读与专题训练3.3元素(考点解读)(原卷版+解析),共33页。试卷主要包含了元素的概念,C-13,元素周期表的特点及其应用等内容,欢迎下载使用。
这是一份人教版九年级化学上册同步考点解读与专题训练3.3元素(专题训练)【五大题型】(原卷版+解析),共28页。










