

所属成套资源:【寒假自习】人教版(2019)高中化学 高二上册(选择性必修2)寒假专题复习训练
- 【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第01讲 原子结构(原卷版+解析版) 试卷 0 次下载
- 【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第03讲 共价键(原卷版+解析版) 试卷 0 次下载
- 【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第04讲 分子的空间结构(原卷版+解析版) 试卷 0 次下载
- 【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第05讲 分子结构与物质的性质(原卷版+解析版) 试卷 0 次下载
- 人教版(2019)高中化学 高二上册 (选择性必修3)【寒假预习衔接】第01讲 有机化合物的结构特点 (教师版+学生版) 学案 0 次下载
【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第02讲 原子结构与元素的性质(原卷版+解析版)
展开
这是一份【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第02讲 原子结构与元素的性质(原卷版+解析版),文件包含人教版2019高中化学选择性必修2专题复习第02讲原子结构与元素的性质原卷版docx、人教版2019高中化学选择性必修2专题复习第02讲原子结构与元素的性质解析版docx等2份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
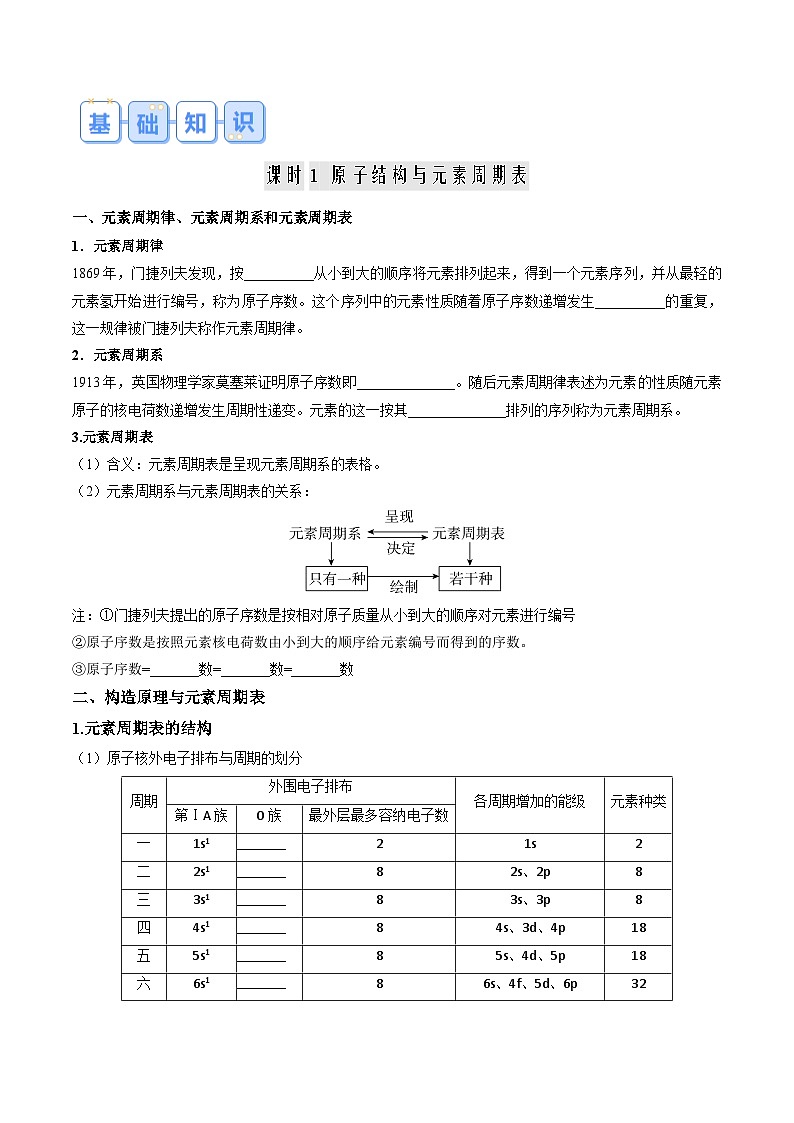
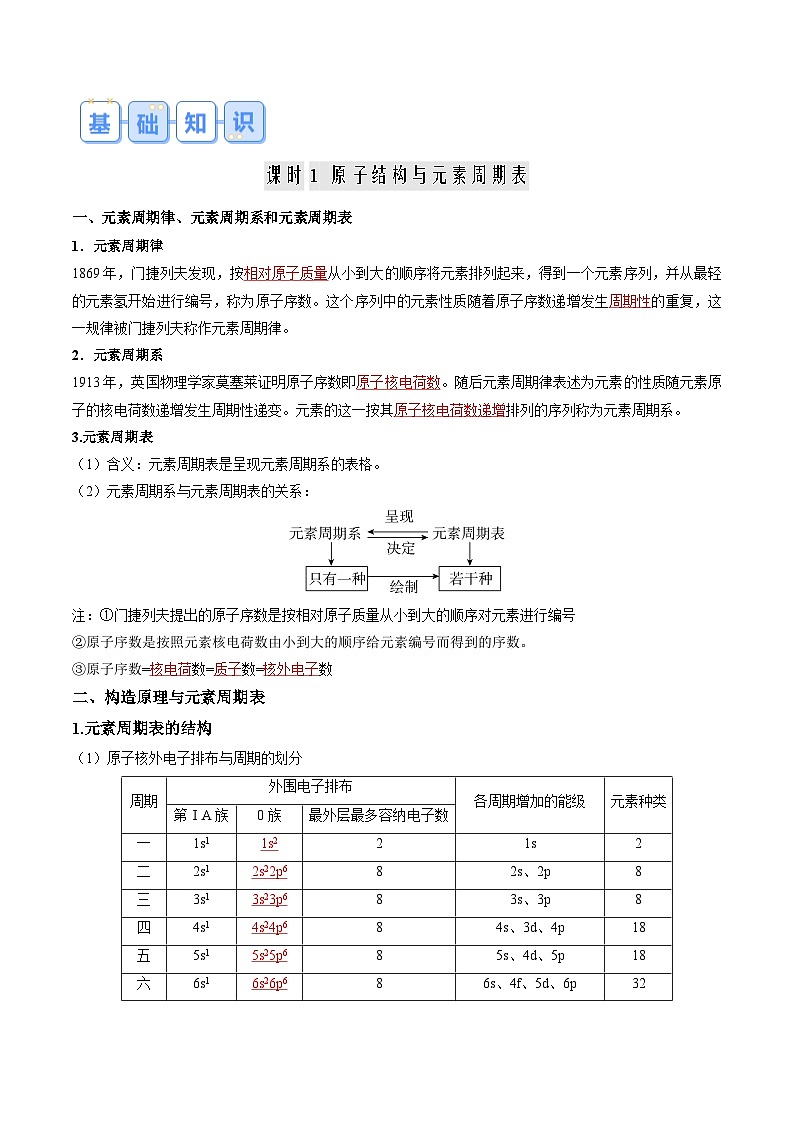
课时1 原子结构与元素周期表
一、元素周期律、元素周期系和元素周期表
1.元素周期律
1869年,门捷列夫发现,按相对原子质量从小到大的顺序将元素排列起来,得到一个元素序列,并从最轻的元素氢开始进行编号,称为原子序数。这个序列中的元素性质随着原子序数递增发生周期性的重复,这一规律被门捷列夫称作元素周期律。
2.元素周期系
1913年,英国物理学家莫塞莱证明原子序数即原子核电荷数。随后元素周期律表述为元素的性质随元素原子的核电荷数递增发生周期性递变。元素的这一按其原子核电荷数递增排列的序列称为元素周期系。
3.元素周期表
(1)含义:元素周期表是呈现元素周期系的表格。
(2)元素周期系与元素周期表的关系:
注:①门捷列夫提出的原子序数是按相对原子质量从小到大的顺序对元素进行编号
②原子序数是按照元素核电荷数由小到大的顺序给元素编号而得到的序数。
③原子序数=核电荷数=质子数=核外电子数
二、构造原理与元素周期表
1.元素周期表的结构
(1)原子核外电子排布与周期的划分
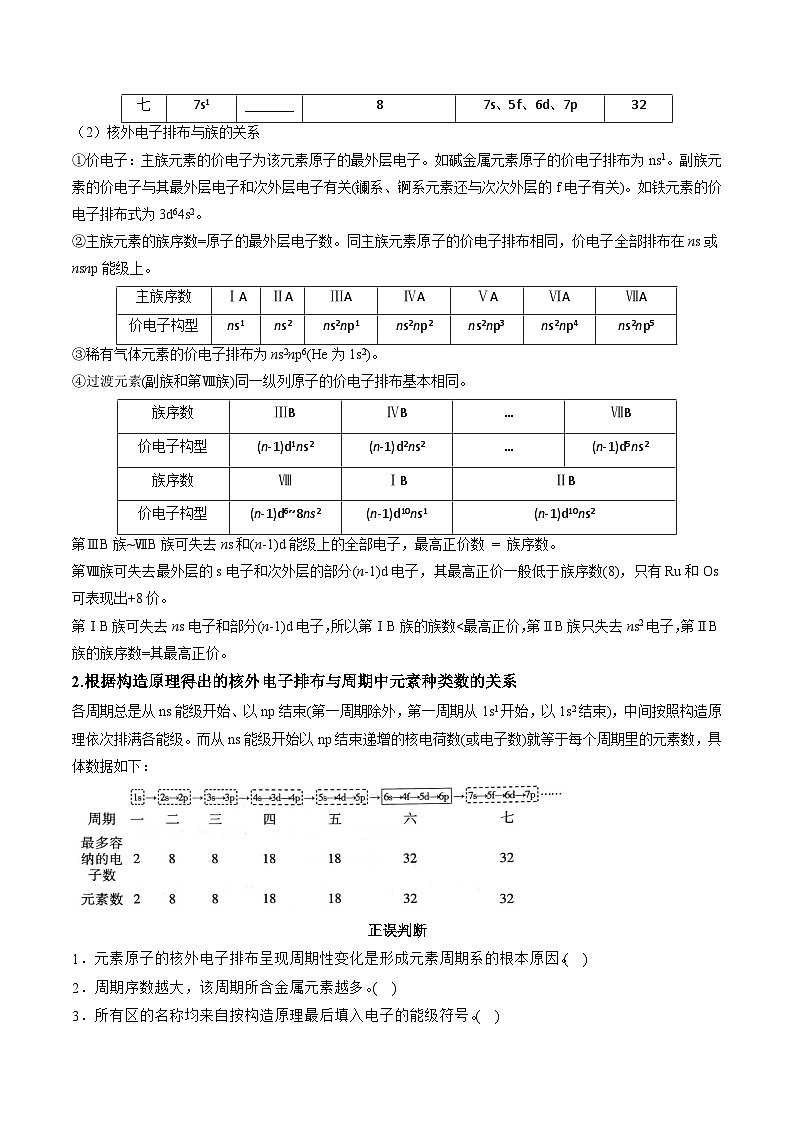
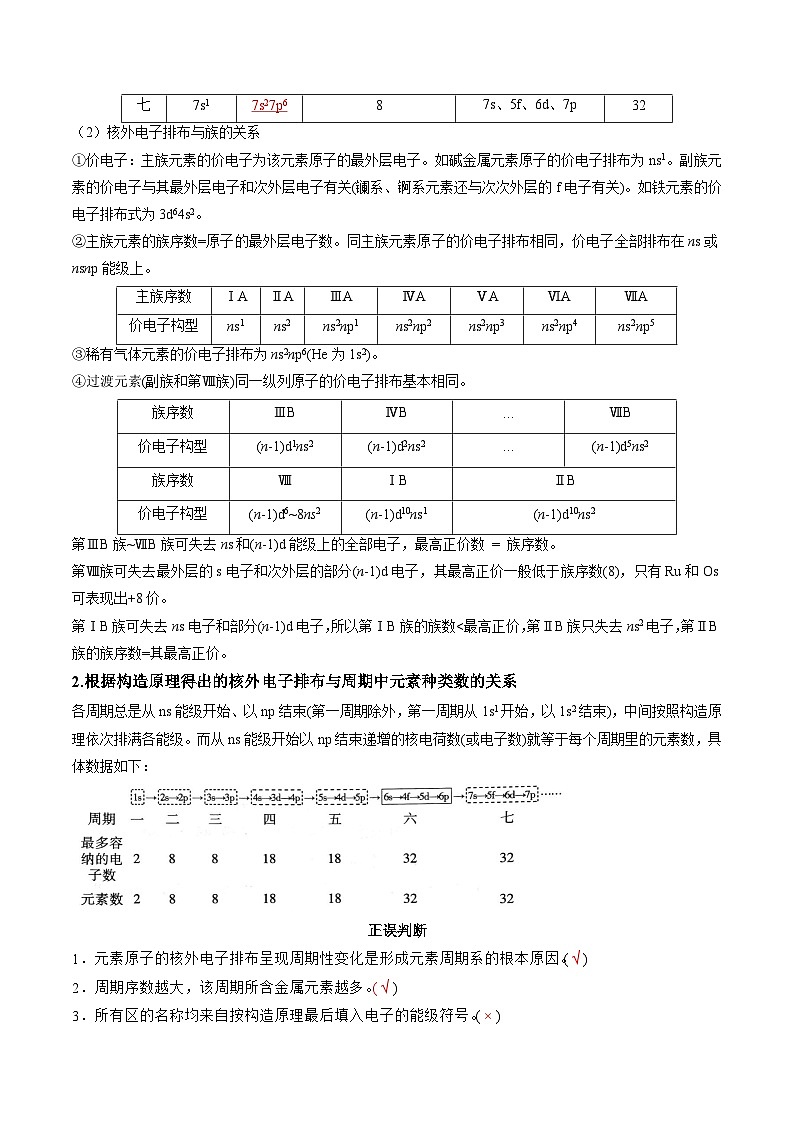
(2)核外电子排布与族的关系
①价电子:主族元素的价电子为该元素原子的最外层电子。如碱金属元素原子的价电子排布为ns1。副族元素的价电子与其最外层电子和次外层电子有关(镧系、锕系元素还与次次外层的f电子有关)。如铁元素的价电子排布式为3d64s2。
②主族元素的族序数=原子的最外层电子数。同主族元素原子的价电子排布相同,价电子全部排布在ns或nsnp能级上。
③稀有气体元素的价电子排布为ns2np6(He为1s2)。
④过渡元素(副族和第Ⅷ族)同一纵列原子的价电子排布基本相同。
第ⅢB族~ⅦB族可失去ns和(n-1)d能级上的全部电子,最高正价数 = 族序数。
第Ⅷ族可失去最外层的s电子和次外层的部分(n-1)d电子,其最高正价一般低于族序数(8),只有Ru和Os可表现出+8价。
第ⅠB族可失去ns电子和部分(n-1)d电子,所以第ⅠB族的族数r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
②同主族元素,随着电子层数递增,其原子半径逐渐增大。
例:r(Li)r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
②电子层结构相同的微粒,核电荷数越大,半径越小。
例:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
③带相同电荷的离子,电子层数越多,半径越大。
例:r(Li+)r(Mg2+)
正误判断
1.核外能层结构相同的单核粒子,半径相同。( × )
2.质子数相同的不同单核粒子,电子数越多,半径越大。( √ )
3.各元素的原子半径总比其离子半径大。( × )
4.同周期元素从左到右,原子半径、离子半径均逐渐减小。( × )
二、电离能
1.第一电离能
(1)定义:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。
(2)符号和单位:常用符号I表示,常用单位是kJ·ml-1。
(3)意义:衡量元素的原子失去一个电子的难易程度。
第一电离能数值越小,原子越容易失去一个电子;第一电离能数值越大,原子越难失去一个电子。
(4)变化规律
①每个周期的第一种元素(氢和碱金属)第一电离能最小,稀有气体元素原子的第一电离能最大,同周期中从左到右元素的第一电离能呈增大的趋势。
②同主族元素原子的第一电离能从上到下逐渐减小。
③同一周期中,第ⅡA族元素的第一电离能比第ⅢA族元素的第一电离能要大,第ⅤA族元素的第一电离能比第ⅥA族元素的第一电离能要大,这是因为第ⅡA族元素的最外层p轨道全空,第ⅤA族元素的最外层p轨道半满,全空和半满状态相对稳定。
总之,第一电离能的周期性递变是原子半径、核外电子排布周期性变化的结果。
2.逐级电离能
(1)含义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,依次类推。可以表示为 M(g)=M+(g)+e- I1(第一电离能)
M+(g)=M2+(g)+e- I2(第二电离能)
M2+(g)=M3+(g)+e- I3(第三电离能)
(2)变化规律
①同一元素的逐级电离能是逐渐增大的,即I1< I2< I3
相关试卷
这是一份【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第05讲 分子结构与物质的性质(原卷版+解析版),文件包含人教版2019高中化学选择性必修2专题复习第05讲分子结构与物质的性质原卷版docx、人教版2019高中化学选择性必修2专题复习第05讲分子结构与物质的性质解析版docx等2份试卷配套教学资源,其中试卷共36页, 欢迎下载使用。
这是一份【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第04讲 分子的空间结构(原卷版+解析版),文件包含人教版2019高中化学选择性必修2专题复习第04讲分子的空间结构原卷版docx、人教版2019高中化学选择性必修2专题复习第04讲分子的空间结构解析版docx等2份试卷配套教学资源,其中试卷共37页, 欢迎下载使用。
这是一份【巩固复习】人教版(2019)高中化学(选修性必修2)寒假专题复习 第03讲 共价键(原卷版+解析版),文件包含人教版2019高中化学选择性必修2专题复习第03讲共价键原卷版docx、人教版2019高中化学选择性必修2专题复习第03讲共价键解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。










