





第7讲 离子交换膜在电化学中的应用 课件 2025高考化学二轮复习
展开
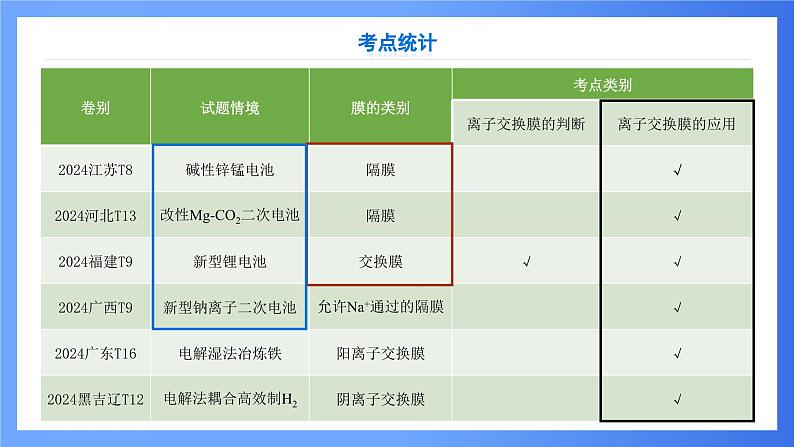
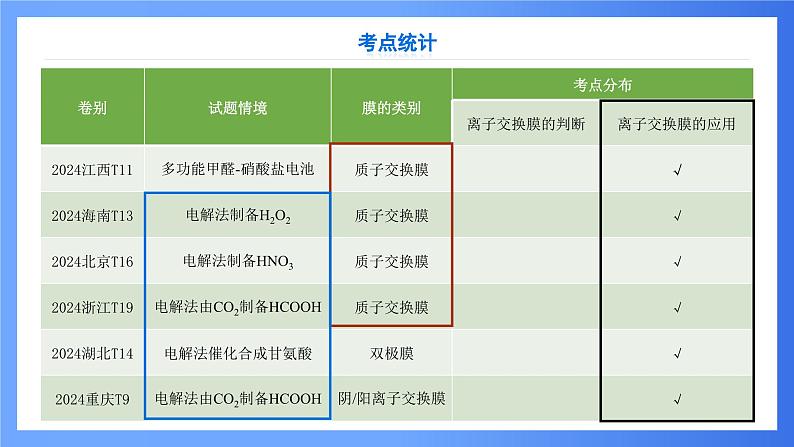
这是一份第7讲 离子交换膜在电化学中的应用 课件 2025高考化学二轮复习,共34页。PPT课件主要包含了考点统计,阴离子交换膜,阳离子交换膜,双极膜,质子交换膜,单膜双室,双膜三室,多膜多室,两室法电解饱和食盐水,三室法电解硫酸钠溶液等内容,欢迎下载使用。
1.常见的隔膜隔膜又叫离子交换膜,离子交换膜是具有离子交换性能的,对溶液中的离子具有选择性透过能力的高分子特殊材料薄膜。1950年W∙朱达首先合成了离子交换膜。1956年首次成功地用于电渗析脱盐工艺上。离子交换膜在应用时,主要利用它的离子选择透过性,由于制膜的主要原料是离子交换树脂,故又称为离子交换(树脂)膜。离子交换膜具有非常广泛的应用,它是分离装置、提纯装置以及电化学组件中的重要组成部分,在氯碱工业、水处理工业、重金属回收、湿法冶金以及电化学工业等领域都起到举足轻重的作用。2.离子交换膜分四类:(1)阳离子交换膜,简称阳膜,只允许阳离子通过,即允许H+和其他阳离子通过,不允许阴离子或分子通过。(2)阴离子交换膜,简称阴膜,只允许阴离子通过,不允许阳离子或分子通过。(3)质子交换膜,只允许H+通过,不允许其他阳离子和阴离子通过。(4)双极性膜,膜的一侧为阳膜,只允许阳离子通过,另一侧为阴膜,只允许阴离子通过。
阴离子交换膜、阳离子交换膜
离子选择性定向移动、维持电荷守恒
阴极:放氢生碱2H2O +2e- = H2↑ +2OH-
阳极:2Cl--2e- = Cl2↑
为什么用阳离子交换膜?
电解硫酸钠溶液产生硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1∶2。
阳极:放氧生酸2H2O-4e- = O2↑ +4H+
Na+SO42-
两膜三室电解硫酸钠溶液
三膜四室电解制备Ca(H2PO4)2
CaCl2溶液浓度减小
膜两侧相同离子与膜的类别是否有关系?
双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。
2Br--2e- = Br2↑失电子为阳极
所得Br2继续氧化乙二醛为乙醛酸OHCCHO+Br2+ 2OH- =HOOCCHO+H2O+2Br-
乙二酸得电子转化为乙醛酸HOOCCOOH+ 2e- + 2H+ =HOOCCHO+H2O
四膜五室电解氯化钠溶液制备HCl和NaOH
阴极:放氢不生碱2H+ +2e- = H2↑
阳极:放氧不生酸4OH- -4e- = O2↑ +2H2O
NaCl溶液浓度减小a>b
四膜五室NaBr溶液的电渗析装置
阳极:OH--4e- = O2↑ +2H2O
阴极:2H+ +2e- = H2↑
Na2SO4溶液浓度不变
Li1-xCO2 +xe-+xLi+===LiCO2
LixC6 - xe-===xLi++6C
放电时,石墨层间的Li失去电子变为Li+ ,电子经导线流向正极, Li+通过隔膜向正极移动,进入正极材料的空隙,同时变价金属得电子化合价降低,与Li+形成化合物。
总反应: LixC6 + Li1-xCO2 ====LiCO2 + 6C
1.(2024·福建T9)一种兼具合成功能的新型锂电池工作原理如图。电解质为含Li+有机溶液。放电过程中产生(CF3SO2)2NLi,充电过程中电解LiCl产生Cl2。下列说法正确的是
A.交换膜为阴离子交换膜B.电解质溶液可替换为LiCl水溶液C.理论上每生成1mlCl2,需消耗2mlLiD.放电时总反应:6Li+ N2+4CF3SO2Cl =2(CF3SO2)2NLi +4LiCl
正极:N2+6e- +6Li+= 2Li3N
2Li3N+4CF3SO2Cl =2(CF3SO2)2NLi +4LiCl
2.(2024·河北T13)我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。下列说法错误的是
A.放电时,电池总反应为2CO2+Mg=MgC2O4B.充电时,多孔碳纳米管电极与电源正极连接C.充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移D.放电时,每转移1ml电子,理论上可转化1ml CO2
CO2得电子为正极:2CO2 + 2e- + Mg2+ = MgC2O4
负极:Mg - 2e- = Mg2+
3.(2022·全国甲T10)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以Zn(OH)42-存在)。电池放电时,下列叙述错误的是
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移B.Ⅰ区的SO42-通过隔膜向Ⅱ区迁移C. MnO2电极反应:MnO2+2e-+4H+=Mn2++2H2OD.电池总反应:Zn+4OH-+MnO2+4H+=Zn(OH)42-+Mn2++2H2O
两侧均有K+,为阳离子交换膜
两侧均有SO42- ,为阴离子交换膜
MnO2+2e-+4H+=Mn2++2H2O
Zn —2e- +4OH-=Zn(OH)42-+2H2O
4. (2022 ·河北T12)科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如图。
两侧均为NaOH,无法直接判定
[Fe(CN)6]4- —e- =[Fe(CN)6]3—
DHPS+2H2O +2e- = DHPS-2H +2OH-
DHPS-2H=DHPS+H2
4[Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O
5.(2023·湖北T10)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为xml∙h-1。下列说法错误的是
A.b电极反应式为2H2O+2e-=H2↑+2OH- B.离子交换膜为阴离子交换膜C.电解时海水中动能高的水分子可穿过PTFE膜 D.海水为电解池补水的速率为2xml∙h-1
4OH――4e-=O2↑+2H2O
6.(2024·江西T11)我国学者发明了一种新型多功能甲醛﹣硝酸盐电池,可同时处理废水中的甲醛和硝酸根离子(如图)。下列说法正确的是
A.CuAg电极反应为2HCHO+2H2O﹣4e﹣═2HCOO﹣+H2↑+2OH﹣B.CuRu电极反应为NO3﹣+ 6H2O+8e﹣═NH3↑+9OH﹣C.放电过程中,OH﹣通过质子交换膜从左室传递到右室D.处理废水过程中溶液pH不变,无需补加KOH
NO3﹣+6H2O+8e﹣═NH3↑+9OH﹣
2HCHO+4OH-﹣2e﹣═2HCOO﹣+H2↑+2H2O
8HCHO+ NO3﹣+7OH-=NH3↑+8HCOO-+4H2↑+2H2O
7.(2024·湖北T14)我国科学家设计了一种双位点PbCu电催化剂,用H2C2O4和NH2OH电化学催化合成甘氨酸,原理如图,双极膜中H2O解离的H+和OH-在电场作用下向两极迁移。已知在KOH溶液中,甲醛转化为HOCH2O-,存在平衡HOCH2O-+ OH- [OCH2O]2-+H2O。Cu电极上发生的电子转移反应为[OCH2O]2--e-=HCOO-+H·。下列说法错误的是
A.电解一段时间后阳极区c(OH-)减小B.理论上生成1mlH3N+CH2COOH双极膜中有4ml H2O解离C.阳极总反应式为2HCHO+4OH-- 2e-= 2HCOO-+ H2↑+2H2OD.阴极区存在反应H2C2O4+ 2H++2e-=CHOCOOH+ H2O
H2C2O4+2e-+2H+=OHCCOOH+H2O
HOOCCH=NOH+4e-+5H+=H3N+CH2COOH+H2O
阴极总方程式:H2C2O4+HON+H3+6e-+6H+= H3N+CH2COOH+3H2O
8.(2024·广东T16)一种基于氯碱工艺的新型电解池(下图),可用于湿法冶铁的研究。电解过程中,下列说法不正确的是
A.阳极反应:2Cl--2e-=Cl2↑B.阴极区溶液中OH-浓度逐渐升高C.理论上每消耗1mlFe2O3,阳极室溶液减少213gD.理论上每消耗1mlFe2O3,阴极室物质最多增加138g
Fe2O3+6e- +3H2O= 2Fe+ 6OH-
2Cl--2e- = Cl2↑
两侧均有Na+,且向阴极移动
3×71+6×23=351g
锂电池只允许Li+自由通过
两侧有相同离子的一般可直接判断
复杂模型需结合装置目的及电极反应变化具体分析
①离子迁移种类的判断:依据膜的类型选择性定向移动,平衡电荷②离子迁移方向及电极属性判断:电解池阴阳相吸,原电池正正负负③电极方程式书写:一定注意电解质环境,尤其是质子交换膜,一定需用H+配平电荷
相关课件
这是一份课件:2024届高考化学增分小专题:《剖析离子交换膜在电化学应用中的重要作用》,共60页。
这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池作业课件ppt,共13页。
这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题12 题型专攻4 电化学离子交换膜的分析与应用课件PPT,共23页。PPT课件主要包含了高考化学二轮复习策略,高考必备,真题演练,H2O+2e-,由电极a到电极b,H2O-4e-,O2↑+4H+,考向预测,K2SO4等内容,欢迎下载使用。








