




所属成套资源:湖北省荆州市沙市中学2024-2025学年高三上学期12月月考试题
湖北省荆州市沙市中学2024-2025学年高三上学期12月月考化学试题及答案
展开
这是一份湖北省荆州市沙市中学2024-2025学年高三上学期12月月考化学试题及答案,文件包含湖北省荆州市沙市中学2024-2025学年高三上学期12月月考化学docx、湖北省荆州市沙市中学2024-2025学年高三上学期12月月考化学答案docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
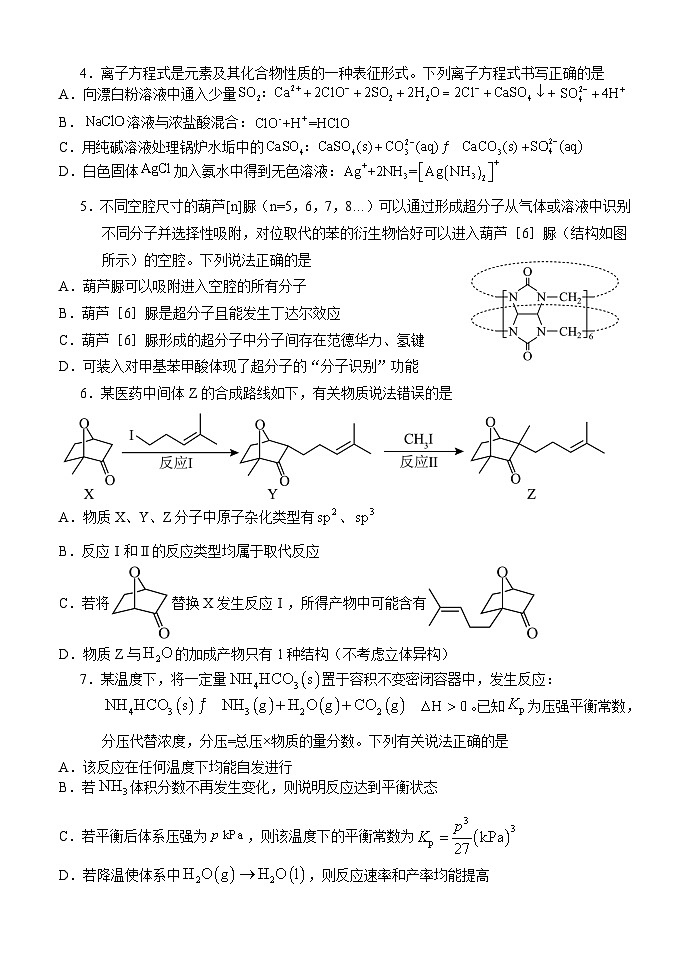
命题人:吴志敏 审题人:蔡艳
考试时间:2024年12月26日
相对原子质量:O 16 Cl 35.5 K 39 Mn 55
一、选择题(本题包括15个小题,每小3分,共45分,每小题只有1个选项符合题意)
1.生活中处处有化学。下列说法正确的的是
A.人体内能量来源腺苷三磷酸(ATP)分子中的磷酸与核糖之间通过磷酸酐键连接
B.利用聚合酶链反应使样本DNA在生物体外扩增,可以快速进行核酸检测
C.顺丁橡胶的硫化交联程度越大,弹性和强度越好
D.用于制作轴承的金刚砂属于传统的硅酸盐材料,具有优异的高温抗氧化性能
2.催化反应广泛存在,如和制(二甲醚)、催化氧化等。催化剂有选择性,如与反应用Ag催化生成(环氧乙烷)、用催化生成。下列说法正确的是
A.合成氨厂采用的压强是20~50MPa,因为该压强下铁触媒的活性最大
B.与反应中,Ag催化能提高生成的选择性
C.制反应中,FeCl3能加快化学反应速率
D.与反应中,能减小该反应的焓变
3.下列化学用语使用正确的是( )
A.Cl2中两个氯原子形成共价键,轨道重叠示意图为
B.BCl3的电子式:
C.碳化硅的分子式:SiC
D.葡萄糖的一种环状结构简式:
4.离子方程式是元素及其化合物性质的一种表征形式。下列离子方程式书写正确的是
A.向漂白粉溶液中通入少量
B.溶液与浓盐酸混合:
C.用纯碱溶液处理锅炉水垢中的
D.白色固体加入氨水中得到无色溶液:
5.不同空腔尺寸的葫芦[n]脲(n=5,6,7,8…)可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
A.葫芦脲可以吸附进入空腔的所有分子
B.葫芦[6]脲是超分子且能发生丁达尔效应
C.葫芦[6]脲形成的超分子中分子间存在范德华力、氢键
D.可装入对甲基苯甲酸体现了超分子的“分子识别”功能
6.某医药中间体Z的合成路线如下,有关物质说法错误的是
A.物质X、Y、Z分子中原子杂化类型有、
B.反应Ⅰ和Ⅱ的反应类型均属于取代反应
C.若将替换X发生反应Ⅰ,所得产物中可能含有
D.物质Z与的加成产物只有1种结构(不考虑立体异构)
7.某温度下,将一定量置于容积不变密闭容器中,发生反应: 。已知为压强平衡常数,分压代替浓度,分压=总压×物质的量分数。下列有关说法正确的是
A.该反应在任何温度下均能自发进行
B.若体积分数不再发生变化,则说明反应达到平衡状态
C.若平衡后体系压强为,则该温度下的平衡常数为
D.若降温使体系中,则反应速率和产率均能提高
8.下列实验装置不能达到实验目的的是
A.用甲装置测定一定质量的和混合物中的质量分数
B.用乙装置测定溶液的浓度
C.用丙装置在铁上镀铜
D.用丁制备晶体
9.下列关于物质结构与性质的说法正确的是
A.缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块
B.O—H…O的键能大于F—H…F的键能,因此水的沸点高于氟化氢的沸点
C.石墨层间靠范德华力维系,因此石墨的熔点较低
D.水晶内部微观粒子呈现周期性有序排列,因此水晶不同方向的导热性相同
10.钠在空气中燃烧,发现其产物中混有黑色物质,某研究小组对黑色物质进行如图所示的实验探究。下列推测错误的是
A.a试管中的现象说明钠的燃烧产物中可能含有
B.b试管的溶液为无色,推测滤液中含有
C.由上述实验现象可得与硫酸反应的离子方程式为
D.滤渣中黑色物质产生的原因可能是
11.物质的氧化性和还原性与溶液有关,具体可用电势图来表征,电势越大,氧化性越强。铬元素的电势图如下图所示,下列说法错误的是
A.被氧化可生成、
B.线的反应为
C.越大氧化性越强
D.时,可与反应生成
12.我国科学家预测了一种N8分子(结构如图)。下列说法错误的是
A.N8中存在离域π键
B.N2和N8互为同素异形体
C.N8转化成N2可以自发进行
D.N8中sp2杂化的N原子均有孤电子对
13.醋酸甲酯制乙醇的反应为:。三个恒容密闭容器中分别加入醋酸甲酯和氢气,在不同温度下,反应t分钟时醋酸甲酯物质的量n如图所示。下列说法正确的是
A.该反应的
B.容器甲中平均反应速率
C.容器乙中当前状态下反应速率
D.容器丙中乙醇的体积分数为
14.我国科学家发现,利用如下装置可以将邻苯二醌类物质转化为邻苯二酚类物质,已知双极膜(膜a、膜b)中间层中的可解离为和。下列说法错误的是
A.M极电极反应式为
B.电极电势:N>M
C.工作一段时间后,装置中需要定期补充和NaOH
D.制取1ml邻苯二酚类物质时,理论上有透过膜a
15.常温下,往足量草酸钙固体与水的混合体系中加或调节时溶质各微粒浓度(M代表、、、)随变化曲线如图所示,其中,虚线④代表的曲线。已知。下列有关说法不正确的是
A.的电离常数
B.用钙离子处理含草酸根离子的废水,应控制大约5~11
C.水的电离程度:
D.时,
二、非选择题(本题包括4个小题,共55分)
16.(14分)中国是世界上最早利用细菌冶金的国家。已知金属硫化物在“细菌氧化”时转化为硫酸盐,某工厂用细菌冶金技术处理载金硫化矿粉(其中细小的Au颗粒被、FeAsS包裹),以提高金的浸出率并冶炼金,工艺流程如下:
含
回答下列问题:
(1)“细菌氧化”中,发生反应的离子方程式为 。
(2)常用于的鉴定,S、C两种元素电负性由大到小的顺序是 ;其对应的酸有两种,分别为硫氰酸()和异硫氰酸(),这两种酸中沸点较高的是 。(填名称)
(3)“焙烧氧化”也可提高“浸金”效率,相比“焙烧氧化”,“细菌氧化”的优势为_____(填标号)。
A.不产生废液废渣B.无需控温
C.设备无需耐高温D.可减少有害气体产生
(4)Au难被氧化,该流程“浸金”中NaCN的作用为 ;通常使用王水也可溶解金,依据此反应原理,也可以使用盐酸和溶液将单质金转化为,写出该转化的化学方程式 。
(5)滤液②经酸化,转化为和HCN的化学方程式为 。
17.(13分)乙醇是燃料,也是重要的有机化工原料,二氧化碳加氢还原制乙醇已成为研究热点,相关的反应如下:
反应i:
反应ii:
反应iii:
请回答下列问题:
(1)已知的燃烧热()为,表示燃烧热的热化学方程式为 。
(2)在一定温度下,向恒容密闭容器中充入和,在某催化剂作用下发生上述反应,测得含碳元素物质占比[如]与时间的关系如图所示:
已知:反应i为快反应,其平衡的建立可认为不受慢反应ii、iii的影响,即可认为反应i建立平衡后始终处于平衡状态。
①表示乙烯占比的曲线是 (填“a”“b”或“c”)。
②若选择对反应i催化效果更好的催化剂,则A点可能移向 (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应iii的平衡常数 L/ml(保留小数点后一位)。
④设反应i和反应ii的化学平衡常数分别为、,适当升温后,增大,理由是
。
(3)我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将转化为乙烯,其装置如图所示。
①阴离子透过交换膜往 (填“左”或“右”)移动。
②纳米Cu上发生的电极反应为 。
18.(14分)兴趣小组比较氧气的两种实验室制法(分别以KClO3和KMnO4为原料)并探究反应产物。实验装置和数据记录如下:
注:实验中,棉花均未发生变化,水槽中为蒸馏水。
(1)依据初中所学,实验i中制备O2的原理是 (用化学方程式表示)。
(2)经检验,实验i中生成的气体仅有O2。
①实验i中,生成O2反应的化学反应速率 = ml·min-1。
②实验i中,反应后剩余固体的总质量比理论计算值要小。结合氧化还原规律和化学方程式推测,固体产物中锰元素的平均化合价 (填“大于”“等于”或“小于”)5。
(3)小组同学发现实验ⅱ制备的气体有刺激性气味。取出导气管,用湿润的淀粉-KI试纸检验实验ⅱ中加热后产生的气体,试纸先变蓝,后褪色。
①甲同学认为可能是高浓度O2使淀粉-KI试纸变蓝,该说法的合理之处是 。对照实验后排除了这种可能性。
②乙同学推测实验ⅱ产生的气体中含有少量Cl2。验证方法:将实验ⅱ产生的气体通入蒸馏水中,加入 ,有白色沉淀生成。
③丙同学查阅资料,ClO2是具有刺激性气味的气体,光照条件下能与水反应生成盐酸和HClO3。丙同学认为,乙的方法不能说明实验ⅱ产生的气体中含有Cl2,理由是 (结合化学方程式说明)。
(4)上述两种方法制备氧气的优势与劣势分别为 (任选一种方法分析即可)。
19.(14分)碳骨架的构建是有机合成的重要任务之一。某同学从基础化工原料乙烯出发,针对二酮H设计了如图合成路线:
已知:
1)RMgX+;2);
3)。
回答下列问题:
(1)由A-B的反应中,乙烯的碳碳 键断裂(填“”或“”)。
(2)D的同分异构体中,与其具有相同官能团的有 种(不考虑对映异构),其中核磁共振氢谱有三组峰,峰面积之比为9:2:1的结构简式为 。
(3)E与足量酸性溶液反应生成的有机物的名称为 、 。
(4)G的结构简式为 。
(5)已知:,H在碱性溶液中易发生分子内缩合从而构建双环结构,主要产物为I()和另一种,-不饱和酮J,J的结构简式为 。若经此路线由H合成I,存在的问题有 。
A.原子利用率低 B.产物难以分离 C. 反应条件苛刻 D.严重污染环境实验
反应前
充分反应后
耗时
m(试剂)
m(试管)
m(试管+固体)
i
15.80 g KMnO4
40.00 g
53.88 g
50 min
ii
12.25 g KClO3 + 4.00 g MnO2
40.00 g
51.34 g
5 min
相关试卷
这是一份湖北省荆州市沙市中学2024-2025学年高一上学期11月月考化学试卷(Word版附答案),共8页。试卷主要包含了1 ml氧气转移的电子数为0,5 g·ml-1,63倍等内容,欢迎下载使用。
这是一份湖北省荆州市沙市区沙市中学2024-2025学年高三上学期11月月考化学试题,共11页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份湖北省沙市中学2024-2025学年高三上学期10月月考化学试题,共16页。试卷主要包含了8℃,熔点为-126等内容,欢迎下载使用。









