

广西壮族自治区部分学校2024-2025学年高二上学期期中联考化学试卷(含答案)
展开
这是一份广西壮族自治区部分学校2024-2025学年高二上学期期中联考化学试卷(含答案),共14页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
一、单选题
1.化学与生产、生活密切相关,下列说法正确的是( )
A.天然气燃烧是由热能转化为化学能
B.煤炭、石油、潮汐能均属于可再生能源
C.燃煤时,添加生石灰是为了减少二氧化碳的排放
D.氢气燃烧的产物是水,氢气是一种理想的清洁燃料
2.下列物质在水中的电离方程式书写错误的是( )
A.B.
C.D.
3.下列过程的能量变化与如图所示能量变化相符合的是( )
A.浓硫酸的稀释B.碳酸氢钠粉末溶于水
C.生石灰溶于水D.金属钠与水的反应
4.下列物质属于电解质的是( )
A.硫酸钡固体B.二氧化碳C.饱和食盐水D.澄清石灰水
5.对于工业合成氨的反应,下列措施有利于加快反应速率的是( )
A.降低温度B.减小的浓度
C.及时抽走部分氢气D.加入适宜的催化剂
6.下列溶液一定呈中性的是( )
A.pH=7的溶液B.不能大量存在的溶液
C.的溶液D.能与固体反应的溶液
7.反应实际上是经过了两步反应完成的:
①(慢);
②(快)。
下列说法错误的是( )
A.的寿命较短B.步骤②需要吸收能量
C.HI分解过程包含两个基元反应D.该反应属于分解反应
8.常温下,氨水中存在,下列说法正确的是( )
A.氨水能使酚酞溶液变蓝
B.适当升高温度,有利于的生成
C.往氨水中加入适量的水,增大,减小
D.加入少量的氢氧化钠稀溶液,氨水的电离平衡常数减小
9.常温下,将的溶液加水稀释至,下列说法错误的是( )
A.稀释后的溶液中,约为
B.稀释前后的溶液中均存在:
C.溶液与稀盐酸的反应为放热反应
D.理论上,稀释后的溶液可与的硫酸溶液恰好完全反应
10.设为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下,中,所含的原子总数为
B.标准状况下,中,所含的电子总数为
C.常温下,的溶液中,所含的数目为
D.常温下,1LpH=1的溶液中,所含的总数为
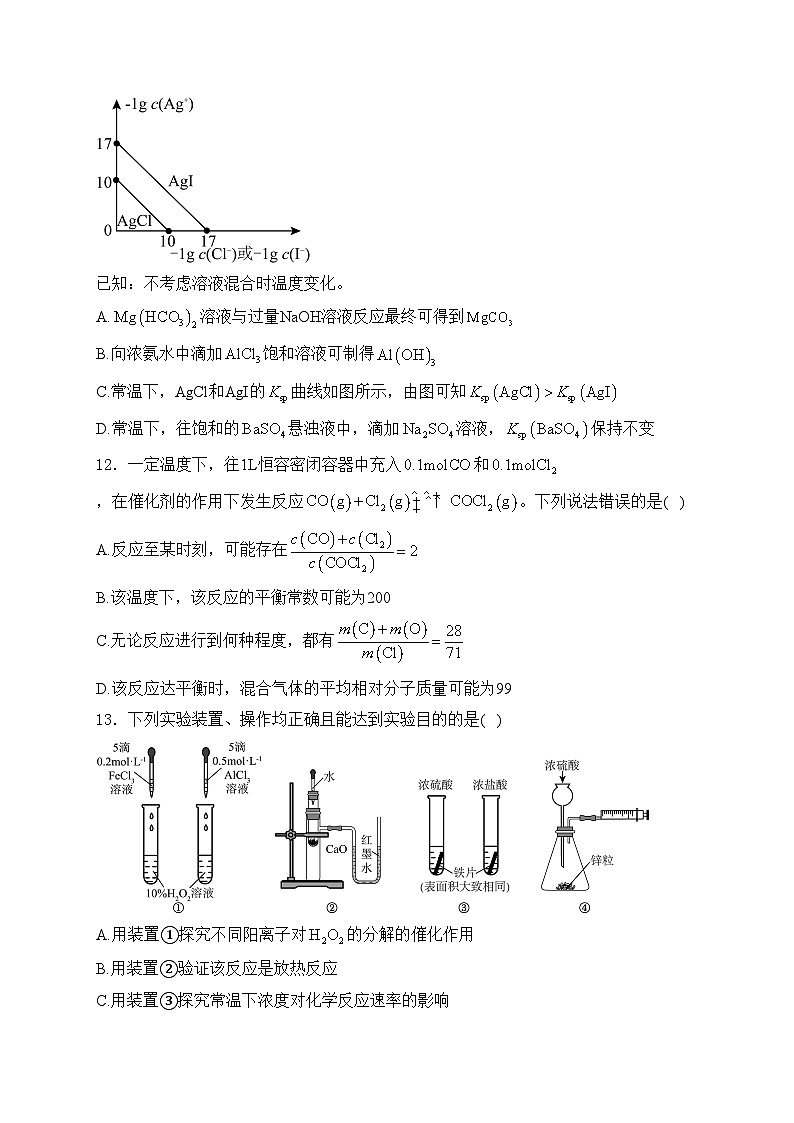
11.下列说法错误的是( )
已知:不考虑溶液混合时温度变化。
A.溶液与过量NaOH溶液反应最终可得到
B.向浓氨水中滴加饱和溶液可制得
C.常温下,AgCl和AgI的曲线如图所示,由图可知
D.常温下,往饱和的悬浊液中,滴加溶液,保持不变
12.一定温度下,往1L恒容密闭容器中充入和,在催化剂的作用下发生反应。下列说法错误的是( )
A.反应至某时刻,可能存在
B.该温度下,该反应的平衡常数可能为200
C.无论反应进行到何种程度,都有
D.该反应达平衡时,混合气体的平均相对分子质量可能为99
13.下列实验装置、操作均正确且能达到实验目的的是( )
A.用装置①探究不同阳离子对的分解的催化作用
B.用装置②验证该反应是放热反应
C.用装置③探究常温下浓度对化学反应速率的影响
D.用装置④测定锌与稀硫酸的反应速率
14.常温下,往溶液中滴入溶液,溶液pH与滴入NaOH溶液体积的关系如图所示。下列说法正确的是( )
已知:。
A.a点溶液中,
B.b点溶液中,
C.c点溶液中,
D.a→c的滴定过程中,可能存在
二、填空题
15.磁选后的炼铁高钛炉渣,主要成分有以及少量的。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
常温下,有关金属离子开始沉淀和沉淀完全的pH见下表:
已知:“焙烧”中,几乎不发生反应,转化为相应的硫酸盐。
回答下列问题:
(1)为了加快“焙烧”速率,可采用的物理方法为________(填一种即可)。
(2)“焙烧”时,转化为。
①在水中的电离方程式为________。
②在的溶液中,________(填“>”或“”或“”“”“
(3)
(4)油浴
(5)
(6)
解析:(1)为了加快“焙烧”速率,可采用的物理方法为:粉碎或搅拌;
(2)①在水中的电离方程式为:;
②由电离方程式可知,若不水解,则,但会水解,则;
(3)由题给开始沉淀和完全沉淀的pH可知,将pH约为2.0的滤液加入氨水调节溶液pH为11.6时,铁离子首先沉淀、然后是铝离子、镁离子,钙离子没有沉淀;
(4)水浴加热温度不能高于100℃,水浸渣在160℃“酸溶”,最适合的加热方式为:油浴;
(5)水解析出沉淀,离子方程式为:;
(6)根据完全沉淀的pH值为10.9,完全沉淀时浓度为,故。
16.答案:(1);
(2)
(3)22;2.25或
解析:(1)由盖斯定律可知,反应iii=,则;;
(2)①由图可知压强不变时,随温度的升高CO的平衡转化率降低,可知升温平衡逆向移动,则;该反应,则反应在低温条件下有利于自发进行;
②由反应可知,氧元素只存在于气体物质中,根据质量守恒可知各对应点的混合气体中氧元素的质量相等;
③c点温度高于b点,该反应为放热反应,温度越高K越小,则平衡常数b>c;
(3)①反应前后各元素质量守恒,则混合气体中;;;;
②结合已知条件列三段式:(设平衡时CO的变化量为xml)
,解得:x=0.24;
该反应的平衡常数或。
17.答案:(1);
(2)变大;变大;变大;1
(3)11.3
解析:(1)为弱电解质,在水溶液中只发生部分电离,电离方程式为:;该反应的平衡常数表达式为;
(2)①常温下,将氨水加水稀释至的过程中变小,则变大,溶液体积也增大,故变大;
18.答案:(1)检查装置气密性
(2)圆底烧瓶
(3)b进a出;冷却效果更好
(4);;当滴入最后半滴NaOH标准溶液时,溶液由无色变为浅红色,且30s内颜色保持不变;0.2048
解析:(1)进行该实验时,为防止气体溢出,应先检查装置气密性;
(2)由实验装置图可知,仪器c的名称为圆底烧瓶;
(3)冷凝管中的冷凝水都是下进上出,故应该是b进a出;原因是,水能充满整个冷凝管,冷却效果更好;
(4)ⅰ.与反应生成硫酸,反应方程式为:,则离子方程式为,中氧元素化合价降低,则为氧化剂;
ⅱ.①氢氧化钠标准溶液滴定稀硫酸,酚酞为指示剂,滴定终点溶液呈浅红色,则到达滴定终点的标志是当滴入最后半滴NaOH标准溶液时,溶液由无色变为浅红色,且30s内颜色保持不变;
②根据可知的质量为:(0.0800ml/L×0.020L)×64g/ml=0.0512g,该葡萄酒中的二氧化硫含量为:0.0512g÷0.25L=0.2048g/L;
金属离子
开始沉淀()的pH
1.5
3.4
8.9
12.0
沉淀完全()的pH
2.8
4.7
10.9
13.8
相关试卷
这是一份广东省部分学校2024-2025学年高二上学期第一次联考化学试卷(含答案),共21页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份湖南省市县部分学校2024-2025学年高二上学期11月期中联考化学试卷(含答案),共18页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份广东省部分学校2024-2025学年高二上学期期中联考 化学试题,共16页。试卷主要包含了选择题的作答,非选择题的作答,化学之美无处不在,已知,室温下,向20,设为阿伏加德罗常数的值等内容,欢迎下载使用。








